靶向探针追踪A β25-35的亚细胞定位并基于Nrf2通路探讨阿里红多糖对线粒体损伤的保护机制
阿依江·哈拜克,王晓梅,闫 冬,李 敏,帕丽达·阿不力孜
新疆医科大学药学院,乌鲁木齐830011
阿尔茨海默病(Alzheimer’s disease,AD)是一种神经退行性疾病,以认知功能障碍为主要临床表现[1]。对于AD的发病机制目前有诸如氧化应激假说[2]、线粒体损伤学说[3]、Aβ毒性学说等等[4],并且发现Aβ沉积,神经炎症的发生,氧化应激都会引起线粒体损伤,最终导致神经元凋亡[5,6],因此,线粒体损伤通路与多种学说交叉,研究意义至关重要。
阿里红(FomesoffcininalisAmes,FOAPs)为多孔菌科药用层孔菌的干燥子实体。阿里红多糖作为阿里红主要有效成分之一具有抗衰老、抗氧化、抗肿瘤、免疫调节等功效[7,8]。课题组前期将阿里红多糖经DEAE纤维素-52,Sepharose CL-6B和葡聚糖凝胶Sephadex G-100柱层析分离纯化得到两种多糖组分FOAPs-a与FOAPs-b[9]。本课题组一直着力于阿里红多糖对AD线粒体靶向性治疗的研究,发现在Aβ25-35诱导的PC12细胞中,阿里红多糖给药组相对于模型组具有显著改善线粒体损伤的作用,包括ATP含量和线粒体膜电位MMP上升,ROS含量下降,线粒体内细胞色素含量C回升等,表明,阿里红多糖对AD模型中,线粒体损伤通路和氧化应激损伤均具有一定程度的改善作用,本实验拟从Aβ25-35与PC12细胞的线粒体荧光共定位角度出发[10-12],探讨阿里红多糖组分FOAPS-a和FOAPs-b可通过参与Nrf2氧化还原信号通路,从而发挥对PC12细胞线粒体损伤的保护作用。
1 材料与方法
1.1 材料与试剂
小鼠瘤细胞(PC12细胞)购自中国科学院上海生命科学研究院细胞资源中心;阿里红多糖组分(新疆医科大学药学院天药生药教研室提取自用);Aβ25-35蛋白(Genscript,南京);FBS胎牛血清(Hyclone公司);DMEM高糖培养基(Hyclone,公司);双抗(Hyclone 公司);盐酸多奈哌齐(Sigma公司),FAM-Aβ25~35荧光(Genscript,南京);Cy3标记羊抗兔IgG(武汉博士德生物工程有限公司);COXIV(Proteintech,武汉);ROS检测试剂盒(碧云天公司);兔多抗Bcl-2抗体(Genetex公司)、兔多抗Bax抗体(武汉三鹰生物技术有限公司)、兔多抗Nrf2(Absin,Abs130481)、兔多抗P-ASK1(Absin,Abs131102)、兔多抗ASK1(美国Cell signaling,批号8662)、兔单克隆抗GAPDH抗体(美国Abcam公司,Ab8245)。
1.2 实验仪器
CO2恒温培养箱(美国Thermo公司);SWCJ2F超净台(AIRTECH公司);IX71~12FL/PH 倒置荧光研究级三目显微镜(日本Olympus公司);721BR13868凝胶成像系统(美国Bio-Rad公司);流式细胞仪(FACSAriall,北京Scotsman公司);激光共聚焦显微镜(德国ZEISS公司)。
1.3 实验方法
1.3.1 药物处理
1.3.1.1 Aβ25-35寡聚体的制备及实验条件的选择
称取药物Aβ25-351 mg,用471.6 μL溶剂水溶解成浓度为2 mM的母液待用,母液于-20 ℃保存;分装Aβ25-35母液,在使用前取适量于37 ℃震荡孵育8天,使多肽聚集。
1.3.1.2 FOAPs-a及FOAPs-b溶液的制备与实验条件的选择
采用水提醇沉法提取阿里红粗多糖,经DEAE纤维素-52,Sepharose CL-6B和葡聚糖凝胶Sephadex G-100柱层析对粗多糖进行纯化得到均一多糖组分FOAPs-a,FOAPs-b[9],平均分子量分别为199和87 kDa。用DMEM培养基充分溶解,PC12细胞干预时用不含血清的培养基稀释到所需浓度。
1.3.2 PC12细胞的培养和分组
按照预实验确定的给药及损伤的浓度和时间,取对数生长期的PC12细胞以1× 104个/孔接种至96孔板,在培养箱孵育24 h,待细胞密度长到75%左右时,分为空白组(只加培养液)、模型组(加入40 μmol/L Aβ25-35)、阳性药物组(50 μmo/L盐酸多奈哌齐)、高、中、低浓度的 FOAPs-a及FOAPs-b干预组(各50、100、200 μg/mL)等。
1.3.3 细胞爬片免疫荧光单标实验
1.3.3.1 细胞处理
取处于对数生长期的PC-12细胞,用DMEM培养基调整细胞密度到105个/mL,接入六孔板,每孔2 mL细胞悬液,同时设空白孔,37 ℃培养24 h,弃上清,分正常组(加不含血清的培养基);模型组(40 μmol/L FAM-Aβ25-35);给药组(加入DMEM配置的200 μg/mL FOAPs-a/b应用液处理2 h,再加FAM-40 μmol/L Aβ25-35共同孵育培养48 h。
1.3.3.2 免疫荧光
将细胞玻片用PBS浸洗3 min×3次;用4%的多聚甲醛固定爬片15 min,PBS浸洗;0.5% Triton X-100(PBS配制)室温通透20 min;PBS浸洗,吸水纸吸干,在玻片上滴加正常山羊血清,室温封闭30 min;吸水纸吸干,不洗,滴加足量一抗(稀释比1∶100),4 ℃孵育过夜;PBST 浸洗吸干,滴转移暗处,加荧光二抗(稀释比1∶100),37 ℃孵育1 h,PBST浸洗3次。滴加DAPI避光孵育5 min进行染核,PBST 浸洗5 min×4次,吸水纸吸干,抗荧光淬灭剂封片,荧光显微镜采集图像。
1.3.3 活性氧自由基ROS检测
收集细胞,按照DCFH-DA细胞ROS检测试剂盒操作:按照1∶1 000用无血清培养液稀释DCFH-DA,使终浓度为10 μmol/L,体积;弃PBS加入稀释好的DCFH 1 mL;37℃培养箱孵育20 min,每隔3 min混匀一次;用无血清培养基体积洗涤细胞3次。1 500 rpm,5 min离心,弃上清,加PBS重悬;流式细胞仪机检测。
1.3.4 Western blotting检测Bcl-2、Bax、Nrf2、APK1及P-APK1的蛋白表达量
将对数生长期的PC12细胞以(2×105个/孔)接种到6孔板中,分组方法同上。24 h后用预冷的PBS洗三遍,收集细胞离心,并加入适当的RIPA裂解液吹打混匀,在冰上静止30 min左右,裂解完全后,4 ℃、12 000 rpm离心12 min,取上清即为提总蛋白。用BCA蛋白定量试剂盒测定各组蛋白浓度,经过煮蛋白、上样、电泳、转膜、封闭、孵育一抗:兔多抗Bcl-2抗体(1∶1 000),兔多抗Bax抗体(1∶1 000),兔多抗Nrf2(1∶1 000),兔多抗P-ASK1(1∶ 1 000),兔多抗ASK1(1∶1 000),兔单克隆抗GAPDH抗体(1∶1 000)过夜、用1×TBST洗膜三次后,室温孵育AP标记二抗(1∶1 000)1 h、显色液显色,条带出现后定影终止,对目的蛋白和内参蛋白条带进行总灰质分析。
1.3.5 统计学处理
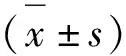
2 结果
2.1 荧光探针追踪A β25-35在线粒体中的表达结果
如图图1A和1B:与空白组比较,模型组细胞内红色荧光强度明显减弱,且出现较强的绿色荧光,绿色和红色荧光叠加出现黄色荧光,表明Aβ25-35与线粒体共定位;观察单个PC12细胞周边荧光强度,发现红色荧光强度明显减弱,表明线粒体的完整性受到影响,细胞核形态畸形;与模型组相比,在200 μg/mL FOAPs-a 和FOAPs-b预处理PC12细胞后,细胞核形态趋于正常,Aβ25-35的绿色荧光强度明显减弱,红色荧光强度增强,红色荧光强度与绿色荧光强度的比值IOD差异有统计学意义(P<0.05,图1C)。
图1 激光共聚焦显微镜下的荧光共定位结果
2.2 活性氧自由基ROS含量检测结果
活性氧自由基ROS检测结果显示:与空白组比较,模型组细胞中ROS沉积量明显增加;与模型组比较,各浓度的FOAPs-a及FOAPs-b均能显著降低ROS的含量,且具有浓度依赖性,差异有统计学意义(P<0.05),阳性对照组显示盐酸多奈哌齐(DHCL)具有良好的抗Aβ25-35诱导的氧化应激的作用;FOAPs-a和FOAPs-b在浓度50、100和200 μg/mL时,均具有良好的抗氧化应激的作用,但仍未恢复到阳性对照盐酸多奈哌齐(DHCL)的影响水平(P<0.05,图2)。

图2 检测阿里红多糖组分对PC12细胞ROS的影响
2.3 Western blotting检测结果
2.3.1 Bcl-2和Bax蛋白表达结果
如图3 Western blotting结果显示:与空白组比较,Aβ25-35诱导的模型组细胞中,Bcl-2蛋白的表达量显著性下降,而Bax蛋白表达量则明显增加,即Bcl-2/Bax的相对表达率下降(如图4所示),差异有统计学意义(P<0.05);与模型组比较,不同浓度的FOAPs-a及FOAPs-b均能显著增加Bcl-2的表达量,同时显著降低Bax蛋白的表达水平,并具有浓度依赖性,结果表明,FOAPs-a及FOAPs-b可以通过调控细胞凋亡因子对Aβ25-35诱导的PC12细胞发挥抗氧化应激作用,从而起到神经保护作用,且FOAPs-a比FOAPs-b的调控能力更好。

图3 不同处理组Bcl-2和Bax蛋白表达情况
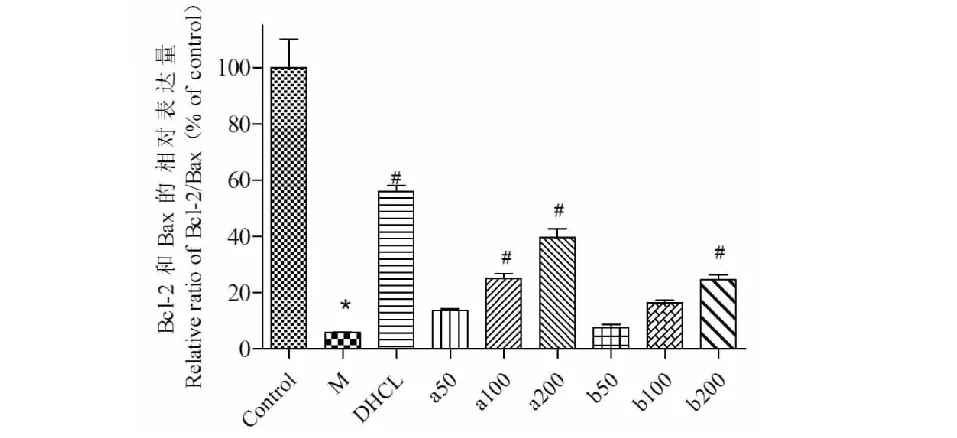
图4 不同处理组Bcl-2和Bax蛋白相对表达量(Bcl-2/Bax)统计柱状图
2.3.2 Nrf2、ASK1和P-ASK1的表达
为了观察阿里红多糖组分保护PC12细胞对抗Aβ25-35引起的氧化应激和线粒体损伤的作用机制可能是ASK1凋亡途径激活Nrf2信号通路。以50、100、200 μg/mL阿里红多糖组分FOAPs-a和FOAPs-b对PC12细胞进行干预处理2 h后,再加入40 μmol/L Aβ25-35继续培养48 h后,用蛋白免疫印迹法检测细胞中Nrf2和ASK1的蛋白表达水平及ASK1蛋白的去磷酸化程度,结果显示(图5):与空白组比较,40 μmol/L Aβ25-35处理组中细胞凋亡信号调节激酶 1(APK1)蛋白表达量增加,APK1的磷酸化水平升高,Nrf2被激活;与模型组比较,50、100、200 μg/mL的FOAPs-a及100、200 μg/mL FOAPs-b干预后,ASK1蛋白含量显著下降,ASK1的磷酸化水平也下降,差异具有统计学意义(P<0.05,图6),50 μg/mL FOAPs-b干预后,蛋白表达量无统计学意义。与此同时,Nrf2的蛋白表达量显著增加,且呈现浓度依赖性,表明阿里红多糖组分FOAPs-a和FOAPs-b可以通过ASK1凋亡途径激活Nrf2信号通路拮抗Aβ25-35诱导的PC12细胞的氧化应激和线粒体损伤,且高剂量FOAPs-a和FOAPs-b干预可以发挥更强的抗氧化和抗细胞凋亡作用。

图5 不同处理组Nrf2、ASK1和P-ASK1蛋白表达情况

图6 不同处理组Nrf2、ASK1和P-ASK1蛋白平均光密度值比值(与GAPDH)统计柱状图
3 讨论
在生理情况下,线粒体在人体功能正常状态下,其功能主要是维持ROS的生成和去除处于一个平衡状态。在病理情况下,ROS不能够及时被清除,可能导致ROS沉积,这可能与线粒体受损有关[13]。反过来ROS浓度过高,一方面影响了线粒体的正常运转,促使体内氧化应激反应的大量产生,进而造成神经元损伤,甚至导致患者死亡;另一方面,ROS聚集还会造成Aβ的超量。有学者研究证实Aβ的沉积会直接导致神经元的损伤,而受损的线粒体中产生大量氧化应激反应,促使淀粉样前体蛋白APP更易分解为不溶性的Aβ。课题组前期研究体内实验发现,阿里红提取物对Aβ25-35致痴呆动物模型学习记忆障碍有一定的改善作用[14],阿里红多糖组分对APP/PS1双转基因小鼠行为学有影响[15]。本研究预实验结果显示,相比空白组,用40 μmol/L Aβ25-35诱导的PC12细胞中ROS大量聚集,数量显著性增多,Aβ25-35打破了ROS的动态平衡,产生了氧化应激相关指标SOD,MDA,LDH的异常,进而出现一系列AD的症状,说明Aβ25-35造成PC12细胞的线粒体损伤;然后在这个AD模型中用不同浓度的阿里红多糖组分FOAPs-a和FOAPs-b给药后,组内ROS聚集情况得到了显著的改善,且能显著增加Bcl-2的表达量,同时显著降低Bax蛋白的表达水平,各组内呈现浓度依赖性,组间比较后发现FOAPs-a对线粒体功能的改善作用要优于FOAPs-b的效果。同时,荧光探针共定位实验和WB检测凋亡蛋白结果进一步证实:Aβ25-35的确可以进入到PC12细胞的线粒体当中,诱导其线粒体的形态和数量发现不同程度的改变,并加速细胞凋亡,而FOAPs-a和FOAPs-b给药组则可以改善线粒体的损伤程度和抑制细胞的凋亡。
文献报道,线粒体功能障碍和氧化应激是AD的重要病理特征,过度氧化应激反应会导致氧化还原通路Nrf2的激活。近年来研究发现Nrf2(nuclear related factor 2)是一种重要的核转录因子,在细胞抗氧化应激反应中起着很重要的作用[16]。在生理条件下,Nrf2处于惰性状态,当机体在病理条件下,Nrf2被激活与抗氧化反应元件(antioxidant responseelement,ARE)结合,从而启动一系列的抗氧化物质的合成来对抗氧化应激[17];另外,Nrf2诱导产生的血红素加氧酶(HO-1)具有神经保护作用,HO-1催化血红素生成的产物亦是体内强有力的ROS清除剂,对Aβ诱导的细胞毒性发挥重要的神经保护作用[18],过表达Nrf2的神经元能够减轻Aβ毒性损伤,上调Nrf2目标基因的表达从而减少氧化应激的发生[19]。细胞凋亡信号调节激酶 1(ASK1)是高度保守的MAP3Ks 家族成员之一,ASK1被激活后能够将MKK3/MKK6-p38和MKK4/MKK7-JNK两大激酶通路激活,最终诱导细胞发生凋亡[20]。研究发现很多调控因子与ASK1直接结合调控其活性,ASK1去磷酸化则活化,从而导致细胞凋亡发生[21]。本实验中WB结果显示:与模型组比较FOAPs-a及FOAPs-b均能减少APK1的磷酸化和上调Nrf2的蛋白表达,说明两种阿里红多糖组分FOAPs-a和FOAPs-b均能够激活Nrf2蛋白的表达,参与氧化还原信号通路,对抗AD中的氧化应激反应,在一定程度上改善线粒体损伤进而缓解氧化应激损伤,揭示阿里红多糖线粒体保护作用的分子机制。
综上所述,阿里红多糖组分可抑制Aβ25-35诱导PC12细胞的线粒体损伤和细胞凋亡的产生,对AD模型的线粒体损伤通路和氧化应激损伤均具有一定程度的改善作用,推测阿里红多糖可能参与氧化应激损伤通路,发挥对线粒体的保护作用,但其详细的机制仍需深入研究。

