Ag与Ag2O协同增强TiO2光催化制氢性能的研究
王 苹,李心宇,时占领,李海涛
Ag与Ag2O协同增强TiO2光催化制氢性能的研究
王 苹,李心宇,时占领,李海涛
(武汉理工大学 化学化工与生命科学学院, 武汉 430070)
本研究采用两步法制备了电子助剂Ag和界面活性位点Ag2O共修饰的高效TiO2光催化剂(TiO2/Ag-Ag2O): 首先用光沉积法将Ag负载在TiO2表面(TiO2/Ag), 再经过低温煅烧法使部分Ag原位生成Ag2O。紫外光照射TiO2时, 激发产生的电子被助剂Ag捕获后快速传输到Ag2O上, 电子把Ag2O界面产氢活性位点从溶液中所捕获的氢离子还原成氢气, Ag和Ag2O的协同作用加快了TiO2上光生电子的转移和界面产氢反应, 从而提高了TiO2/Ag-Ag2O制氢性能。在300 ℃煅烧温度下制备的TiO2/Ag-Ag2O光催化剂制氢速率最高, 达到75.20 μmol/h, 分别是TiO2(3.59 μmol/h)和TiO2/Ag(41.13 μmol/h)的21.0倍和1.8倍。本研究为光催化制氢材料的设计和制备提供了有益的参考。
TiO2; 电子助剂; 界面活性位点; 协同作用; 光催化制氢
随着社会生产力的发展, 人类对能源的需求量日益增大, 但是能源与环境平衡的问题也不容忽视。在能源危机和环境污染的双重压力下, 各国科学家纷纷将研究的重点转向新型清洁能源的开 发[1-4]。氢能因产热高、储量大、清洁无污染等优点受到了各国科学家的青睐[5-6]。在各类制氢技术中, 由Fujishima等[7-10]开创的光催化制氢技术具有反应条件温和、能耗低、操作简便等优势, 成为一项具有巨大应用潜力的新型制氢技术。作为光催化剂, TiO2的性能稳定、无毒, 并具有抗光腐蚀等优点, 但光生电子–空穴对极易复合, 导致其制氢效率较低[11-12]。目前可以通过形貌控制[13]、离子掺杂[14]、半导体复合[15]和助剂修饰[16]等方法对TiO2改性。其中, 助剂表面修饰用量少、条件温和, 并且对主 体材料结构影响很小, 是一种常见、有效的改性 手段。
已有研究[17-19]表明, 以金属纳米粒子作为电子助剂修饰改性TiO2是一种提高光催化性能的有效方法。但在大多数情况下, 金属材料(除Pt以外)本身都不能作为有效的界面催化活性位点, 导致迁移到金属表面的电子不能及时与吸附在材料表面的H+发生还原反应生成H2, 使金属修饰的TiO2光催化材料表现出较低的界面析氢速率, 并成为整个反应过程中的控速步骤, 最终制约了整体制氢效率。最近研究表明[20-21], 在金属电子助剂表面增加金属氧化物或硫化物等作为界面催化活性位点协同修饰改性光催化剂是一种提高光催化性能的有效方法。但由于一般在半导体光催化材料表面修饰的金属颗粒比较小, 往往是纳米级别的小颗粒, 很难大量吸附作为界面活性位点的基团或离子。而且, 如果金属电子助剂和界面活性位点之间是以物理吸附方式结合, 相互作用力较弱, 结合不够牢固, 仍然会影响光生电子的快速传输以及随后的界面催化产氢反应, 不能明显改善光催化制氢性能。因此, 发展新型界面催化活性位点, 促进其界面产氢催化反应, 对于提高半导体/电子助剂光催化材料体系的制氢性能至关重要。
在金属表面定向生成可作为界面催化活性位点的物质, 可以使两者紧密结合, 进而改善电子的传输。考虑到Ag2O有一定的吸氢能力, 而且可以在Ag与氧气发生反应时原位生成, 使Ag2O与Ag之间存在很强的亲和力, 本研究设计了在TiO2光催化材料表面光沉积Ag后煅烧再生成Ag2O的方法, 制备了电子助剂Ag和界面活性位点Ag2O共修饰的TiO2光催化材料(TiO2/Ag-Ag2O), 测试了TiO2/Ag- Ag2O光催化剂的制氢性能, 并研究了其光催化制氢机理。
1 实验方法
1.1 主要试剂
商业P25 TiO2购于Degussa公司, AgNO3、甲醇和乙醇购于上海化学试剂公司, 均为分析纯。实验过程中用水均为去离子水。
1.2 样品制备
1.2.1 TiO2-C的制备
将装有一定量的P25 TiO2的坩埚放入马弗炉中, 然后以5 ℃/min的速率升到550 ℃并煅烧2 h, 冷却后取出坩埚,得到TiO2-C。
1.2.2 TiO2/Ag的制备
在三颈烧瓶中将200 mg TiO2粉末分散到80 mL 10vol%的甲醇溶液中, 磁力搅拌10 min, 得到均匀分散的白色悬浊液; 随后, 在上述TiO2悬浊液中缓慢滴加186 µL 0.10 mol/L的AgNO3溶液。搅拌混合液60 min, 通氮气15 min, 然后用4个紫外光灯(3 W, 365 nm)照射上述悬浊液, 触发Ag+的还原反应。照射60 min后, 经过滤、洗涤和干燥, 得到棕红色的TiO2/Ag复合光催化剂。
1.2.3 TiO2/Ag-Ag2O的制备
将80 mg TiO2/Ag样品放置于带有盖子的瓷舟中, 放入马弗炉中煅烧, 以10 ℃/min的速度上升至设定温度(200, 250,300,350,400 ℃)。煅烧结束后, 立即从炉子中取出产物并密封, 将其冷却至室温, 即得TiO2/Ag-Ag2O光催化复合材料, 标记为TiO2/Ag-Ag2O(), 其中=200, 250,300,350,400, 表示煅烧温度。
1.3 光催化制氢性能测试
参考本课题组的方法[16]对材料进行制氢性能测试, 具体操作步骤为: 在100 mL的三口平底烧瓶中, 将50 mg光催化剂样品分散到80 mL 25vol%的乙醇溶液牺牲剂中, 通氮气15 min。将密封的反应容器放置在距离光源(4个365 nm的LED灯) 1 cm的位置进行照射, 同时进行搅拌。每间隔30 min测1次氢气含量, 测试120 min, 直至产氢稳定。气相色谱仪(岛津GC-2014C)的载气为氮气, 配置TCD检测器和0.5 nm分子筛毛细管柱。
1.4 电化学测试
采用标准三电极系统电化学工作站(CHI660E)采集电化学数据, 对电极为Pt, 参比电极为CHI150型Ag/AgCl, 电解质溶液为0.5 mol/L Na2SO4溶液。采用旋涂方法将光催化剂涂布在导电玻璃(FTO)的表面制备工作电极, 具体步骤为: 在由1.5 mL的萘酚D-520溶液(5wt%)和1 mL无水乙醇制得的混合溶液中加入4 mg样品, 然后使用旋转涂膜仪将超声后的悬浮液均匀涂抹在FTO上, 室温下放置1 h后, 在40 ℃下烘24 h。工作电极(-)的线性扫描范围为0~–1.6 V, 扫描速度为0.001 V/s。测试工作电极的光电流(-)光源为LED灯(3 W,=365 nm, 80 mW/cm2), 电压为0.5 V, 循环光照4次, 每次光照间隔60 s。测试工作电极的电化学阻抗的初始电压为开路电势, 扫描范围为0.001~ 106Hz。
1.5 样品表征
采用X射线衍射仪(XRD, Rigaku Ultima Ⅲ)测定样品的晶型; 采用场发射扫描电子显微镜(FESEM, JEOL JSM-7500)和透射电子显微镜(TEM, JEOL JEM-2100F)对样品的形貌特征进行研究观察; 采用紫外–可见分光光度计(UV-Vis, Shimadzu UV- 2450)、以BaSO4为标样测试样品的紫外–可见漫反射光谱; 采用X射线光电子能谱仪(XPS, KRATOA XSAM800, Al Kα靶)检测样品表面化学元素, 标准碳元素峰C 1s 284.6 eV为所有样品元素结合能的参考标准。采用日本Hitachi公司的F-7000型荧光光谱仪测定样品的荧光光谱, 激发波长为350 nm。
2 结果与讨论
2.1 TiO2/Ag-Ag2O样品的合成
图 1(A)是通过光沉积法和煅烧法制备TiO2/Ag-Ag2O样品的合成示意图, 图1(B)是对应的样品照片。首先, 传统的锐钛矿和金红石混合晶型P25 TiO2经过高温煅烧得到样品TiO2-C, 将其分散到10vol%甲醇溶液中, 得到乳白色的悬浊液。随后, 通过光沉积法使 AgNO3溶液中的 Ag+原位还原 成Ag纳米颗粒并沉积在TiO2表面, 悬浊液的颜色也从乳白色变为棕红色(图1(B)中b), 得到TiO2/Ag光催化剂的悬浮液。最后, 将制备的TiO2/Ag样品分别在马弗炉中不同温度下煅烧, 得到TiO2/Ag-Ag2O()光催化剂。将所制得的TiO2/Ag-Ag2O样品分散于乙醇溶液(25vol%)中, 悬浊液分别为浅红色(TiO2/Ag-Ag2O(200), 图 1(B)中c)、浅蓝色(TiO2/Ag-Ag2O(300), 图 1(B)中d)和灰白色(TiO2/Ag-Ag2O(400), 图1(B)中e), 样品对应悬浮液的颜色随着煅烧温度的升高逐渐变浅。这是因为Ag在低温煅烧(100~400 ℃)的环境下部分被O2氧化为Ag2O[22], 而当温度达到300 ℃以上后, 生成的Ag2O又会分解生成O2和Ag, 导致样品的颜色出现相应变化。
2.2 样品的微结构分析
为确定所制备样品的晶体结构, 测定了不同样品的XRD图谱(图2)。TiO2-C中同时存在金红石型TiO2(JCPDS-99-0090)和锐钛矿型TiO2(JCPDS-99- 0008)的衍射峰, 与原料P25晶型一致[12]。TiO2/Ag和TiO2/Ag-Ag2O()的XRD衍射峰与TiO2-C相比没有明显变化, 说明负载Ag和Ag2O对TiO2-C的晶型以及晶化程度没有影响。比较TiO2-C和TiO2/Ag的金属Ag慢扫图(图2(B))可见, TiO2/Ag样品在金属Ag的特征衍射峰(2=38.1o)处有明显的增强, Ag助催化剂已经成功沉积在TiO2表面[19]。TiO2/Ag-Ag2O (300)在金属Ag的特征衍射峰处的强度比TiO2/Ag有所减弱, 说明煅烧后样品中Ag含量有所降低[22]。进一步观察样品的 Ag2O 慢扫图 (图2(C))发现, TiO2/Ag-Ag2O(300)样品中没有出现明显的Ag2O衍射峰, 这可能是因为Ag2O的含量太低而无法检出。

图1 (A) TiO2/Ag-Ag2O合成示意图和(B)对应样品照片

图2 TiO2-C、TiO2/Ag和TiO2/Ag-Ag2O(x)的(A) XRD图谱、(B) 金属Ag的慢扫图谱和(C) Ag2O的慢扫图谱
从场发射扫描电镜(图3(A~F))中发现, TiO2-C、TiO2/Ag和TiO2/Ag-Ag2O()的颗粒大小(20~50 nm)基本相同。TiO2/Ag的EDX数据(图3(B)插图)中出现了Ag元素, 说明Ag已经成功负载在TiO2颗粒表面。比较图3(C~F)插图中的EDX数据发现TiO2/Ag-Ag2O()中Ag元素的原子百分含量随煅烧温度升高先逐渐降低, TiO2/Ag-Ag2O(350)达到最低, 然后又有所升高。这是由于在煅烧过程中TiO2/Ag样品中的Ag部分被氧化为Ag2O, 当温度达到350 ℃后, Ag2O在高温环境中又迅速分解成Ag和O2, 并且Ag2O分解的速度大于生成的速度[22]。从TiO2/Ag-Ag2O(300)的TEM照片(图 3(G))可见, 在TiO2颗粒表面均匀负载着尺寸约为5 nm的Ag纳米粒子(红色圆圈中的黑色颗粒)。其高分辨TEM照片(图 3(H))中有TiO2(101)面的晶格条纹, 间距为0.350 nm[12], 以及Ag(111)面的晶格条纹, 间距为0.236 nm[22]。晶格在Ag纳米粒子边缘区域有微小的变化, 主要源于在Ag表面原位氧化生成的Ag2O, 进一步证明成功制备了Ag和Ag2O共修饰的TiO2复合光催化剂。

图3 (A~F) TiO2-C、TiO2/Ag和TiO2/Ag-Ag2O(x)的FESEM照片(插图: EDX谱图和数据)和(G, H) TiO2/Ag-Ag2O(300) 的TEM照片
图4(A)是不同样品的XPS全谱图。位于289、473和534 eV结合能的峰分别对应于C1s、Ti2p和O1s的特征峰, 其中Ti、O元素主要来源于TiO2, C元素则来源于碳污染。与TiO2-C相比, 在TiO2/Ag和TiO2/Ag-Ag2O()中出现了Ag的特征峰, 并且在Ag3d高分辨率XPS图谱(图4(B))中, TiO2/Ag和TiO2/Ag-Ag2O在大约368和374 eV处有明显的Ag3d5/2和Ag3d3/2特征峰, 说明存在Ag元素。TiO2/Ag-Ag2O()与TiO2/Ag相比, 其特征峰向较高的结合能偏移, 这是由于煅烧后部分Ag转变为Ag2O造成的[23]。图4(C)是TiO2/Ag-Ag2O(300)样品的Ag3d典型峰拟合曲线。367.44和368.15 eV的峰分别对应于Ag0和Ag+的3d5/2轨道; 373.46和374.16 eV的峰分别对应于Ag0和Ag+的3d3/2轨道[22,24]。图4(D)是TiO2/Ag-Ag2O(300)样品的O1s分峰的拟合曲线, 其中Ti–O和Ti–O–Ag键的峰对应于Ag与TiO2之间的作用力。而且, 在XPS图谱的Ag分峰数据(表1)中, TiO2/Ag-Ag2O(200~400)的Ag+/Ag0数值先升后降, 进一步证明TiO2/Ag-Ag2O样品中同时存在Ag和Ag2O。
图5为不同样品紫外–可见漫反射光谱转化后的吸收光谱图, 插图为对应样品的照片。TiO2-C光催化剂样品的紫外–可见吸收光谱的吸收边在410 nm左右, 样品呈白色[12]。TiO2/Ag光催化剂在410~800 nm范围的可见光区具有较强的吸收, 白色的TiO2样品转变为棕红色。这主要是因为Ag纳米粒子的表面等离子体共振效应引起了可见光区的吸收加强[21]。TiO2/Ag-Ag2O样品在紫外光区的吸收与TiO2-C无明显差异, 在可见光区的吸收随着煅烧温度的升高出现明显减弱, 分别呈紫色(TiO2/Ag-Ag2O(200))、暗蓝色(TiO2/Ag-Ag2O(300))和灰白色(TiO2/Ag-Ag2O(400))。随着煅烧温度的升高, TiO2/Ag-Ag2O样品表面的Ag逐渐被氧化为Ag2O, 导致Ag的等离子体共振效应随之减弱。相比于TiO2, TiO2/Ag和TiO2/Ag-Ag2O()样品的紫外吸收边略有红移, 可能是由于金属Ag与TiO2之间形成了Ti–O–Ag键, 以及金属Ag被氧化成Ag2O, 形成Ag–O–Ag键, 导致光催化剂体系跃迁能量略有下降。而且, 相比于TiO2, TiO2/Ag-Ag2O具有更强的紫外–可见光吸收性能。
2.3 光催化制氢性能和光催化制氢机理
图6(A)是不同样品的制氢速率柱状图。TiO2/Ag-Ag2O的制氢速率随着样品煅烧温度的逐步升高而表现出先升高后下降的规律, 并在煅烧温度为300 ℃时达到最大(75.20 μmol/h), 分别是TiO2-C(3.59 μmol/h)和TiO2/Ag(41.13 μmol/h)的制氢速率的21.0和1.8倍。当煅烧温度超过300 ℃后样品的制氢速率有所下降。不同煅烧温度的样品制氢性能变化规律和EDX图谱(图3(A~F)插图)中Ag和Ag2O的含量变化趋势相对应, 说明表面负载Ag和Ag2O对TiO2光催化剂制氢性能具有重要影响。为了验证光催化剂的性能稳定性, 测试了样品TiO2/Ag-Ag2O(300)的4次循环性能(图6(B))。由图可知, 随着循环次数的增加, 样品TiO2/Ag-Ag2O(300)的制氢速率虽有所下降, 但始终高于TiO2/Ag和TiO2–C, 说明TiO2/Ag-Ag2O样品具有一定的稳定性。

图4 TiO2-C、TiO2/Ag和TiO2/Ag-Ag2O(x)的(A)XPS全谱和(B)Ag3d谱的高分辨率XPS谱; TiO2/Ag-Ag2O(300)样品的(C)Ag3d和(D)O1s典型峰的拟合曲线

表1 不同样品XPS的元素含量
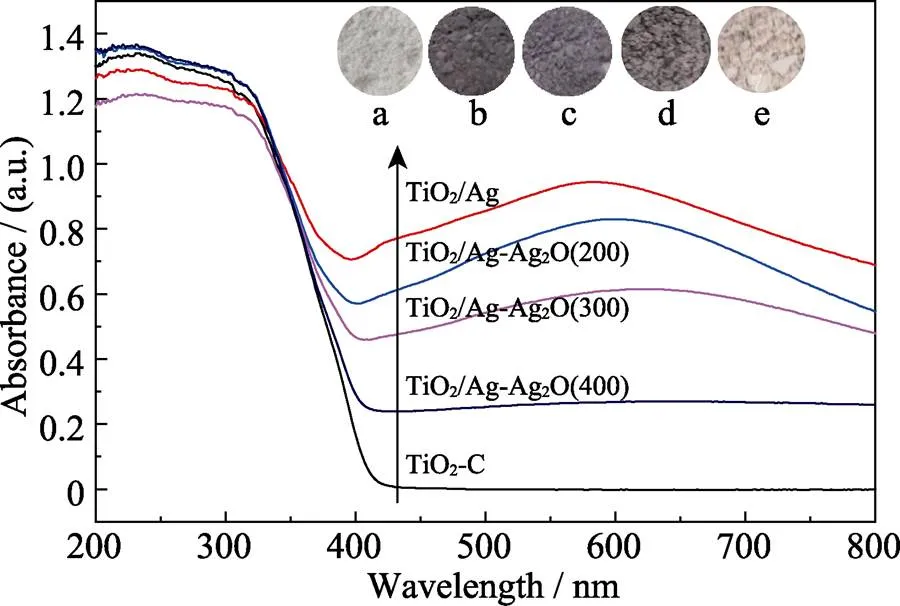
图5 TiO2-C、TiO2/Ag和TiO2/Ag-Ag2O(x)的UV-Vis吸收光谱及对应样品照片

图6 (A) TiO2-C、TiO2/Ag和TiO2/Ag-Ag2O(x)的光催化制氢性能; (B) TiO2/Ag-Ag2O(300)的循环性能
图7为TiO2/Ag-Ag2O的光催化制氢机理示意图。在紫外光照射下, TiO2产生光生电子和空穴, 金属Ag充当电子助剂能够快速转移光生电子, 加快光生电子–空穴对的有效分离, 抑制两者的复合。Ag表面的光生电子进一步转移到其上的Ag2O, 同时Ag2O作为界面催化反应活性位点吸附溶液中的H+产生H2, 加速了界面催化产氢反应速率[22]。不同煅烧温度样品制氢性能变化规律与样品Ag2O含量变化规律的一致性也证明了这一点。所以, 电子助剂Ag和界面活性位点Ag2O的协同作用增强了TiO2光催化的制氢性能。
为验证TiO2/Ag-Ag2O光催化制氢机理, 对样品进行光电化学表征。图8(A)是不同样品的线性扫描伏安曲线(LSV)。其中, TiO2/Ag的电流密度明显超过TiO2-C, 产氢过电位略微降低, 表明Ag作为助催化剂能够快速捕获光生电子, 促使溶液中的H+还原成H2[21]。TiO2/Ag-Ag2O的电流密度进一步增大, 同时产氢过电压逐渐降低, 表明Ag2O是一种高效的界面催化活性位点, 能有效吸附溶液中的H+, 加快界面催化反应。为了进一步研究TiO2/Ag-Ag2O中光生载流子的捕获、分离和传输效率, 测量了不同光催化剂的瞬态光电流响应曲线(图 8(B))和电化学阻抗谱(EIS, 图 8(C))。由图 8(B)可以看出, 相对于TiO2-C, TiO2/Ag的光电流密度明显提升, 说明Ag具有优异的载流子传输性能, 能有效促进光生电荷的分离。随着煅烧温度从200 ℃升到400 ℃, TiO2/Ag-Ag2O()的光电流密度先明显增加, TiO2/Ag-Ag2O(300)达到最大, 后有所下降, 但TiO2/Ag-Ag2O(400)的光电流密度依然超过TiO2–C。由图8(C)可见, TiO2/Ag-Ag2O()样品的圆弧半径小于TiO2-C和TiO2/Ag, 说明Ag2O与Ag之间的传输阻力小, 光生载流子的传输效率高[25]。Ag与Ag2O以适当比例共存时, 电子助剂Ag和界面活性位点Ag2O能显著提高光生电子转移速度, 加快界面的产氢催化反应速率, 促进光生电子和空穴的分离, 改善TiO2光催化制氢性能。

图7 TiO2/Ag-Ag2O的光催化制氢机理示意图
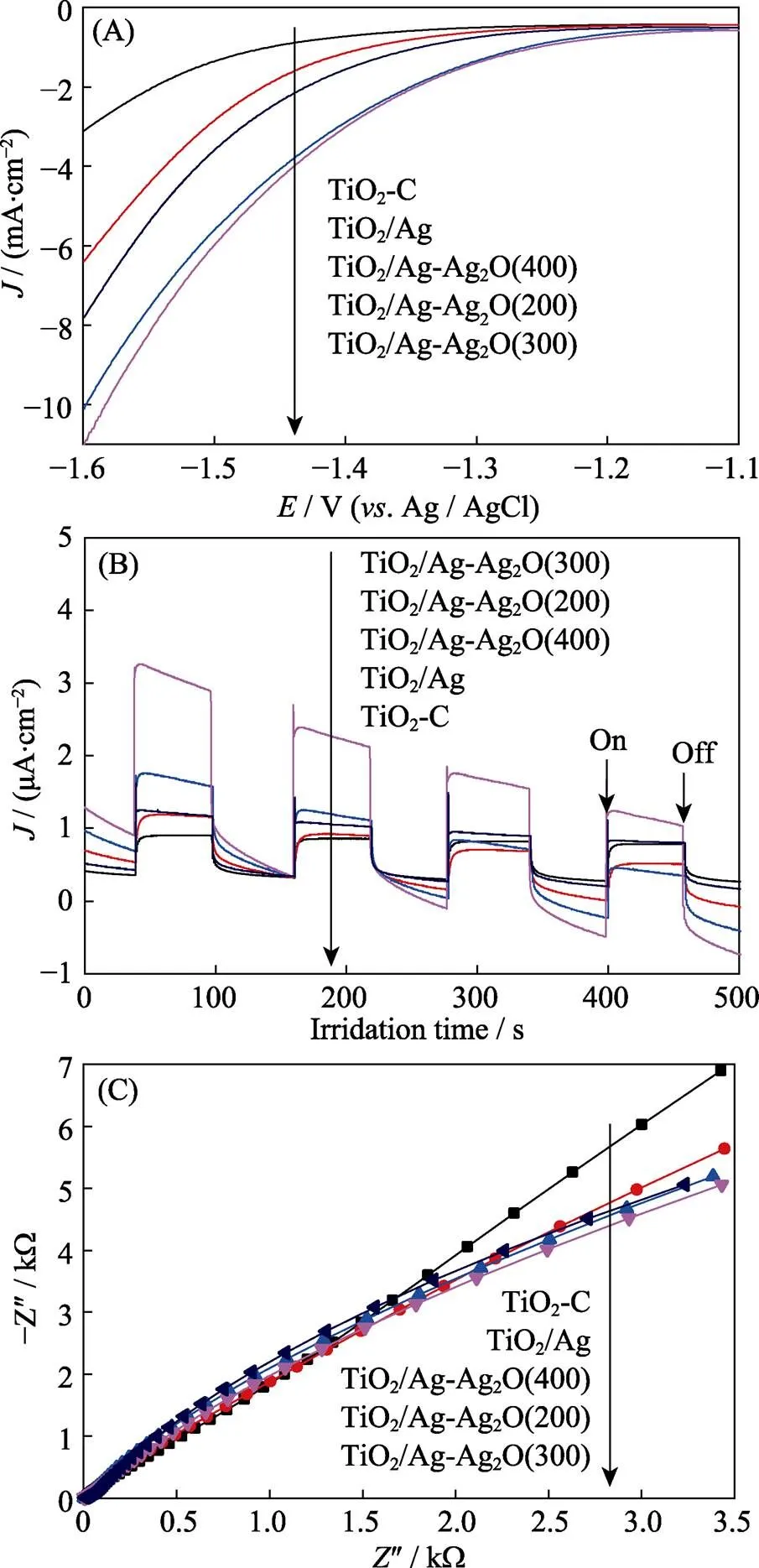
图8 TiO2-C、TiO2/Ag和TiO2/Ag-Ag2O(x)的(A)线性扫描曲线(LSV)、(B)瞬态光电流响应和(C)电化学阻抗谱(EIS)

图9 TiO2-C、TiO2/Ag和TiO2/Ag-Ag2O(x)的荧光光谱图
为揭示样品在光照时光生载流子复合的情况, 测定了样品的荧光(PL)光谱图(图9)。相比于TiO2–C,TiO2/Ag的荧光强度有所下降, 说明电子和空穴的复合得到有效抑制, 主要是由于Ag起到了快速传输电子的作用。TiO2/Ag-Ag2O()的光生载流子复合的情况相对于TiO2/Ag有增有减。TiO2/Ag-Ag2O(300)的荧光强度最弱, 说明其电子空穴复合率最低、分离效率最高[26], 有助于改善产氢性能。
3 结论
本研究采用光沉积法和煅烧法制备了TiO2/Ag-Ag2O复合光催化剂, 表现出较高的光催化制氢性能。300 ℃煅烧制得的复合光催化剂的制氢速率达到最大值(75.20 μmol/h), 分别是TiO2–C和TiO2/Ag的21.0和1.8倍。TiO2/Ag-Ag2O复合光催化剂制氢性能显著提高的原因是: Ag作为电子助剂快速转移光生电子, Ag2O作为界面催化反应活性位点加快界面产氢速率, 两者的协同作用促使光生电子–空穴复合率显著降低, 从而提高了TiO2的制氢速率。本研究对设计具有高效制氢性能的TiO2光催化复合材料具有一定的指导意义。
[1] DU H, LIU Y, SHENG C,. Nanoheterostructured photocatalysts for improving photocatalytic hydrogen production.,2017, 38(8): 1295–1306.
[2] ZHANG K, PARK J H. Surface localization of defects in black TiO2: enhancing photoactivity or reactivity., 2017, 8: 199–207.
[3] LIU Q, SHEN J, YU X,. Unveiling the origin of boosted photocatalytic hydrogen evolution in simultaneously (S, P, O)- codoped and exfoliated ultrathin g-C3N4nanosheets., 2019, 248: 84–94.
[4] TIAN L, YANG X, LIU Q,. Anchoring metal-organic framework nanoparticles on graphitic carbon nitrides for solar-driven photocatalytic hydrogen evolution., 2018, 455: 403–409.
[5] MA Y, LI Q. Preparation and characterization of TiO2/Co3O4nanocomposites and their photocatalytic activity for hydrogen evolution.,2016, 31(8): 841–844.
[6] JIANG Y, QUA F, TIAN L,. Self-assembled g-C3N4nanoarchitectures with boosted photocatalytic solar-to-hydrogen efficiency., 2019, 487: 59–67.
[7] WEI J, LI X, WANG H,. Nitrogen doped carbon quantum dots/titanium dioxide composites for hydrogen evolution under sunlight.,2015, 30(9): 925–930.
[8] YAN C, XUE X, ZHANG W,.Well-designed Te/SnS2/Ag artificial nanoleaves for enabling and enhancing visible-light driven overall splitting of pure water., 2017, 39: 539–545.
[9] LIU W, SHEN J, LIU Q,.Porous MoP network structure as co-catalyst for H2evolution over g-C3N4nanosheets., 2018, 462: 822–830.
[10] TANG H, WANG R, ZHAO C,. Oxamide-modified g-C3N4nanostructures: tailoring surface topography for high-performance visible light photocatalysis., 2019, 374: 1064–1075.
[11] LI C, JIN H, YANG Z,. Preparation and photocatalytic properties of mesoporous RGO/TiO2composites.,2017, 32 (04): 357–364.
[12] WANG P, LU Y, WANG X,. Co-modification of amorphous- Ti(IV) hole cocatalyst and Ni(OH)2electron cocatalyst for enhanced photocatalytic H2-production performance of TiO2.,2017, 391: 259–266.
[13] ZHANG W, ZHANG H, XU J,. 3D flower-like heterostructured TiO2@Ni(OH)2microspheres for solar photocatalytic hydrogen production.,2019, 40(3): 320–325.
[14] KUMARAVEL V, MATHEW S, BARTIETT J,Photocatalytic hydrogen production using metal doped TiO2: a review of recent advances.,2019, 244: 1021–1064.
[15] ZHAO D, YANG C F. Recent advances in the TiO2/CdS nanocomposite used for photocatalytic hydrogen production and quantum-dot-sensitized solar cells., 2016, 54: 1048–1059.
[16] CHEN F, LUO W, Mo Y,photodeposition of amorphous CoSon the TiO2towards hydrogen evolution.,2018, 430: 448–456.
[17] GUPTA B, MELVIN A A, MATTHEWS T,TiO2modification by gold (Au) for photocatalytic hydrogen (H2) production.,2016, 58: 1366–1375.
[18] HOU L, ZHANG M, GUAN Z,Effect of platinum dispersion on photocatalytic performance of Pt-TiO2.,2018, 20(3): 1–8.
[19] SARAVANAN R, MANOJ D, QIN J,Mechanothermal synthesis of Ag/TiO2for photocatalytic methyl orange degradation and hydrogen production.,2018, 120: 339–347.
[20] WANG P, SHENG Y, WANG F,Synergistic effect of electron- transfer mediator and interfacial catalytic active-site for the enhanced H2evolution performance: a case study of CdS/Au photocatalyst.2018, 220: 561–569.
[21] YU H, LIU W, WANG X,Promoting the interfacial H2-evolution reaction of metallic Ag by Ag2S cocatalyst: a case study of TiO2/Ag-Ag2S photocatalyst.2018, 225: 415–423.
[22] WANG X, LIAO D, YU H,Highly efficient BiVO4single- crystal photocatalyst with selective Ag2O-Ag modification: orientation transport, rapid interfacial transfer and catalytic reaction.,2018, 47(18): 6370–6377.
[23] YU H, LIU R, WANG X,Enhanced visible-light photocatalytic activity of Bi2WO6nanoparticles by Ag2O cocatalyst.,2012, 111–112: 326–333.
[24] LI J, HAO H, ZHOU J,Ag@AgCl QDs decorated g-C3N4nanoplates: the photoinduced charge transfer behavior under visible light and full arc irradiation.,2017, 422: 626–637.
[25] KIM J, JUN H, HONG S,Charge transfer in iron photoanode modified with carbon nanotubes for photoelectrochemical water oxidation: an electrochemical impendence study., 2011, 36: 9462–9468.
[26] LIU Y, DING S, SHI Y,Construction of CdS/CoOcore-shell nanorods for efficient photocatalytic H2evolution., 2018, 234: 106–116.
Synergistic Effect of Ag and Ag2O on Photocatalytic H2-evolution Performance of TiO2
WANG Ping, LI Xinyu, SHI Zhanling, LI Haitao
(School of Chemistry, Chemical Engineering and Life Science, Wuhan University of Technology, Wuhan 430070, China)
Highly efficient TiO2photocatalysts (TiO2/Ag-Ag2O) co-modified by Ag as electron cocatalysts and Ag2O as interfacial catalytic active sites were synthesizeda two-step process including the initial photoinduced deposition of metallic Ag nanoparticles on the TiO2surface (TiO2/Ag)and the followingoxidation of partial Ag into Ag2O by low-temperature calcination.Ag nanoparticles function as effective electron cocatalysts for the steady capture and rapid transportation of photogenerated electrons from TiO2surface to Ag2O, while the adsorbed H+ions from solution to Ag2O as the interfacial catalytic active sites are reduced into H2. The synergistic effect of Ag and Ag2O can accelerate the electrons transfer and promote the rapid H2-evolution reactionfor enhanced photocatalytic H2-evolution performance of TiO2/Ag-Ag2O. The highest H2-evolution rate of the resultant TiO2/Ag-Ag2O calcinated at 300 ℃reached 75.20 μmol/h, which was higher than those of the TiO2(3.59 μmol/h) and TiO2/Ag (41.13 μmol/h) by 21.0 and 1.8 times, respectively. This study provides a new strategy for the design and synthesis of highly efficient photocatalytic H2-evolution materials.
TiO2; electron cocatalyst; interfacial catalytic active site; synergistic effect; photocatalytic H2evolution
1000-324X(2020)07-0781-08
10.15541/jim20190460
O643
A
2019-09-04;
2019-12-04
国家自然科学基金(51872221); 国家级大学生创新创业训练计划项目(20181049715025)
National Natural Science Foundation of China (51872221); National Undergraduate Innovation And Entrepreneurship Training Program (20181049715025)
王苹(1970–), 女, 教授. E-mail: wangping0904@whut.edu.cn
WANG Ping (1970–), female, professor. E-mail: wangping0904@whut.edu.cn

