超声波辅助生物酶提取紫薯色素工艺优化
东子珺 徐晓萍

摘 要:紫薯色素原料易得、造价低廉且具有抗癌、抗氧化和预防疾病等功效,因此紫薯色素提取成为科研者的重点研究对象。本文通过结合目前常见的超声波提取法、生物酶提取法,进一步优化紫薯色素提取工艺。通过单因素试验和正交试验得到在实验范围内最佳提取工艺为:采用超声波-半纤维素生物酶协同提取紫薯色素效果佳,其中酶用量25 U·mL-1、超声时间20 min、温度60 ℃、溶液pH值为4.0、料液比1∶25,得到色素提取量为31.72 mg·(100 g)-1;影响色素提取因素大小为:pH值>酶用量>超声时间。本文为紫薯色素的实际生产和开发利用提供一定的理论依据。
关键词:紫薯色素;超声波;半纤维素酶;提取
Abstract: The raw material of purple potato pigment is easy to be obtained. It has inexpensive price and many effects, such as anti-cancer, anti-oxidation and prevention of disease. Therefore, the extraction of purple potato pigment has become the focus of research. In this paper, the extraction process of purple sweet potato pigment was further optimized by combining the ultrasonic extraction method and biological enzyme extraction method. According to single factor test and orthogonal test, the optimal extraction process within the experimental range was as follows: the ultrasonic and hemicellulose enzyme were used to extract the pigment of purple sweet potato with the best effect. The enzyme dosage was 25 U·mL-1, the ultrasonic time was 20 minutes, the temperature was 60 ℃, the pH was 4.0, the solid-liquid ratio was 1∶25, and the extraction amount of pigment was 31.72 mg·(100 g)-1. The order of the factors affecting the extraction of purple potato pigment was: pH > enzyme dosage > ultrasonic time. It provided some theoretical basis for the actual production, development and utilization of purple sweet potato pigment.
Key words: purple potato pigment; ultrasonic; hemicellulose; extraction
紫薯色素主要成分為花青素。花青素具有抗氧化、抗癌、预防疾病[1]等功效,常作为食品调色原料,是人类饮食的重要组成部分[2]。自然界中鲜有单纯的花青素存在,在紫薯色素中的花青素主要为矢车菊素、芍药色素和极少量的天竺葵色素,都是以糖苷化后的酰基化衍生物的形式存在[3],因此,紫薯色素稳定性强[4],抗氧化效果好[5]。
色素提取常见方法有溶剂萃取法[6]、超声波提取法[7]、生物酶提取法[8]等。其中溶剂萃取法操作简便,但提取率低、溶剂使用量大[9]。超声波提取法利用振动和空化效应[10]来破坏细胞,具有提取时间短、操作简单、提取率高等特点[11]。生物酶提取法是通过对植物细胞相关物质进行降解从而提取出色素,具有高效性、专一性[12],但成本较高。
综上所述,结合各个方法的优缺点,本文将采用超声波-生物酶协同提取法,并以柠檬酸-柠檬酸钠缓冲溶液作为提取剂,研究紫薯色素的最佳提取工艺,为紫薯色素提取提供一定的理论依据。
1 材料和方法
1.1 材料与试剂
紫薯(购于市场);柠檬酸(天津市风船化学试剂科技有限公司 分析纯);柠檬酸钠(天津市北方天医化学试剂厂 分析纯);半纤维素酶(源叶生物 20 000 U·g-1);α-淀粉酶(北京奥博星生物技术有限责任公司 ≥3 700 U·g-1);纤维素酶(麦克林 10 000 U·g-1);柠檬酸-柠檬酸钠缓冲溶液(pH值3.2,4.0,4.8);酶液(5 U·mL)。
1.2 仪器与设备
远红外干燥箱(220 V,50 Hz,1.2 kW) 天津市天宇实验仪器有限公司;HD-600超声仪(220 V/50 Hz,600 W,40 kHz) 济宁亨达超声设备有限公司;JW-3021HR高速冷冻离心机 安徽嘉文仪器装备设备有限公司;722S可见分光光度计 上海菁华科技仪器设备有限公司;恒温水浴锅 北京中兴伟业仪器有限公司;多功能粉碎机 佛山德玛仕网络科技有限公司;FA1204B电子天平 上海精密科学仪器;TU-1901双光束紫外可见分光光度计 北京普析通用有限责任公司;FTIR-650傅立叶变换红外光谱仪 天津港东科技发展股份有限公司。
1.3 方 法
1.3.1 紫薯粉的制备 紫薯粉的制备工艺:选择无病变或无腐烂的新鲜紫薯,洗去表面的沉积物,将其(生紫薯或熟紫薯)放入远红外干燥箱中在不同温度下进行干燥,取出后用粉碎机粉碎,过筛,避光保存。
1.3.2 色素提取流程 本文主要通过超声波-生物酶协同提取法对紫薯色素进行提取,并与超声法和酶解法进行对比。同时,在文献[13]中发现酶解温度曲线较为平缓,由此推断酶解温度对紫薯色素提取的影响不大,因此本文选用酶解温度为50 ℃[13]。
超声波-生物酶协同提取法操作过程为:用分析天平精确称取紫薯粉置于大试管中;加入柠檬酸-柠檬酸钠缓冲溶液、酶,密封后水浴加热,再进行超声、离心,取上清液定容至50 mL容量瓶中,并测定吸光度。
酶解法无需超声,其余流程同超声波-生物酶协同提取法。
超声法无需酶解,其余流程同超声波-生物酶协同提取法。
1.3.3 紫薯总色素含量计算方法 总色素含量参照文献[14]提供的公式进行计算。
式中:M—总色素含量/(mg·(100 g)-1),A—吸光度,N—稀释倍数,X—浸提液体积/mL,m—原料质量/g,98.2—消光系数。
1.3.4 紫薯中花青素的初步判断 为确保所提取色素为花青素,本文采用紫外-可见分光光度法[15]和红外光谱法[16]对色素进行初步判断。
1.3.5 最大吸收波长测定 称取3种紫薯粉各1.000 0 g置于大试管中;加入pH值4.8柠檬酸-柠檬酸钠缓冲溶液20 mL,将其密封之后置于50 ℃水浴锅中水浴1 h,取出放至室温;转移至50 mL离心管中,以3 000 r·min-1的转速离心15 min;取上清液,用pH值4.8柠檬酸-柠檬酸钠缓冲溶液定容至50 mL的容量瓶中;通过紫外-可见分光光度计全波扫描,确定最大吸收波长。
1.3.6 单因素试验 按照1.3.2超声波-生物酶协同提取法提取流程以及设计的单因素试验条件展开试验(表1)。研究一种因素的影响时,其余各因素均恒定,并且均采用上一试验的最佳值开展下一项试验。
2 结果与分析
2.1 紫薯粉的选择
通过图1可见,生紫薯直接置于烘干箱烘干,紫薯粉末会发生褐变现象,且随着温度升高,褐变现象明显。这是由于生紫薯粉中淀粉难溶于水,随着温度的升高,淀粉分子发生剧烈振动,造成氢键断裂,发生糊化,产生不同程度的褐变反应;而熟紫薯由于在蒸熟过程中改变紫薯细胞膜的通透性,同时使花青素的多酚含量增加[17],发生辅色效应,提高花青素的稳定性[18]。因此,即使在70 ℃温度条件下也不会出现褐变现象。此外,据研究表明花青素于120 ℃时降解率最高[19]。综合考虑,选用熟紫薯粉进行研究。
2.2 紫薯中花青素的初步判断
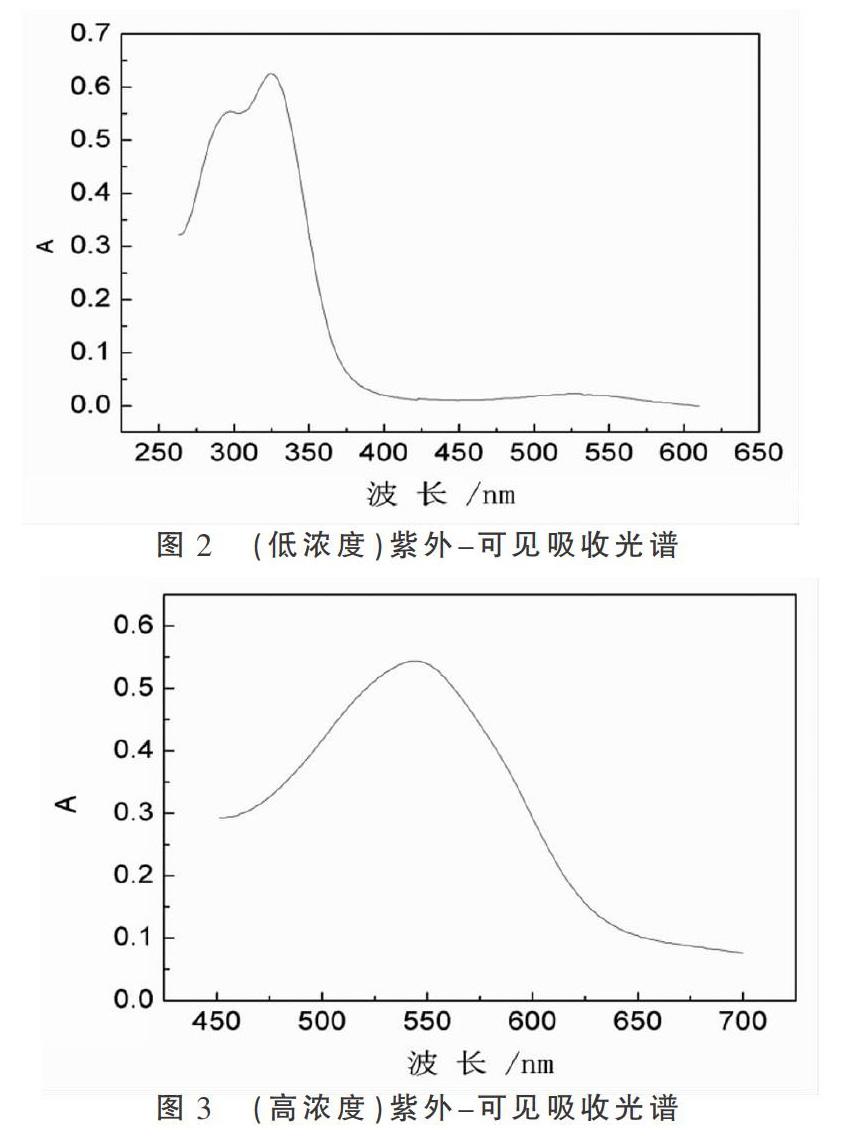
2.2.1 紫外-可见分光光度法对紫薯色素的初步判断 通过将定容后的紫薯色素溶液置于紫外-可见分光光度计中进行扫描,并与花青素标准溶液的紫外-可见吸收光谱[15]进行对比,初步判断提取的紫薯色素是花青素。由图2可知,提取出的色素稀溶液在可见光区540 nm附近和紫外光区297 nm、324 nm附近有吸收峰,并且紫薯色素主要在紫外光区有强吸收,说明紫薯色素存在共轭体系。但紫外主要是针对无颜色的稀溶液,而提取出的色素是有颜色的浓溶液,因此不适合在紫外进行评测。通过对提取出的浓色素溶液在可见光区进行扫描,测定最大吸收波长为540 nm(图3)。与文献[15]中标准溶液紫外-可见吸收光谱图进行对比,所提取的色素与标准溶液的紫外-可见吸收光谱图[15]吸收峰位置大致一致。周培剑[20]在对紫薯色素的提取研究中得出在可见光最大吸收波长为530 nm,与本试验结果相近,初步判断提取出的色素为花青素。此外,由于在紫外光区324 nm附近有吸收峰,可以判断提取出的花青素存在酰基化[21],具有更高的稳定性[22]。因此,从紫薯中提取出的花青素更有适用性。
2.2.2 红外光谱法对紫薯色素的初步判断 将提取的紫薯色素溶液在红外光谱仪中进行扫描,如图4所示,并与郭燕等[16]所得标准溶液红外光谱图进行对比。通过图4与标准溶液红外光谱图[16]的对比,发现提取出的花青素与标准溶液的红外光谱图[16]出峰位置相似。在3 500~3 200 cm-1附近的吸收峰是-OH;在1 650.77 cm-1处的吸收峰是酰基化产物C=O;在1 417.42 cm-1处的吸收峰是苯环和杂环上C-C;在1 274.72 cm-1和1 089.58 cm-1處的吸收峰是甲氧基。这些吸收峰表现出酰基化花青素中官能团的特征。这一结论与佀俊茹等[23]在研究中的结论相似。因此,初步推断提取出的色素为花青素。
2.3 单因素试验分析
2.3.1 超声温度对紫薯色素的影响 由图5看出在30 ℃到60 ℃时,吸光度值随超声温度的升高而增大;在60 ℃之后出现下降趋势,这是因为在30 ℃到60 ℃时,超声温度对紫薯细胞破坏力增强,使色素流出;而当温度上升到一定值时,由于天然色素的热不稳定性[24],使色素提取率降低。彭常安等[25]在研究中表明紫薯色素耐温在60 ℃及以下。如继续升温会破坏色素,降低色素的稳定性[26],从而降低色素提取率。因此,判断最佳超声温度为60 ℃。
2.3.2 超声时间对紫薯色素提取的影响 由图6可看出在10~15 min时没有明显变化;在15~20 min时吸光度值变大;20 min之后呈现下降趋势。这是因为在10~15 min时对于紫薯细胞的穿透能力不是很大,使色素流出量较小;而20 min之后随着时间增加,色素加热时间也随之增加,破坏色素而导致。关晴月和邹宇[27]在研究中得出超声最佳时间为20 min,与本试验结果大致一致,因此初步判断最佳超声时间为20 min。
2.3.3 酶的种类对紫薯色素提取的影响 由于目前还未有人使用半纤维素酶对紫薯色素提取展开过研究,只有陈合等[28]使用半纤维素酶对姜黄素进行提取,并得到较好的结果。由此提出设想:使用半纤维素酶提取紫薯色素会提高提取率。为验证该设想,选取半纤维素酶、纤维素酶和α-淀粉酶分别对紫薯色素进行提取。
如图7可知,半纤维素酶提取紫薯色素为最佳,因为半纤维素酶提取所得的色素含量要高于纤维素酶和α-淀粉酶,因而选用半纤维素酶进行色素提取。
2.3.4 料液比对紫薯色素提取的影响 由图8可知,随着柠檬酸-柠檬酸钠缓冲溶液量的增加,吸光度呈现出先平缓,再增长,后下降的趋势。这是因为如果提取剂的量不够,无法使提取剂完全渗入紫薯细胞溶解色素,不足以使色素从细胞内扩散出来;之后随着提取剂量的增加,渗入紫薯粉中的提取剂增多,形成内高外低的渗透压,使色素逐渐被溶解;当提取剂过量,稀释了酶的浓度,使提取率降低。赵二劳等[29]在对紫薯色素提取工艺研究中得出最佳料液比为1∶25,与本试验结果一致,因此最佳料液比初步认定为1∶25。
2.3.5 酶用量对紫薯色素提取的影响 由图9可知,在5~25 U·mL-1随着酶浓度的增加,吸光度呈现出先增长,后下降的趋势。随着酶浓度的增加,紫薯细胞内半纤维素的降解速率加快,从而加大细胞内色素的渗透率;当酶分子被底物饱和后,增加酶量将不会增大紫薯色素的提取率。姚刚[30]在研究中表明最适酶量为20 U·g-1,与本试验结果相近。同时考虑到经济成本,初步确定酶用量为25 U·mL-1。
2.3.6 pH值对紫薯色素提取的影响 由图10可知,紫薯色素提取适合在酸性条件下进行。从图11中看出不同pH值下的颜色不同,主要由于不同的pH值导致紫薯色素的分子构型不同[31],从而发生了颜色改变。初步确定最佳pH值为3.2。
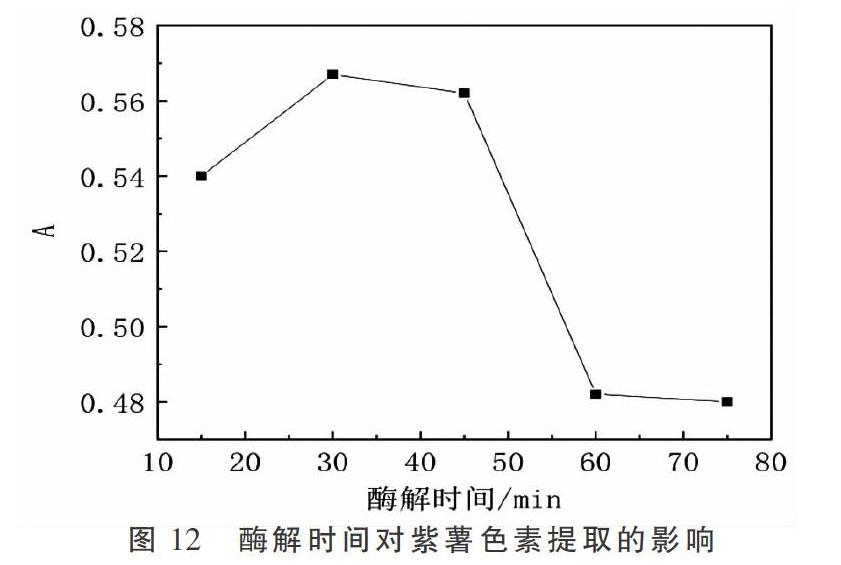
2.3.7 酶解时间对紫薯色素提取的影响 由图12可知,在15~30 min随着时间的增加,紫薯细胞降解会随之增加;在30~45 min变化不大;在45~60 min出现大幅下降,是因为长时间加热破坏了酶的活性所致。李辉等[32]在研究中得出最佳酶解时间为45 min,与本试验结果相近,经综合考虑,选用最佳酶解时间为30 min。
2.4 正交试验
为使试验结果更加精准,提高紫薯色素的产率,设计出三因素两水平L4(23)的正交试验如表2、表3所示。
由表3中R值(极差)大小可推断出对紫薯色素提取时各因素的影响程度顺序为:pH值>酶用量>超聲时间。通过k值(平均值)的计算和比较,得到最佳工艺为:超声时间20 min,酶用量25 U·mL-1,pH值为4.0,色素提取量为31.72 mg·(100 g)-1。
分别用超声波-生物酶协同法、酶解法和超声法在最佳工艺下进行紫薯色素提取,得到吸光度值分别为0.623,0.491,0.572。通过计算色素提取量分别为31.72,25.00,29.12 mg·(100 g)-1。由此可判断出对于紫薯色素提取采用超声波-生物酶法为最佳。
3 结论与讨论
本文采用超声波-生物酶协同法对紫薯色素进行提取,利用吸光度大小来衡量提取效果。从单因素试验中得到如下结论:选用半纤维素酶提取效果要优于纤维素酶和α-淀粉酶;吸光度随着酶用量的增加先增大后减小,在25 U·mL-1时达到最大值;随着酶水解时间的增加吸光度先增大后减小,在45 min后迅速下降;紫薯色素提取适合在酸性条件下进行,随着溶液pH值的增加吸光度呈现下降趋势;吸光度随着料液比的增加先增大后减小,最佳料液比为1∶25;随着超声时间的增加,吸光度在20 min时达到最大然后迅速降低;吸光度随着超声的升高先增大后减小,在60 ℃达到最大值。通过正交试验得到最佳工艺为:超声时间20 min,酶用量25 U·mL-1,pH值为4.0,色素提取量为31.72 mg·(100 g)-1。在紫外-可见吸收光谱中,紫薯色素在324 nm附近出酰基化峰,说明紫薯花青素比较稳定,适合运用到生活中。本文试验方法简单、便捷,使用的试剂成本较低、安全性高、效果好,具有可行性。
参考文献:
[1]ZHU Z Z, GUAN Q Y, GUO Y, et al. Green ultrasound-assisted extraction of anthocyanin and phenolic compounds from purple sweet potato using response surface methodology[J]. International Agrophysics,2016,30(1):113-122.
[2]HU Y J, DENG L Q, CHEN J W, et al. An analytical pipeline to compare and characterize the anthocyanin antioxidant activities of purple sweet potatp cultivars[J]. Food chemistry,2016,194:46-54.
[3]毛建霏,付成平,郭灵安,等.可见分光光度法测定紫甘薯总花青素含量[J].食品与发酵科技,2010,46(2):216-219.
[4]ZHAO C L, YU Y Q, CHEN Z J, et al. Stability-increasing effects of anthocyanin glycosyl acylation[J]. Food chemistry,
2017,214:119-128.
[5]RICCARDO M, SIMONE G, SERENA B,et al. Acylated anthoc-yanins from sprouts of Raphanus sativus cv. Sango: Isolation, structure elucidation and antioxidant activity[J]. Food
chemistry,2015,166:397-406.
[6]陈杰.紫甘薯色素提取、纯化及稳定性研究[D].无锡:江南大学,2011:3-4.
[7]刘晓娜.黑糯玉米原花青素提取纯化和抗氧化性的研究及应用[D].乌鲁木齐:新疆大學,2016:8-10.
[8]秦永剑,张加研,万永燕.纤维素酶辅助提取油菜籽皮中的原花青素[J].北京农业,2012(24):14-16.
[9]朱珠,柳中梅,刘云派.紫薯中提取色素的工艺研究[J].江西理工大学学报,2013(3):11-15.
[10]李萍,汪青青,闫静坤,等.超声波辅助酸法提取陈皮中果胶的工艺优化[J].天津农学院学报,2017,24(3):79-84.
[11]CORRALES M, TOEPFL S, BUTZ P, et al. Tauscher. Extraction of anthocyanins from grape by-products assisted by ultrasonics, high hydrostatic pressure or pulsed electric fields: A comparison[J]. Innovative food science and emerging Technologies,2007,9(1):85-91.
[12]章萍萍.紫薯花青素的提取、纯化及其抗氧化和益生元活性研究[D].合肥:合肥工业大学,2017:6-7.
[13]吴春,张艳.纤维素酶法提取葡萄籽中原花青素的研究[J].食品科学,2006,27(10):258-261.
[14]蒋丽施,孟晓,陈艳,等.微波辅助提取紫甘薯色素的研究[J].食品与发酵科技,2015,51(2):56-59.
[15]许丽梅,杜永峰,姚秉华.分光光度法测定葡萄籽中原花青素的含量[J].食品科技,2008(5):216-219.
[16]郭燕,郭利,胡奇林.超声波法结合响应曲面法优化葡萄籽中原花青素的提取工艺研究[J].山西大学学报,2015,38(1):133-141.
[17]孔霜霜.紫薯熟粉的加工及其自发粉研制[D].无锡:江南大学,2015:2-3.
[18]王辉,龚淑英,刘蕾.花青素分布、合成和降解综述[J].茶叶,2009,35(4):203-206.
[19]施雅,雍克岚,汪凌波,等.金荞麦高聚原花青素的氢化降解反应[J].食品研究与开发,2010,31(2):138-141.
[20]周培剑.紫甘蓝和紫甘薯色素提取及酸碱指示真丝织物的制备[D].杭州:浙江理工大学,2012:23-24.
[21]赵立仪,李路宁,申芮萌,等.酰基化蓝莓花青素的稳定性研究[J].食品工业科技,2014,35(22):299-303.
[22]PAULA D A C, EKICI L, BARNES R C, et al. Pre-heating and polyphenol oxidase inhibition impact on extraction of purple sweet potato anthocyanins[J]. Food chemistry,2015,
180:227-234.
[23]佀俊茹,吴坚,殷雪.紫甘薯红色素用于大豆蛋白复合纤维织物的染色性分析[J].毛纺科技,2011,39(7):20-25.
[24]王怡龄,赵云蛟,吴昊天,等.多种水溶性天然色素的热稳定性研究[J].中国食品添加剂,2015(10):88-92.
[25]彭常安,付严萍,刘永,等.紫甘薯色素理化性质及稳定性研究[J].安徽农业大学学报,2012,39(3):407-411.
[26]JIE C. Extraction and stability of purple sweet potato pigment[J]. Food science,2011,32(18):154-158.
[27]关晴月,邹宇.紫甘薯色素提取工艺条件的优化[J].中国调味品,2017(6):149-151.
[28]陈合,李世玉,舒国伟,等.半纤维素辅助提取姜黄色素的研究[J].中国调味品,2010,35(2):106-108.
[29]赵二劳,闫唯,高子怡,等.紫薯色素提取工艺及其功能活性研究进展[J].食品与机械,2018,34(3):192-195.
[30]姚刚.从紫甘薯中提取纯化花青素、花青素的抗氧化活性以及利用剩余物制备麦芽糊精的研究[D].杭州:浙江大学,2015:57-58.
[31]王晰锐.紫甘薯花色苷的结构鉴定以及稳定性和功能性的研究[D].哈尔滨:东北农业大学,2011:5-6.
[32]李辉,孟雅红,付彦青,等.酶-超声波联用提取紫薯色素的工艺研究[J].食品工业科技,2014,35(14):256-259.

