心室辅助装置血流动力学关键参数可视化评价方法和平台研究
李澍,张琪,郝烨,王权
1. 中国食品药品检定研究院 医疗器械检定所,北京 102629;2. 国家节能中心,北京 100045
引言
心力衰竭作为心血管疾病的最终发展阶段严重威胁着我国人群的健康。目前,我国的心力衰竭患者超过1100万,5年死亡率超过50%[1-2]。近年来,心室辅助装置作为一种有效的心力衰竭治疗手段,广泛地应用于心衰临床治疗中[3-4]。研究发现,心室辅助装置的血流动力学特性对临床疗效影响显著,叶轮处过高的切应力会损伤红细胞功能[5],激活血小板凝血功能[6],后导叶处的血流停滞区与过高的切应力梯度会导致血栓形成与脱落[7]。因此,检测心室辅助装置的血流动力学关键特性对于全面准确地评价心室辅助装置的性能、血液相容性与临床安全性具有重要的价值[8]。
粒子图像测速(Particle Image Velocimetry,PIV)是研究血流动力学应用最广泛的方法[9-10]。PIV通过在待测流场中均匀分布荧光示踪粒子,采用激光激发示踪粒子,并采用高速CCD相机连续拍摄待测流场中粒子的运动轨迹,以流场中粒子的速度表示其所处局部流场的流体速度;然后用图像分析方法(如光学杨式条纹法、自相关法或者互相关法等)计算出待测流场中各个粒子团的位移轨迹,进而计算出其中各个荧光粒子的流速矢量,获得流场速度分布;最后,利用第三方图像后处理软件,根据计算出的流体速度场数据,获得某一个时刻某个截面的速度流场矢量和云图。PIV因其优异的空间与时间分辨率,广泛应用于流体力学测量中。图1是PIV工作的原理图。
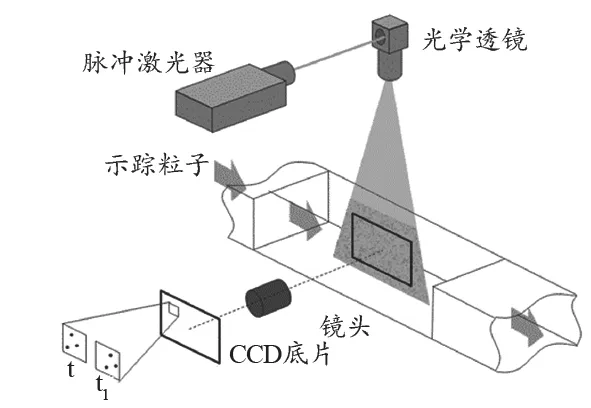
图1 PIV原理图
国内外在利用PIV方法研究心室辅助装置血流动力学性能方面开展了大量研究。美国食品药品监督局承认PIV测试的有效性,推荐将PIV的实验结果作为植入物性能的评价指标。在国内,江苏大学钱坤喜团队采用PIV方式评价人工心脏内部血液流场特性[11]。阜外医院胡盛寿团队采用PIV实验评价FW-II型血泵的流动特性[12-13]。北京工业大学常宇团队采用3D PIV平台研究人工心脏内部的旋动流特性[14]。虽然基于PIV技术的血流动力学研究已广泛开展,但是目前的研究成果大多依托于真实血管的简化模型,这意味着所获得的结果只具有理论价值,无法直接对临床应用提供指导。临床上,主动脉具有复杂的三维空间形态,而其空间形态的改变会极大地影响主动脉内血流动力学特性,尤其是血流的旋动流特性。因此仅通过对理想化的几何模型的研究无法满足心室辅助装置临床应用的需求。
鉴于以上局限性,有必要针对真实心室辅助装置辅助主动脉模型展开研究,从而获得更加真实的主动脉内血流流动数据[15],同时能够为质量评价工作提供证据性更强、更加贴近临床真实的研究结果[16-17]。本文从心室辅助装置血流动力学质量检测的实际需求出发,研究并固定心室辅助装置PIV流体实验所需要的模型透明度、示踪粒子浓度以及拍摄位置等相关参数,并确定心室辅助装置血流动力学关键特征对血液相容性的影响规律,为心室辅助装置质量评价提供方法[18]。
1 材料与方法
1.1 流场检测平台搭建需求分析
为了加工出能够用于PIV实验的真实主动脉模型,除了在加工中要保持主动脉复杂的几何特征以外,还需要保证模型材料具有良好的透光性,以便于在测量区域获取信息。为了在加工过程中尽可能保持真实主动脉的几何特征,采用三维打印技术制作高还原度的真实主动脉阳模;此外由于主动脉模型空间形态复杂,基于现有工艺无法完成脱模操作,因此采用可以被溶剂溶解的塑料材料作为模型的打印材料;最后,为了保证测量结果的准确性与重复性,模型采用高透明硅胶,其固化后折射率与亚克力相近,但是其弹性模量远低于亚克力材料,更加适合制作主动脉弹性模型。
1.2 PIV检测平台搭建
PIV的检测平台由循环管路、摄像机、激光器以及图像后处理工作站组成(图2和图3)。PIV实验通过激光器发射激光,经过透镜的调整形成实验中所用的激光光源,激光光源垂直射到实验模型的待测区域,通过调整激光器的照射高度以及照射角度可以准确地照射到实验模型测量位置,以达到较为准确的实验结果。摄像机对实验图像进行捕捉时要保证镜头与片光源平面保持垂直。实验测量摄像机采用美国IMPERX公司的高分辨率CCD相机,型号为ICL-B4820,其分辨率高达1600万像素,全画幅下最高拍摄帧率为4.2 fps。实验照明光源采用半导体连续式激光器,其波长532 nm,输出功率为1.5 W。具有体积小、重量轻、移动方便等优点,但其发光功率小,因此适合小尺寸模型的流动实验。激光器发出的光束经柱棱镜组括束后形成片光源,照亮考察区域。流体内的示踪粒子采用密度为1.03 g/mm3的空心玻璃微珠,粒径为5 μm。图像处理计算中采用了互相关算法,通过高斯拟合确定粒子的重心,其计算精度可达±0.1像素,同时结合图像偏置及迭代算法,可将系统计算误差控制在1%以内。

图2 PIV实验循环台原理图

图3 PIV测试平台
2 结果
2.1 模型材料配比和加工工艺研究
为了保证主动脉实验模型的高透光性,实验采用透光率高、强度高、化学性质稳定的双组分高透明硅胶作为主动脉模型的制作材料。该材料拉伸强度为5 MPa,拉伸率300%,撕裂强度30 N/mm,固化后材料收缩率<0.3%。除此之外,该种材料的透光率稳定,在两种组分按照质量比例1:1混合,并且充分固化后,其折射率保持在1.4。在加工过程中,通过调节两种组分的比例来实现不同透明硅胶固化时间,当两种组分按照质量比1:1混合后,其在室温下的固化时间约为24 h。同时需要在这段时间内,利用抽真空机排出硅胶内参杂的气体微泡,以保证模型内部透光度一致。
主动脉模型的加工方案包括以下两类:第一种是利用硅胶的弹性直接开模工艺;第二种是利用硅胶浇筑可溶解的3D阳模的倒模工艺。由于主动脉结构复杂,具有高度的空间扭曲与血管分叉结构,无法利用硅胶进行直接脱模。因此选择第二种工艺制作模型,其加工工艺流程如图4所示。主要工艺路径如下所述。
(1)根据心衰患者CT数据重建主动脉三维几何模型。为了数值计算与PIV实验结果的一致性,流体模型以心室辅助装置辅助下主动脉几何模型为基础进行设计(图4a),模型包括出口插管、主动脉根、头臂干动脉、左颈总动脉、左锁骨下动脉及降主动脉等4个接口。由于模型中头臂干动脉、左颈总动脉与左锁骨下动脉距离较近,无法安装独立的管路接头,因此设计了一个内部接口将上述3根血管合并为一个出口管道。同时,为了方便与管道衔接,升主动脉口、插管入口及降主动脉口分别设计了楔形接口。
(2)将设计好的主动脉几何模型文件读入高精度3D打印机,对主动脉模型的阳模进行打印制作。主动脉的复杂几何模型决定了它无法采用常规方法进行脱模,因此选择能够溶解于无水乙醇的新型三维打印材料作为阳模打印材料。由于三维打印采用层堆积方式进行打印,因此所打印模型表面并不光滑,这样会极大地降低翻模之后硅胶模型的透光程度。为了解决这一问题,在模型打印完成后,采用超声波抛光装置对模型表面进行抛光处理,使模型表层材料溶解并再次凝固,从而形成光滑的外表面。为了降低抛光对模型几何特征的影响,每次抛光使用酒精不超过20 mL,抛光时间为20~30 min。制作完成的阳模模型如图4b所示。
(3)将制作完成的主动脉实验模型的阳模固定在事先准备好的矩形亚克力外壳中,并采用透明硅胶进行浇筑。本实验中选取双组份硅胶配置比为1:1。硅胶在配的时候需迅速搅拌充分,使两组分混合均匀。搅拌后会掺入较多的气泡,因此在灌注前,需用真空机将配置烧杯中的气泡抽真空排出。在硅胶的灌注环节中,需要保证硅胶模型的外表面光滑无杂质,这样才能保证激光打到模型后不会影响到光线的传输。灌注硅胶时需要把模型放置在一个透明的亚克力盒子中,保证亚克力外壳内表面无杂质,并在亚克力方盒的表面喷脱模剂,以保证拆除盒子时更加容易(图 4c)。
(4)灌注过程中也会夹杂入气泡,因此灌注完成后整个模型仍需要放入真空机继续抽真空(图4d)。
(5)灌注排气后的硅胶模型还需要将模型凝固与清洗。用真空干燥箱加热模型,待1~2天硅胶完全固化后,将模具拆除。通过加热可将模具轻易拆开,需要注意的是拆除过程中一定要注意保护盒内已成型的透明硅胶模型,避免外壳碰到硅胶模型壁面而形成划痕,影响实验时激光射入后拍摄图像,造成干扰(图4e)。
(6)将模型放入超声波振动仪中,利用超声波震动将酒精加热使模型需要部分溶解并经血管管道流出(图4f)。
(7)待3D打印模型溶解完全后,保证硅胶模型上无材料残留,在真空干燥机种加热(图4g)。
(8)待加热凝固完成,得到符合要求的全透明硅胶模型(图4h)。
(9)采用相同的工艺制作轴流式人工心脏的PIV实验模型(图5)。

图4 PIV实验模型加工工艺图

图5 轴流式心室辅助装置PIV实验模型
2.2 PIV实验模型的折射率补偿
由于模型来源于真实主动脉三维重建数据,虽然通过3D打印技术并且表面经过抛光平滑,但是其表面依然存在众多不规则并且拥有不同曲率的小曲面,对后续PIV实验带来了困难。由于受到模型内表面曲率变化以及本身硅胶材料折射率与实验流体折射率偏差的影响,PIV采集到的图像会出现扭曲失真。而基于失真图像进行后期粒子流动状态的分析会存在较大误差,甚至会导致分析失败。为了解决这一问题,需要对实验流体进行调配,调节液体折射率达到与硅胶一致,从而消除模型内表面曲率对于光线的折射与扭曲。
研究发现,通过调节水中的甘油与NaI浓度能够改变实验溶液的折射率,从而解决PIV图像扭曲失真的问题。由于甘油不仅能够改变实验溶液的折射率,对于溶液黏度也有直接影响,因此为了保证实验溶液与人体血液具有相近的黏度,研究中将甘油与水的体积固定在1:2,主要通过调节NaI的浓度进一步调节食盐溶液的折射率。为了验证实际效果,实验之前首先测量了模型在空气、水以及甘油-水-NaI溶液充满状态下的成像质量,如图6所示。空气填充状态下,主动脉模型流道内表面由于存在大量不规则曲面,与空气之间的折射率差异较大,因而造成了严重的扭曲,从图中可以看到主动脉模型流道内边界清晰;内部流动区域图像扭曲严重,无法透过流动区域看到背景上正交的栅格。与此相对,在流道覆盖区域之外,由于完全被透明硅胶覆盖,因此其成像效果良好,背景栅格没有出现扭曲变形。在这种条件下,对图像进行采集将无法获得有效的流动信息,见图6a;当使用纯水作为实验流体时,成像质量与空气模型有了很大程度地改善,透过模型看到背后正交的网格依然具有明显的畸变,这种畸变在流道边缘尤为明显,这种情况对于我们分析主动脉近壁面血流流动结构提出了很大挑战,见图6b;在使用甘油-纯水-NaI溶液作为实验溶液时,PIV成像质量比起前两种溶液有了极大的提高,几乎看不到主动脉流道边界的存在,并且流道背后的栅格正交性也得到了保证,这种高质量的PIV图像为获得精确度较高的主动脉内血流流动结构奠定了基础,见图6c。基于以上实验,最终确定在实验流体中NaI的质量比为20%。

图6 不同实验溶液折射率补偿
3 讨论
3.1 试验工况
遵循血液流动相似性原则,在保证模型中雷诺数Re不变的情况下,对主动脉模型开展实验,研究不同心室辅助装置辅助水平对主动脉内血流动力学环境的影响规律。试验环境温度为20℃,实验流体为按比例配置的甘油-纯水-NaI溶液。实验测量的工况如表1所示。

表1 工况详表
3.2 PIV实验结果与分析
实验结果如图7与8所示,通过PIV实验能够清晰观察到心室辅助装置内部血液流动特性,为评价心室辅助装置内部流场的合理性提供了重要的数据。从图7中可以发现,轴流泵入口(图7a)、出口(图7b)血流存在大量湍流流场,并且湍流区域与高剪切应力区域基本重合。从图8可以看出,测量得到在血泵出入口处的剪切应力最大值为180 Pa。将剪切应力的最大值作为后续检测的基础数值,根据血流流速与剪切应力的面分布确定血液测试的剪切应力曲线。

图7 心室辅助装置PIV结果

图8 心室辅助装置血液剪切应力结果
4 结论
PIV作为一种验证产品安全有效的评价工具,在产品研发阶段受到的广泛的应用。然而,在产品上市评价阶段,PIV结果作为客观证据证明产品安全有效的方式也逐渐被持续关注、研究并逐渐开始广泛应用。PIV虽然在模拟真实环境、成本和时效性等方面具有显著优势,但同样存在着试验结果依赖模型、边界条件等问题。本文研究PIV测试模型材料配比、加工工艺以及折射率补偿方法。采用透光率高、强度高、化学性质稳定的高透明硅胶进行PIV模型的制作,并通过工艺将折射率保持在1.4,通过调节NaI的质量比消除PIV图像扭曲失真问题。通过对心室辅助装置开展PIV测试参数优化和确认,有利于科学有效地评价心室辅助装置血流动力学性能,有助于形成合理的心室辅助装置血流动力学质量评价规范。

