外源激素对银杏雌株开花性状和开花相关基因表达的影响
石从广,周 琦,柳新红,李因刚,杨少宗,蒋冬月,沈 鑫,李海波
(浙江省林业科学研究院,浙江 杭州 310023)
银杏Ginkgo biloba具有适应性强、枝繁叶茂、雄伟挺拔、姿态优美等特点,为理想的园林绿化树种和观赏树种,世界上许多国家已把银杏作为庭荫树、行道树和观赏树广泛栽植,或制作成观叶和观实盆景[1]。银杏为雌雄异株,鉴于作为绿化的银杏雌株结实多,果实成熟时浆果掉落对地面造成污染,为了解银杏雌株结实机制,合理调控银杏雌株结实,有必要开展外源植物激素调控银杏雌株结实的内在机制及其应用研究。
关于木本植物花芽分化时期内源激素的动态变化研究表明,高水平的GAs(赤霉素)和ZT(玉米素)有利于麻风树Jatropha curcas雌雄花器官的发育;高水平的ZT含量,ABA/IAA(脱落酸/生长素),ABA/GA,ZT/GA利于文冠果Xanthoceras sorbifolium花芽的分化[2-3]。对银杏花芽分化过程中内源激素的变化规律研究表明,内源激素ABA,ZT和iPAs(异戊烯腺嘌呤类)与银杏雌花芽的诱导及分化密切相关[4-5]。
关于外源激素调控植物花芽分化的研究目前已在龙眼Dimocarpus longana[6],苹果Malus pumila[7-8],无花果Ficus carica[9]和鼠耳芥Arabidopsis thaliana[10-11]上有相关报道。这些研究表明,外源激素通过影响内源激素的比例从而影响植物的花芽分化,高含量的GAs和ABA不利于花芽分化,而高含量的CTK(细胞分裂素)则有利于花芽分化;喷施GAs能抑制花芽分化和雌花芽成花;但对鼠耳芥GA缺陷型和敏感型突变体的研究表明,GA合成和信号传导在花朵开放的过程中起到至关重要的作用,GA合成突变体ga1表现出了明显的花期推迟现象。
要阐明植物外源激素如何影响银杏开花,就必须从分子水平上对银杏开花的内在调控机制作深入探究。植物开花过程由内源因子和外源因素共同决定,植物开花(自主促进途径)所需的必要条件,主要涉及调控植物开花转换的相关基因。LFY(LEAFY)是目前研究得最清楚的与开花相关的转录因子[12-14]。与被子植物不同,银杏具有双拷贝的LFY同源基因[15],由于银杏是雌雄异株植物,其中一个LFY同源基因GinLFY在雌雄株上的序列也不尽相同,银杏雄株与雌株的GinLFY基因核苷酸序列同源性高达99%[16],银杏两个LFY同源基因GinLFY和GinNdly在其生长发育过程中有着截然不同的表达方式,GinLFY为组成型表达,而GinNdly属于组织特异性表达[17]。这种时空表达差异可能是裸子植物花进化发育的一个显著特征,也可能是造成银杏童期长的一个重要因素[18]。AG(AGAMOUS)基因是植物花器官特异性基因,决定雌蕊、雄蕊的分化和形成。从银杏基因组中分离得到的AG同源基因GBM5为单拷贝,除了在生殖器官雄蕊、胚珠以及雌配子体有表达之外,在雌雄株的幼叶中也有表达[19]。
国内对于银杏雌雄株花芽的形态分化已有报道[20-21],也有基于转录组测序的银杏花芽分化时期相关基因筛选与表达分析的研究,并对筛选出的与开花调控相关的GbCOL基因进行生物信息学分析,推测其可能在银杏开花调控过程中发挥重要作用[22-24]。但从分子水平上研究外源激素如何通过影响开花相关基因的表达从而调控银杏开花的机制,迄今尚未见报道。
银杏是裸子植物,其调控开花的相关基因不能套用ABC模型,本文根据已报道的银杏开花相关基因GinLFY,GinNdly和GBM5的序列,设计合适的引物,利用实时荧光定量PCR(RT-qPCR)手段来检测这些基因在不同外源激素处理间转录水平的差异。基于对组织特异性表达的基因进行相对定量表达的尝试在取样上比较困难,很少有公开报导,本研究尝试在银杏花芽分化始期施加外源激素GA3与PP333,探讨外源激素如何通过影响银杏开花相关基因的表达来抑制或促进银杏的开花结实,为揭示外源激素调控银杏花芽分化的分子机制提供另外一种研究视角。
1 材料与方法
1.1 材料与试剂
在浙江省长兴县名圃苗木场(以下简称苗木场)选取15株已结实的10年生银杏雌树,于每年休眠期和开花期各施用有机肥(羊粪)一次,每株每次施有机肥2 kg,正常的除草管理。
外源激素GA3为赤霉素粉末状结晶,PP333为50%多效唑可湿性粉剂,使用前分别溶解成1 g·L-1和 0.5 g·L-1的原液,4℃冷藏备用,喷施时稀释成不同浓度,现配现用。
RNA提取:TaKaRa MiniBEST Plant RNA Extraction Kit(TaKaRa Code.9769)试剂盒;DNA消除:PrimeScript RT reagent Kit with gDNA Eraser试剂盒;RT反应和PCR反应:5×PrimerScript Buffer (for Real Time),SYBR Premix Ex Taq II (2×)。
1.2 仪器与设备
沃傲麒3 m金属头高枝剪,安胜达园林公司;双肩背负高压喷雾器16 L型,沃施(Worth)园艺;StepOne型荧光定量PCR仪,Applied Biosystems公司。
1.3 试验方法
1.3.1 喷施外源激素和统计开花结实的表型指标 2018年4月初,在苗木场将选取的15株银杏雌株进行分组编号,每5株为一组,从每组中分别随机选取3株作为样株(分别编号为1-1,1-2,1-3;2-1,2-2,2-3;CK-1,CK-2,CK-3),在每株样株上用高枝剪剪取5~ 10个结果枝(用标签进行编号),用来统计开始绽放的花芽和叶芽数目,统计后用软尺测量结果枝长度,计算单位长度(每米)银杏结果枝上的雌花芽数(number of flower bud per meter,NFB)和叶芽数(number of leaf bud per meter,NLB)以及两者的比值(ratio of flower bud to leaf bud,RFL);每米结果枝芽头数(number of bud per meter,NB)是NFB和NLB之和,每米结果枝平均芽头数(average number of bud per meter,ANB)为每处理3个重复的平均值,同理可以推断每米结果枝平均花芽数(average number of flower bud per meter,ANFB)和每米结果枝平均叶芽数(average number of leaf bud per meter,ANLB)。然后在银杏花芽分化始期(6月)用高压喷雾器分别喷施200 mg·L-1GA3(1-1,1-2,1-3),100 mg·L-1PP333(2-1,2-2,2-3)和清水(CK-1,CK-2,CK-3),每间隔7~ 10 d喷施一次,共喷施3次。
2019年4月初,以同样的方式剪取银杏结果枝,统计开始绽放的花芽和叶芽数,并采集叶芽和花芽,将每个单株上采集的花芽和叶芽混合后作为一个样品,每个处理3个单株即3个样品(重复),放入锡箔纸中包裹起来,在锡箔纸上用记号笔填写对应编号然后投入干冰盒中,用作后续的RNA提取和反转录以及RT-qPCR试验材料。如上再一次统计绽放的花芽和叶芽数,测量结果枝长度,计算ANB,ANFB,ANLB和RFL等指标。
1.3.2 RNA提取和RT-qPCR试验 以采集到的3个处理的9个花芽、叶芽混合样品为材料,用TaKaRa MiniBEST Plant RNA Extraction Kit (TaKaRa Code.9769) 试剂盒提取各个样品的RNA,经DNA消除酶试剂盒PrimeScript RT reAGent Kit with gDNA Eraser纯化后再进行RT反应,基因组DNA去除反应体系包含5×gDNA Eraser Buffer 2 mL,gDNA Eraser 1 mL,Total RNA (50 ng·mL-1) 2 mL,RNase Free ddH2O 5 mL,共计10 mL;42℃处理2 min。RT反应体系包含上述反应液10 mL,5×PrimerScript Buffer (for Real Time) 4 mL,PrimeScript RT Enzyme Mix I 1 mL,RT Primer mix 1 mL,RNase Free ddH2O 4 mL,37℃保持15 min,然后85℃保持5 s。
根据已报道的银杏开花相关基因GinLFY,GinNdly和GBM5的序列,参照RT-qPCR引物设计原则,利用在线网址http://bioinfo.ut.ee/primer3-0.4.0/primer3/input.htm设计各候选基因的RT-qPCR引物(表1)。引物序列由宝生物工程(大连)有限公司 (Dalian Takara Biotechnology Co.,Ltd.) 合成,以GAPDH为内参基因[25],采用Step One(ABI)进行RT-qPCR反应,用2-△△CT法对这些差异表达基因的表达水平进行均一化处理[26],通过内参基因的校正,对样品中目的基因mRNA表达量进行分析。
PCR反应体系为25 μL(RR820反应体系),包括SYBR Premix Ex Taq II (2×)12.5 mL,Primer F/R(10 μmol·L-1)各1 mL,RT产物2 mL,ddH2O 8.5 mL。反应程序为:95℃ 30 s,95℃ 5 s,各引物退火温度30 s,40 Cycles。扩增完毕后,温度以每0.5℃·10 s-1的速率从60℃缓慢递增到95℃,连续测定样品的荧光强度以获得溶解曲线。在每个反应过程中,每个内参基因的RT-qPCR均设置阴性对照,以检验该基因扩增反应的背景,每份样品设置2个平行样。
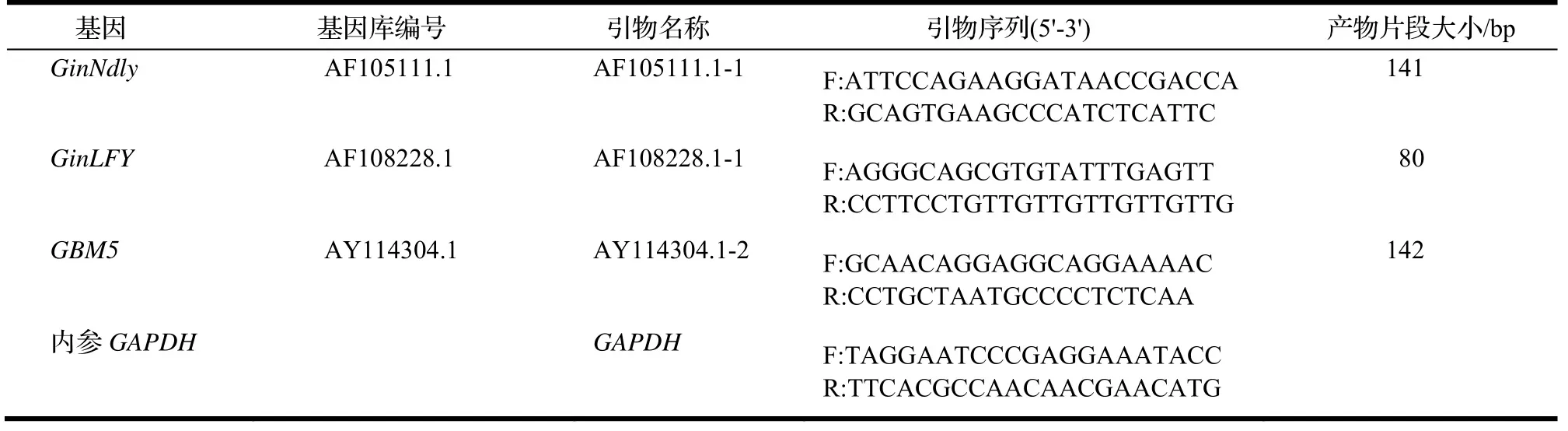
表1 定量PCR引物序列和对应的扩增片段Table 1 Sequences and corresponding amplified fragment of quantitative PCR primers
1.3.3 数据分析 利用SPSS 20.0软件的单因素方差分析(One-Way ANOVA)方法分析GA3和PP333处理对银杏雌株花芽分化的影响,采用最小显著差异法(LSD)分析各处理间和各年份间的差异显著性,并用Excel作图;采用Pearson单变量Bivariate correlations方法,对GinLFY,GinNdly和GBM5基因的表达量与结果枝花芽叶芽数量性状进行相关分析。
2 结果与分析
2.1 喷施外源激素对银杏雌株每米结果枝花芽和叶芽数的影响
对不同处理和不同年份的各花芽叶芽指标的平均值进行方差显著性分析经,结果见表2。由表2可知,RFL和ANB在不同处理和不同年份间均无显著性差异,但ANFB在不同处理和不同年份间存在显著差异,其中GA3处理的ANFB显著高于PP333处理和CK,但GA3处理中2019年的ANFB略低于2018年的,且两者间存在显著差异,说明施用GA3后,银杏雌株结实势头有所抑制;PP333处理中2019年的ANFB显著高于2018年,两者间存在显著差异,说明施用PP333后能适当促进银杏雌株结实;CK处理中2019年的ANFB与2018年的基本持平,两者间不存在显著差异。ANLB在不同处理和不同年份间也存在显著差异,但在GA3处理和PP333处理中,不同年份间却不存在显著差异,说明喷施外源激素对银杏叶芽的形成没有明显的影响。

表2 2018年和2019年结果枝平均花芽和叶芽数统计分析Table 2 Analysis of ANFB and ANLB on fruit-bearing branches in 2018 and 2019
2.2 RNA提取与引物验证结果
由图1可知,除了引物AF108228.1-1的扩增条带稍显暗淡且扩增产物片段长度小于100 bp,其余3对引物的扩增条带单一且明亮,扩增产物片段长度都在100~ 200 bp之间,其中引物GAPDH的扩增片段最长,预测在180 bp左右,引物AF10511.1-1和AY114304.1-2的扩增片段长度目测在150 bp左右,符合表1引物设定时各引物对应的预测产物片段大小。由图1的结果说明,设定的引物都能扩增到特异且单一的条带,扩增出的片段长度与预期的相符合,所设定的4对引物适用于RT-qPCR试验。
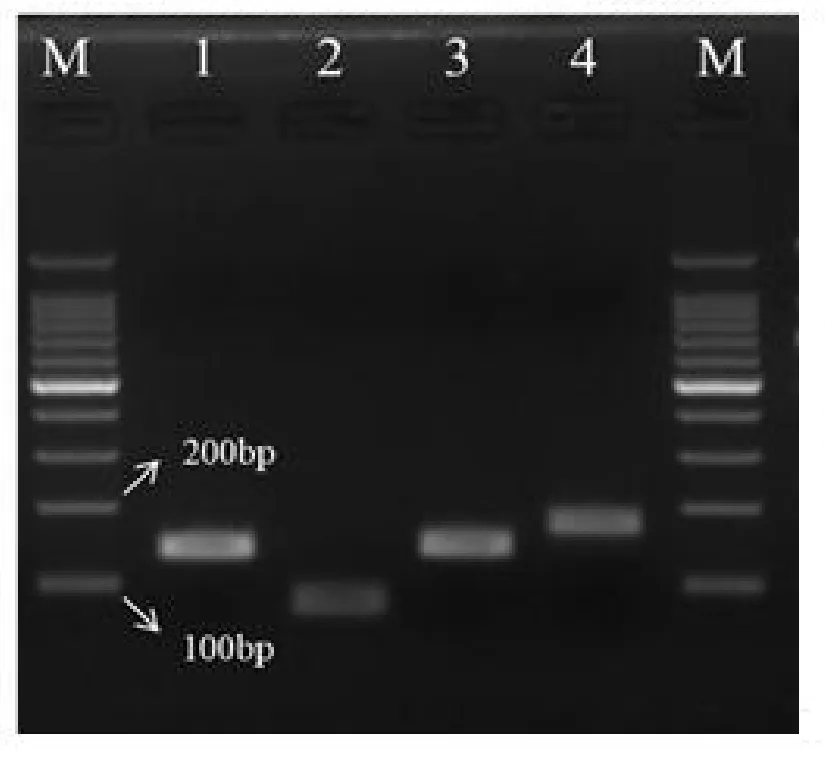
图1 4对定量引物的PCR扩增电泳图Figure 1 PCR amplification electrophoresis of 4 pairs of quantitative PCR primers
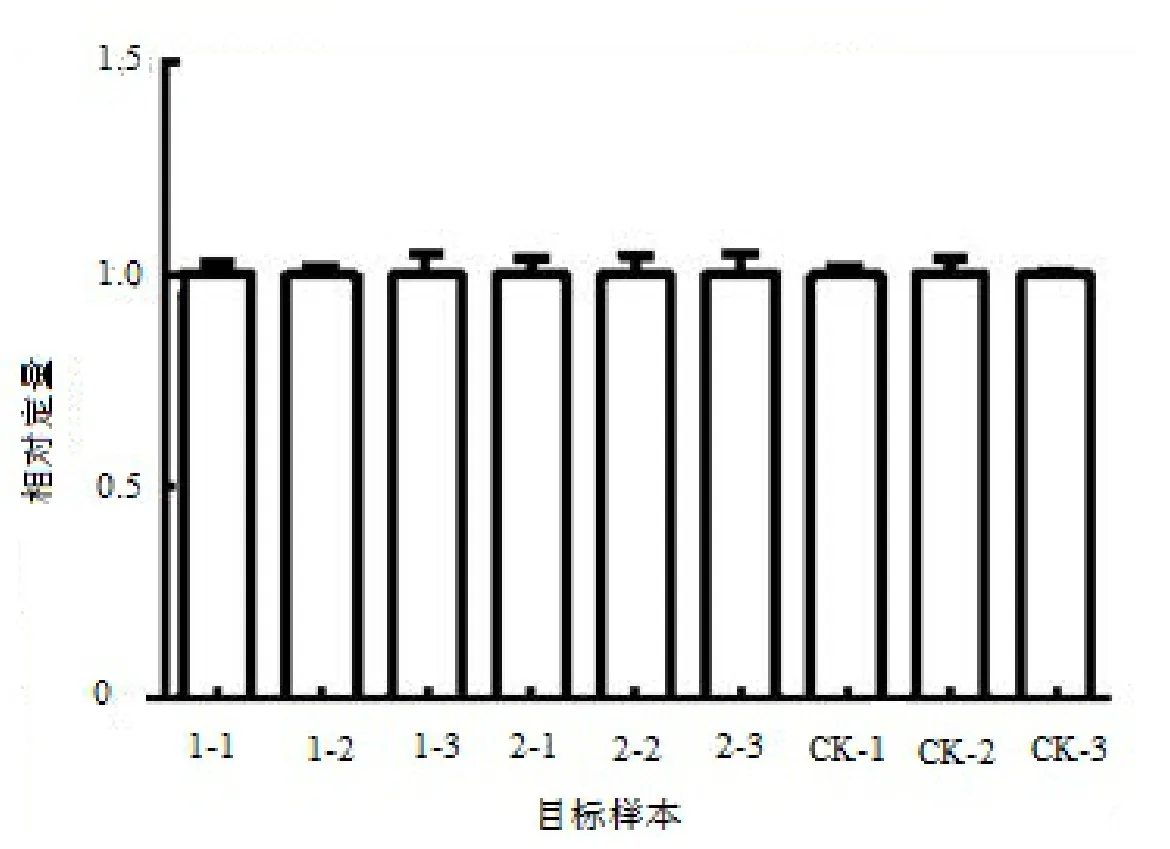
图2 内参基因GAPDH 在9个银杏雌株混合芽样本中的RT-qPCR表达量Figure 2 Expression quantity of internal reference gene GAPDH in mixed buds of 9 female G.biloba trees
2.3 GinLFY,GinNdly 和GBM5 基因在9个银杏雌株混合花芽中的表达情况
内参基因GAPDH在9个银杏雌株混合芽中的表达量(即ΔΔCT Rel.Qty(SDM)值,以下简称ΔΔCT)见图2。由图可知,内参基因在各处理与各样品间的表达较为稳定,表达量水平均在1.0左右,各单株之间的表达量均无显著差异(P<0.05),符合作为检测基因参照物的条件。
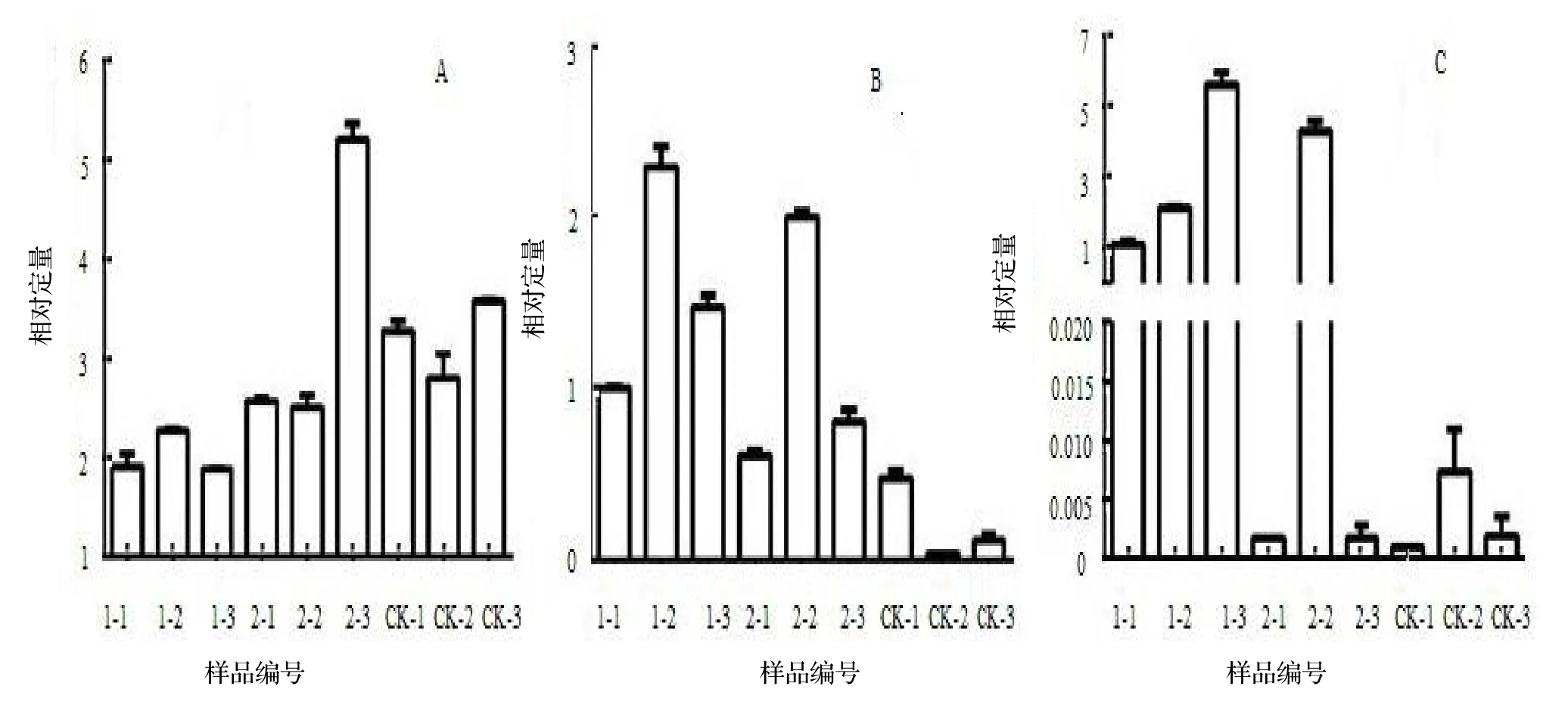
图3 3个银杏开花相关基因在9个银杏雌株混合芽中的相对表达量Figure 3 Relative expression of 3 flowering related genes of G.biloba in mixed buds of 9 female trees
由图3A可知,GinNdly基因在9个银杏雌株混合芽样品中的表达量比较平稳,喷施GA3和PP333二种外源激素后GinNdly基因的表达量与对照相比均无显著差异(表3),表明激素处理对银杏雌株混合芽GinNdly因的表达没有明显的诱导作用。不同的是,GinLFY基因和GBM5基因在二种激素处理后总体上皆呈上调表达(图3B-C)。方差显著性分析(表3)显示,对于GinLFY基因,对照的ΔΔCT平均值为0.208±0.231,显著低于GA3处理的1.579±0.645(P<0.05),也低于PP333处理的1.130±0.748;对于GBM5基因,对照的ΔΔCT平均值为0.003±0.003,显著低于GA3处理的2.714±2.181(P<0.05)和PP333处理的1.654±2.862(P<0.05)。这表明二种激素处理对于银杏雌株混合芽GinLFY和GBM5基因的表达具有显著的诱导上调作用。

表3 各处理对应的3个基因的相对表达量的差异分析Table 3 ANOVA on relative expression of the 3 genes corresponding to each treatment
2.4 基因相对表达量与结果枝花芽叶芽数量性状的相关性
采用Bivariate correlations方法,对GinLFY,GinNdly和GBM5基因的表达量与2019年9个单株结果枝的花芽、叶芽数进行相关分析,结果见表4。由表4可知,RFL与NFB之间呈极显著正相关,其Pearson相关系数为0.948,与NLB间呈极显著负相关,其Pearson相关系数为-0.826;此外,NFB与NLB之间呈极显著负相关,其Pearson相关系数为-0.833,说明在一定长度的结果枝内,花芽数越多叶芽数相应越少,基因AF108228.1(GinLFY)和AY114304.1(GBM5)的相对表达量与平均花芽数呈一定的正相关(Pearson相关系数分别为0.348和0.481),而基因AF105111.1(GinNdly)的相对表达量与平均花芽数呈一定的负相关(Pearson相关系数为-0.590),但相关性均不显著;基因AF108228.1(GinLFY)与AY114304.1(GBM5)的相对表达量呈显著的正相关关系(Pearson相关系数0.746),说明两个基因的表达具有较高的同步性。
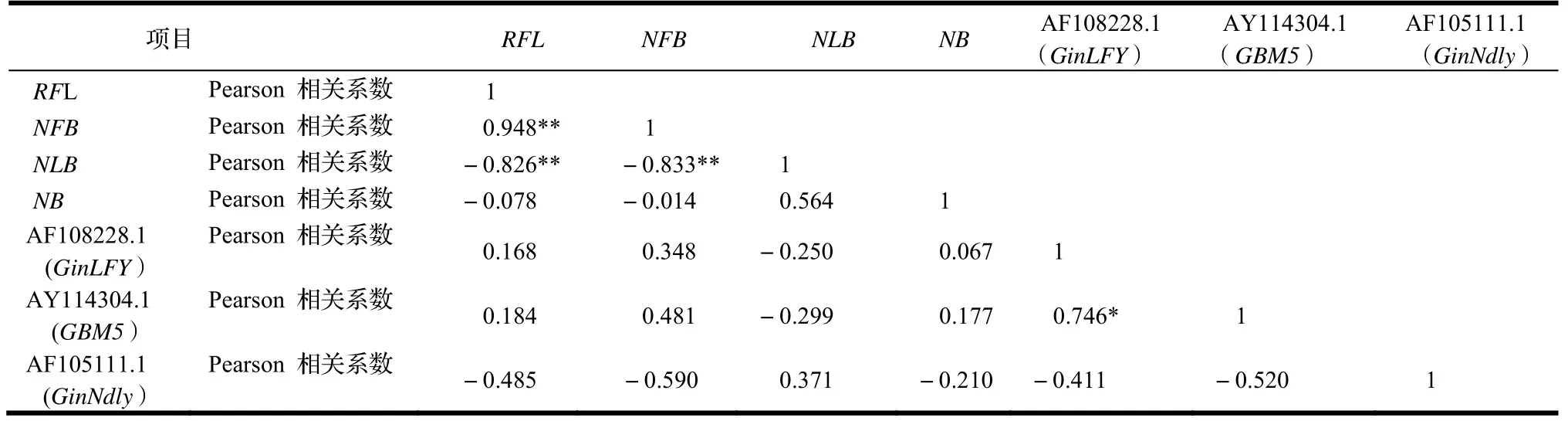
表4 基因相对表达量与结果枝花芽和叶芽性状的相关性Table 4 Correlation between relative gene expression and the traits of flower and leaf buds on bearing shoots
3 讨论
Thomas等[12]在研究植物开花控制的分子和遗传机制时对这些开花相关基因的功能进行了验证和归类,发现LFY基因的功能主要是作为一个开花开关决定着花分生组织的分化;Dilusha等[14]指出LFY的下游直接靶基因是花器官特异基因AP1和CAL,在植物开花的起始阶段起着重要作用,作为一个开花转换开关,决定花序分生组织向花分生组织的转换。本研究结果表明,外源激素处理对银杏雌株混合芽GinNdly基因的表达没有明显的诱导作用,而对GinLFY基因的表达有显著的诱导上调作用,说明GinLFY基因与银杏雌株的开花密切相关,但郭长禄等[17]的研究结果显示GinLFY为组成型表达,而GinNdly属于组织特异性表达,相较而言,组织特异性表达的GinNdly基因对外源激素的响应较为敏感,这与本文的结果有所不同,可能的原因是取样不完整,再加上每次逆转录和扩增的效率不尽相同,所以导致处理间各单株的相对表达量误差比较大。
已有研究表明AP1,AP2,AP3,AG等都是花器官特异性基因[12],控制着花各部分组织的发育和形成,GBM5是银杏基因组中分离得到的AG同源基因[19],故GBM5基因很有可能决定银杏雌蕊/雄蕊的分化和形成,这与本文的推论即GBM5基因是影响银杏雌株开花结实的主要因子基本相吻合。近年来,在花器官发育过程中具有重要作用的MADS-box转录因子基因家族成员也相继从银杏中克隆,包括隶属AG的GbMADS2基因[28],有望调控开花周期和促进抗逆境胁迫的GbMADS9基因[29],GbSEP基因[30]。此外,最近从银杏克隆的开花基因FRIGIDA(GbFRI)可调控MADS-box转录因子FLC(Flowering Locus C.)基因的功能,FLC可阻遏银杏开花进而导致开花推迟,是调节开花周期的主要抑制因子。因此FRIGIDA基因的克隆为银杏春化途径的深入研究奠定了基础[31]。这些从银杏中新克隆的开花相关基因也为进一步深入研究外源激素如何调控银杏开花的分子机理拓展了思路。
总之,本研究为揭示外源激素如何影响开花相关基因表达从而调控银杏花芽分化的分子机制提供了间接的视角,如果把喷施外源激素GA3可以抑制银杏雌株开花的结论应用到生产实际中,则能大大减少人工疏果成本,提高种植银杏雌株成年雌株的经济效益。
限于客观条件,本研究仅在某个时间点对9个银杏单株的花叶混合芽进行了3个开花相关基因的定量表达分析,并与当年开花结实的表型性状进行了相关分析,没有测定喷施外源激素前后结果枝内源激素比例的变化,也没有进行多年的观察统计和取样,这是本研究的不足之处,对外源激素调控银杏雌株开花结实的分子机理的研究还需进一步从外源激素喷施前后结果枝内源激素比例变化和基因表达变化等方面加以深入。
4 结论
外源激素调控银杏雌株开花结实的分子机理大致可总结为:花发育相关基因构成一个复杂的网络共同调控银杏开花;外源激素通过打破内源激素平衡来调控,调控过程涉及到许多上下游基因的表达。本研究表明上游开花相关基因GinLFY基因的表达水平与平均花芽数呈一定的正相关,在施用外源激素处理组(GA3和PP333)后呈上调表达,说明GinLFY基因与银杏雌株的开花密切相关且对外源激素的响应较为敏感,很可能是调控银杏雌株开花结实的外围因子。下游开花基因GBM5基因的表达水平与平均花芽数呈正相关,在施用外源激素后呈上调表达,且与GinLFY基因的表达具有较高的同步性。据此推断,上游开花相关基因GinLFY表达的上调和下调决定GBM5基因的相对表达,从而影响银杏的开花结实。

