思茅松HMGS基因的克隆与表达分析
李云琴, 原晓龙, 李 江, 王 毅, 陈 伟
(1.云南省森林植物培育与开发利用重点实验室,云南昆明650201;2.国家林草局云南珍稀濒特森林植物保护和繁育重点实验室,云南昆明650201)
思茅松(Pinus kesiya var.langbianensis)为松科(Pinaceae)松属植物,是云南重要的产脂资源树种[1]。松脂包含松节油和松香,思茅松松香年产量超过2.5×105t,松节油产量超过6×104t。松脂是一种萜类混合物,而萜类化合物(类异戊二烯)在自然界中广泛存在。根据异戊二烯的单元可将萜类化合物分为单萜、倍半萜、二萜和三萜等[2],松节油就属于单萜和倍半萜类,松香属于二萜类。萜类化合物是很多植物化感作用的关键物质,在农业、工业、医药生产等领域也被广泛应用。
萜类物质在植物中主要由甲羟戊酸途径(mevalonate pathway,MVA)和甲基赤藓醇4-磷酸途径(methylerythritol 4-phosphate pathway,MEP)2条途径合成[3]。3-羟基-3-甲基戊二酰辅酶 A合酶(3-hydroxy-3-methylglutaryl-CoA synthase,HMGS)属于MVA途径中的第1个催化酶,可以催化1个乙酰辅酶A与乙酰乙酰辅酶A缩合成3-羟基-3-甲基戊二酰辅酶A,然后在3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl-CoA reductase,HMGR)的催化下形成异戊烯基焦磷酸(isopentenyl diphosphate)[4],从而为单萜、二萜等萜类化合物的合成提供前体异戊烯基焦磷酸。目前,HMGS基因已在20余种植物中被克隆,如拟南芥(Arabidopsis thaliana)[5]、樟子松(Pinus sylvestris var.mongolica)[6]、茶树(Camellia sinensis)[7]等,但尚未见思茅松的相关报道。因此,从思茅松的转录组数据挖掘并克隆得到思茅松HMGS基因的全长序列,通过生物信息学分析预测该基因,采用转录模式分析该基因在不同处理和组织中相对表达量。以期为进一步探讨HMGS基因在高产脂思茅松二萜类物质生物合成中的作用,从而为揭示思茅松高产脂的分子机理提供理论依据。
1 材料与方法
1.1 材料
从云南普洱市景谷县半坡乡(23°47′47.8″N, 100°27′55.8″E)采集思茅松(0.5 kg<年产脂量≤30.0 kg)作为高低产脂样品,高产脂思茅松样品用于转录组测序;低产脂个体用于与高产脂个体一同分析基因表达量。树脂的测定参照文献[8-9],用 “V”型下降采脂法。采用物理割伤的方式处理高低产脂的思茅松树皮,采集处理后0、6和12 h的各组织样品,并迅速放入液氮中保存带回实验室。
1.2 转录组分析组装与RNA提取
在对cDNA文库进行测序之后,通过修剪原始读取以删除适配器序列、Q值小于20或不明确碱基(N)的低质量读取来生成高质量的干净读取;然后使用Trinity平台(http:∥trinityrnaseq.sf.net.)重新组装干净的读数;所有的基因被用作检索Nr、eggNOG、GO、KO和Swissprot数据库(E值<10-5)的查询,并用Blast 2 GO软件进行GO分析(E值<10-5);利用KEGG图谱预测代谢途径[9]。
采集高、低脂产量思茅松树皮,立即液氮冷冻。按照植物总RNA提取试剂盒(康维世纪)说明书分别提取各样品的RNA,用1%琼脂糖凝胶电泳检测其完整性和质量,用Thermo USA的分光光度计检测浓度。选择较为完整且浓度适宜的RNA按照RevertAid第一链cDNA合成试剂盒(Thermo Scientific)的说明书合成cDNA第一链,并将cDNA放入-20℃冰箱中。
1.3 思茅松HMGS基因克隆
以HMGS基因序列为依据,设计含有起始密码子的(PkHMGSF:5′-ATGGCATCTCGTCCAGAGAA-3′)和含有终止密码子的(PkHMGSR:5′-TTACAATTCATCATGGGTGG-3′)特异引物。以高产脂思茅松树皮cDNA为模板,PkHMGSF和PkHMGSR为引物,EasyPfu DNA聚合酶进行聚合酶链式反应(polymerase chain reaction,PCR)扩增得到思茅松HMGS全基因片段,命名为PkHMGS。经电泳检测后将目的片段连接到pGEMT载体上,经菌落PCR检测,选择阳性克隆送往上海生工进行测序。
1.4 思茅松HMGS基因蛋白生物信息学分析
用NCBI(http:∥www.ncbi.nlm.nih.gov/)在线软件ORFFinder(https:∥www.ncbi.nlm.nih.gov/orffinder/)推测PkHMGS基因的cDNA序列的蛋白序列,用ProtParam(https:∥web.expasy.org/protparam/)预测PkHMGS蛋白的理化性质。在NCBI中搜索并选择与PkHMGS蛋白序列同源性较高的其他植物的HMGS蛋白序列,经过与思茅松的HMGS蛋白进行多重比对后,用软件MEGA 6.0构建系统进化树。
1.5 思茅松HMGS基因不同组织的表达分析
分别取2μg高低产脂思茅松个体的小枝、树皮和松针的RNA,按照反转录试剂盒说明合成cDNA第一条链。用小枝、不同处理的树皮和松针的cDNA为模板,以特异引物TPkHMGSF和TPkHMGSR进行荧光定量PCR(real-time polymerase chain reaction,RT-PCR)分析,并以阿尔法延长因子基因作为内参基因。具体反应体系如下:分别向PCR管中加入12.5μL 2×SYBR Green master mix、引物各0.5μL、1μL cDNA、10.5μL的ddH2O。用ABI 7300 Real Time PCR System检测PkHMGS基因在不同组织中的表达情况,共进行3个生物学重复。
2 结果与分析
2.1 RNA提取与基因克隆
按照植物总RNA提取试剂盒的说明提取各样品RNA,以含有起始密码子的PkHMGSF和终止密码子的PkHMGSR为引物,以高产脂思茅松韧皮部的cDNA为模板,用EasyPfuDNA聚合酶进行PCR扩增获得目的基因全长。连接后阳性克隆的测序结果显示,思茅松HMGS基因开放阅读框全长1 425 bp(图1)。
2.2 思茅松HMGS蛋白序列分析
利用ORF Finder以及Prot Param软件分析PkHMGS基因的蛋白序列,结果表明PkHMGS基因共编码474个氨基酸,其相对分子质量为53 028.17,理论等电点为5.61。在Blast上用得到的474个氨基酸序列与已知的其他植物的HMGS蛋白序列进行相似性对比(图 2),结果显示,PkHMGS拥有 HMGS所特有保守序列GNTEIEGVDSTNACYGGTA[10];思茅松与樟子松(PinussylvestrisCAA65250.1)HMGS的蛋白序列同源性为99.79%,与曼地亚红豆杉(Taxus×mediaAAT73206.1)HMGS同源性为85.29%,与银杏(GinkgobilobaAUW64606.1)HMGS同源性为82.70%。

图2 HMGS蛋白序列比对Figure 2 HMGSprotein sequence alignment
图1 思茅松HMGS总RNA电泳图Figure 1 RNA electropherogram of the HMGS gene from P.kesiya var.langbianensis
2.3 系统进化树分析
在NCBI上获得其他植物的HMGS蛋白序列,用MEGA 6.0构建分子进化树。结果表明,进化树大致分为3个支系,思茅松与裸子植物樟子松(CAA65250.1)、曼地亚红豆杉(AAT73206.1)、银杏(AUW64606.1)聚为1个支系,而在裸子植物中,思茅松的HMGS与同为松属的樟子松的HMGS亲缘关系最近(图3),该基因的进化规律与植物的进化历程一致。

图3 思茅松与其他植物HMGS系统进化树Figure 3 HMGSphylogenetic tree including P.kesiya var.langbianensis
2.4 思茅松HMGS基因在不同组织中的表达分析
以特异引物TPkHMGSF和TPkHMGSR检测PkHMGS基因在高产脂和低产脂思茅松的树皮、小枝、松针等组织中的表达量。由图4可知,在思茅松各组织中,PkHMGS基因在松针中表达量最高,然后从高到低依次为人工创伤后6 h的低产脂思茅松树皮,人工创伤后12 h的高产脂思茅松树皮和高产脂的小枝,人工创伤后12 h的低产脂思茅松树皮,低产脂树皮,人工创伤后6 h的高产脂思茅松树皮,低产脂小枝,高产脂树皮。在高产脂思茅松的树皮中,PkHMGS基因的人工割伤诱导表现为随着割脂时间的延长(0~12 h),表达量逐渐增高,在人工创伤后12 h的树皮中表达量最高;在低产脂思茅松树皮中,PkHMGS基因的人工割伤诱导表现为随着割脂时间的延长(0~12 h),表达量为先升后降。PkHMGS基因在高低产脂思茅松中的表达量总体表现为松针最高。PkHMGS基因在思茅松受到割脂物理伤害后树皮中的表达量变化,表明其受到割脂物理伤害的诱导表达。
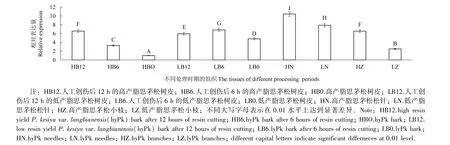
图4 思茅松HMGS基因表达谱Figure 4 P.kesiya var.langbianensis HMGS gene expression profile
3 讨论与结论
伴随着分子生物学的发展,与萜类物质生物合成途径相关的酶基因不断被克隆与研究。MVA途径是进行萜类化合物合成的重要途径,而HMGS催化乙酰辅酶A与乙酰乙酰辅酶A缩合生成羟甲基戊二酸辅酶A,再经过一系列酶促反应生成异戊烯焦磷酸(isopentenyl pyrophosphate,IPP),作为萜类化合物合成的通用前体[10-12]。HMGS是MVA途径的重要催化酶,其表达强度和含量会影响萜类化合物的含量[7,13]。思茅松是云南重要的松脂资源树种,松脂中的松香正是二萜类物质。这些萜类化合物在植物中具有防御作用,还能调节植物的生长和发育[2,14-15]。本研究利用转录组测序技术获得高产脂思茅松的HMGS序列,并利用RT-PCR技术首次在思茅松中克隆到一个具完整开放阅读框的PkHMGS基因,该基因全长为1 425 bp,编码474个氨基酸。与NCBI中已知植物的HMGS构建分子进化树分析显示思茅松HMGS与裸子植物HMGS聚为1支,其中与樟子松亲缘关系最近,蛋白序列的同源性为99.79%,符合遗传进化规律。生物信息学分析结果表明,PkHMGS基因含有HMGS蛋白的典型保守序列GNTEIEGVDSTNACYGGTA,说明克隆到的PkHMGS基因属于3-羟基-3-甲基戊二酰辅酶A合酶基因。
不同植株中HMGS基因的组织表达特性不同[16]。荧光定量PCR显示,PkHMGS基因在思茅松的树皮、小枝、松针中均有表达,但是松针的表达量较高,以高产脂思茅松松针表达量最高。按照源库理论(source-sink theory)[17],“源”是有机物合成和输出的组织或器官,“库”则是同化物转化或贮藏的组织或器官[18],将松针作为源,树皮作为库,PkHMGS基因在松针中表达量较高的株系,在其贮藏组织的树皮中基因表达量较高,最终松脂含量是否也较高,还需要做进一步研究。PkHMGS基因在树皮中的表达明显受到割脂物理伤害的刺激,说明割脂诱导可使思茅松的产脂活力增强,PkHMGS基因与松脂代谢相关。但当高产脂和低产脂思茅松植株受物理伤害的刺激程度和时间不同时,低产脂思茅松PkHMGS基因高量表达的时间比高产脂思茅松短,可能是因为低产脂思茅松树脂道凝结快,而高产脂思茅松树脂道凝结慢,因而低产脂的思茅松比高产脂的防御机制更强,伤口愈合更快,具体还需要做进一步研究。
有研究表明,HMGS基因可能与3-羟基-3-甲基戊二酰辅酶 A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase,HMGR)基因共同协同调控整个MVA途径[13,19-21],HMGR基因表达量的上调能够显著增加植物的类异戊二烯物质含量,同源及异源HMGR基因的过表达,能够显著促进受体植株中类异戊二烯物质含量的增加[22]。对于PkHMGS下一步的研究也可以考虑利用转基因技术进行遗传改良来培育高产脂思茅松植株。

