基质金属蛋白酶-8在寻常型银屑病患者血清及皮损中的表达研究
林路洋, 田歆, 张三泉, 陈晓吟, 梁艳华, 毕超, 谭剑萍, 张锡宝
(广州市皮肤病防治所,广东 广州 510095)
基质金属蛋白酶(matrix metalloproteinases, MMPs)属于一组结构相似、依赖金属Zn2+实现其蛋白酶活性的肽链内切酶家族。在生理情况下,MMPs转录处于低水平,但当发生组织损伤,出现炎症反应时,其局部表达水平迅速上升,因此MMPs是机体对外刺激产生宿主免疫的重要组成部分,其主要功能是调控一些非基质蛋白活性,如:细胞因子、生长因子、抗菌肽、趋化因子等[1]。MMPs在寻常型银屑病(psoriasis vugaris,PV)中的作用主要包括调节炎症反应、组织重塑、细胞迁移及血管扩张及血管新生[2]。近来有研究表明MMP-8与免疫细胞浸润、上皮细胞增殖及迁移、血管新生相关[3-5],上述均为PV的典型病理改变。为探究MMP-8在PV中的作用,本研究观察了PV患者血清及皮损中MMP-8的表达,现将结果报告如下。
1 材料与方法
1.1 一般资料
纳入2018年12月至2019年8月来我院皮肤病门诊就诊并进行病理检查的PV患者20例,均符合最新银屑病诊疗指南[6],排除近1个月有系统性用药史者。其中男16例,女4例;年龄11~77岁,平均(37.10±17.56)岁;病程1个月~13年,平均(4.03±4.31)年。按银屑病面积和严重程度指数(psoriasis area and severity index,PASI)评分分组[7-8]:轻度组(PASI<3)6例;中度组(3≤PASI<10)6例;重度组(PASI≥10)8例。对照血清取自我院职工体检健康者,共12例,其中男9例,女3例;年龄25~53岁,平均(36.67±9.69)岁。对照组与患者组性别(2=0.11,P=0.74)、年龄(t=0.09,P=0.929)差异均无统计学意义,具有可比性。本研究经本院医学伦理委员会审批通过(批件号:201502),受试者均签署知情同意书。
1.2 主要试剂和仪器
MMP-8 ELISA试剂盒(R&D Minneapolis, MN, lot: 286200);小鼠抗人MMP-8一抗(Abcam公司,Cat:ab53017),山羊抗小鼠IgG二抗(Sigma公司,Cat: A3562);mRNA提取试剂盒(赛默飞公司,Cat: 61006)。酶标仪(爱康Uranuas AE 120);PCR仪(ABI-7500型荧光定量PCR仪);光学显微镜(日本OLYMPUS BX51)。
1.3 方法
1.3.1 ELISA检测患者及对照血清中MMP-8水平 用普通干燥管采集患者及正常对照组静脉血5 mL,250 g离心10 min,分离血清,用稀释液1∶4稀释(均用复孔检测)后加入200 μL至微孔,同时设置MMP-8梯度浓度标准品对照;震荡器混匀,室温孵育2 h,用洗液洗4次;加入200 μL酶标抗体,混匀,室温孵育2 h;洗4次,加入底物200 μL,室温孵育30 min;加入终止液50 μL终止反应,30 min内在450 nm波长下读取吸光度值;用标准品吸光度值绘制标准曲线,计算出各样本浓度。
1.3.2 荧光定量PCR检测皮肤组织MMP-8表达 取皮损部位及相邻未受累外观正常皮肤提取mRNA,经反转录获取cDNA,用荧光定量PCR方法(探针法)检测MMP-8;MMP-8引物由达安公司合成并进行Q-PCR实验,引物序列:forward: 5′-CCATCTATGGACTTTCAAGCAAC-3′;reverse:5′-TTGGAAGGGATGGCCAGAATAG-3′;以甘油三磷酸脱氢酶(GPADH)为内参,用公式2-ΔΔCt计算样品中MMP-8相对量。
1.3.3 免疫组化观察皮损中MMP-8的表达 取皮损部位及相邻未受累外观正常皮肤各0.5 mm×0.5 mm大小皮肤组织,进行石蜡切片,然后行免疫组化染色:经3%过氧化氢封闭30 min,消化内源性过氧化氢酶;抗原修复后加入MMP-8一抗(稀释度1∶300),4 ℃过夜;PBS洗3次,加入二抗(稀释度1∶50)37 ℃孵育1 h;PBS洗3次;加入DAB显色,在显微镜下观察并及时终止反应。显微镜下观察皮损部位及相邻未受累表皮内MMP-8的表达。
1.4 统计学处理
数据选用GraphPad Prism 5.0进行统计分析及绘图,计量资料以均数±标准差表示,两组间均数比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 血清中MMP-8浓度比较
对照组血清中MMP-8浓度为(3.788±1.101) ng/mL,PV组MMP-8浓度为(4.143±2.272) ng/mL,两者差异无统计学意义(t=0.66,P=0.510)。轻度组MMP-8浓度低于对照组(t=2.54,P=0.022)、重度组(t=2.69,P=0.020);中度组与对照组、轻度组、重度组间MMP-8浓度均无明显差异(t值分别为0.76、1.99、0.83,P值均>0.05);重度组与对照组及中度组间MMP-8浓度均无明显差异(t值分别为0.83、1.99,P值均>0.05),详见图1。
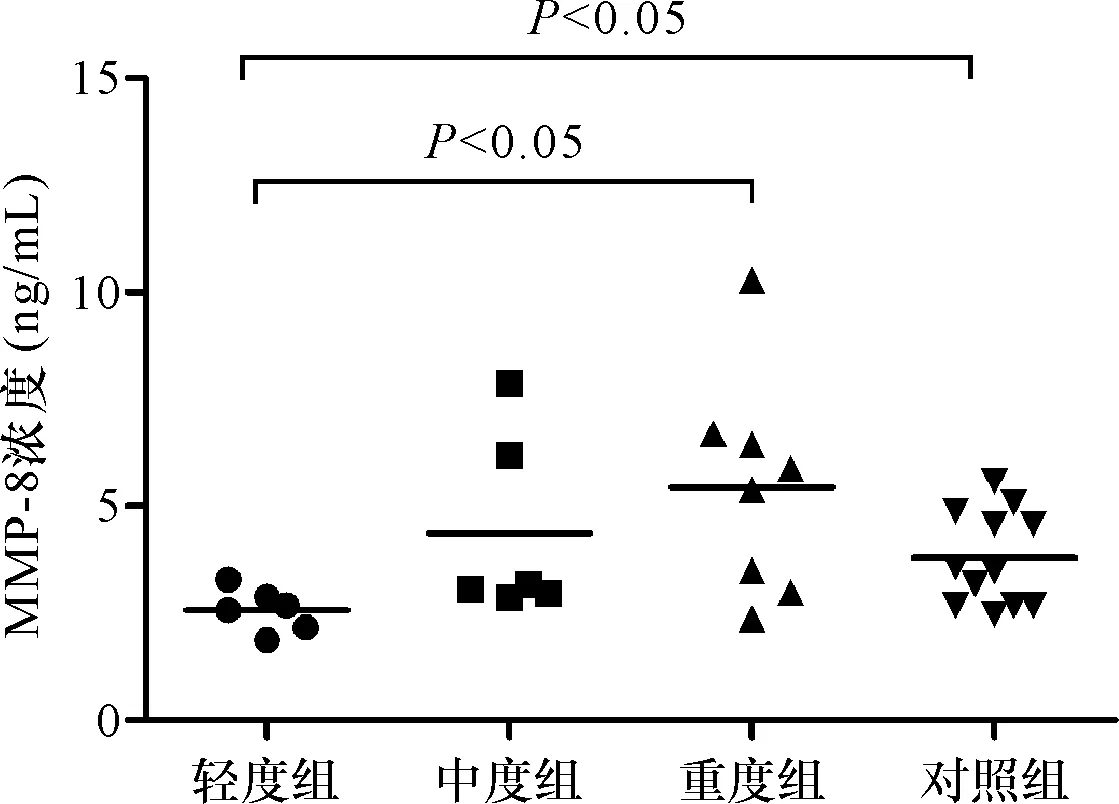
图1 PV患者和对照组血清MMP-8浓度Fig.1 MMP-8 concentrations in the serum of control and PV groups.
2.2 MMP-8-cDNA荧光定量检测
皮损部位MMP-8表达明显高于皮损邻近部位外观正常皮肤(t=2.91,P=0.009),详见图2。重度组PV皮损部位MMP-8表达明显高于轻度组(t=3.45,P=0.005)及中度组(t=2.74,P=0.018),详见图3。重度组与轻度组、中度组(t值分别为1.58、1.10,P值均>0.05)以及轻度组与中度组(t=1.00,P>0.05)非皮损部位MMP-8表达均无明显差异。

图2 PV患者皮损和皮损邻近部位正常皮肤MMP-8的相对表达量Fig.2 Comparision of MMP-8 expressions in non-lesional versus leisonal skin.
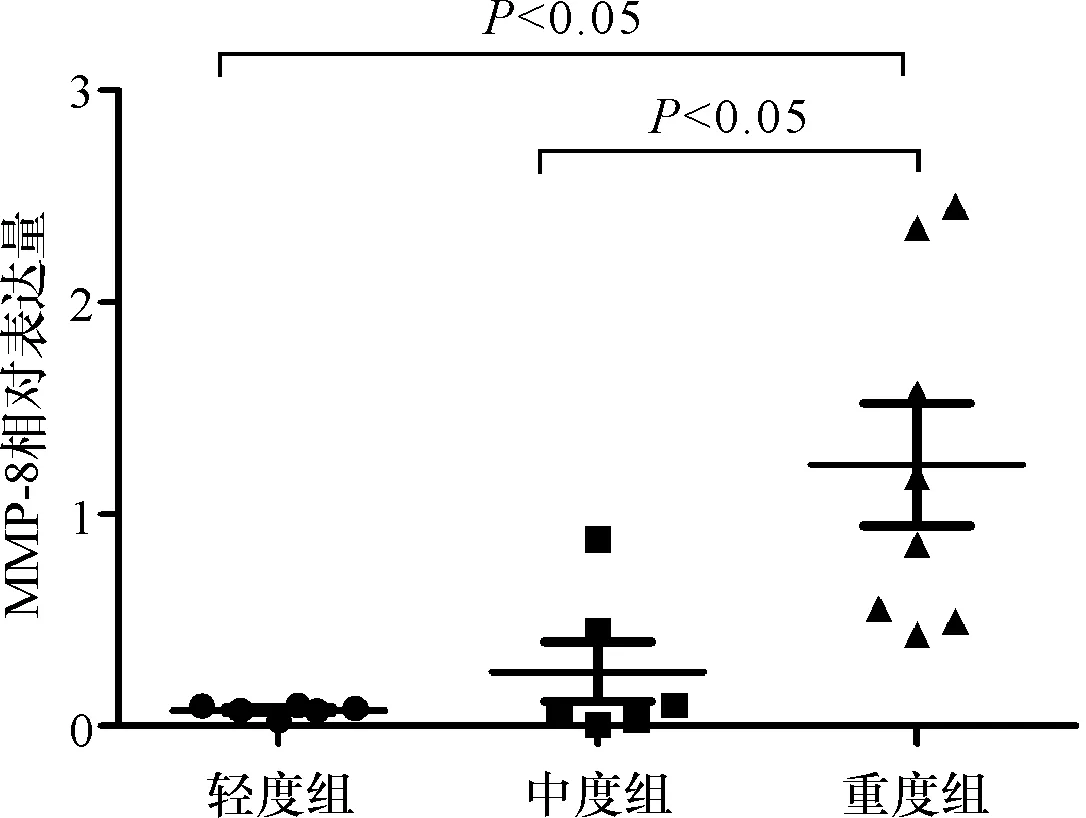
图3 PV各组皮损中MMP-8的相对表达量Fig.3 MMP-8 expressions in the skin lesions of different groups.
2.3 免疫组化观察MMP-8在PV患者皮损中的表达
PV患者皮损部位中,MMP-8阳性细胞主要位于基底层及棘细胞;而非皮损部位中,MMP-8阳性细胞主要位于表皮基底层。皮损及非皮损部位真皮浅层增生血管的血管内皮细胞均高表达MMP-8,见图4。
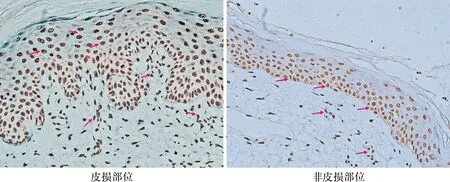
图4 MMP-8免疫组化(400×,箭头指示为MMP-8阳性细胞)
3 讨论
一般认为,MMPs的主要功能是参与细胞外基质(extracellular matrix,ECM)的降解、转化和分解代谢。但近年来研究表明ECM的降解及转化不是MMPs唯一功能,甚至不是主要病理生理学功能,越来越多的学者认为MMPs是机体对外部刺激(如外伤、感染性病原体、自身免疫性抗体非生理性暴露等)产生的宿主免疫(包括先天性免疫和获得性免疫)的重要组成部分[9-12]。MMPs在银屑病炎症反应中的作用是通过调控一些关键免疫细胞所分泌的细胞因子如IL-17、IL-22等来实现的[2],研究较多的是MMP-2、MMP-9等在银屑病中的作用[13-15],较少涉及MMP-8。MMP-8与免疫细胞浸润及上皮细胞增殖、迁移有关,在病理状况,如外伤、炎症等情况下,角质生成细胞、上皮细胞、巨噬细胞都能表达MMP-8[16-17],另外MMP-8有可能通过促进血管新生参与PV的免疫病理进程[5]。
本研究结果显示,PV患者皮损部位MMP-8表达明显高于邻近外观正常的皮肤,提示MMP-8在炎症反应较剧烈的皮损部位较炎症反应较轻的部位表达高;在症状严重PV患者皮损部位较症状较轻患者中表达高,提示PV患者皮损MMP-8表达与炎症反应程度及病情严重程度呈一定的正相关关系。血清检测结果显示,重度组外周血中MMP-8浓度高于轻度组,但对照组外周血MMP-8浓度反而高于轻度组,原因可能是皮损局部MMP-8产生细胞种类较多,如角质形成细胞、血管内皮细胞、巨噬细胞等,且与炎症反应程度密切相关,而外周循环中的MMP-8主要由中性粒细胞合成分泌[18-19],因此外周血MMP-8浓度并不一定能反映皮损局部炎症反应情况,即外周血MMP-8浓度还不能作为一种生物标记用于PV的诊断及病情评估。免疫组化结果显示,皮损部位的棘细胞层表达MMP-8较明显,而非皮损部位MMP-8主要在基底细胞表达,提示可能由于棘细胞层增生活跃,MMP-8表达升高;另外,皮损及非皮损部位真皮乳头层的增生小血管的血管内皮细胞MMP-8表达明显,提示皮损附近皮肤虽无肉眼可见炎症反应,如红肿等,但增生的小血管上皮均高表达MMP-8,提示MMP-8与PV皮损及附近部位血管新生功能相关。
本研究初步了解了MMP-8在PV炎症性皮损中的表达及外周血水平情况。在PV由急性炎症转变为慢性迁延过程中,MMP-8的表达变化、作用机制以及是否可作为一个新的治疗靶点等问题,仍需进一步开展各种体外及体内实验研究,为临床上PV炎症反应的控制提供新的思路。
致谢:非常感谢中山大学公共卫生学院徐琳教授给予统计学方面的指导。

