增生性瘢痕组织中TGF-β1、PI3K的表达及其临床意义
江兰,张衍国,王小霞,王欢,刘涛
空军军医大学唐都医院皮肤科,陕西 西安 710038
增生性瘢痕是炎性反应及创伤后胶原纤维细胞的增殖失控、细胞外基质过度生成并无序沉积的病理性瘢痕,属于纤维增生性疾病[1]。增生性瘢痕会引发疼痛、瘙痒、功能障碍等并发症,严重降低患者生活质量[2]。现阶段增生性瘢痕的发病机制仍处于研究中。研究发现,转化生长因子-β1(transforming growth factor β1,TGF-β1)能够调节细胞生长及分化,对细胞外基质形成、创伤愈合、免疫功能调节等过程均有影响作用[3]。磷脂酰肌醇3-激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)与蛋白激酶B (protein kinases B,PKB)组成的PI3K/PKB 信号通路在增生性瘢痕的形成中发挥着重要的作用[4]。因此,本研究探讨增生性瘢痕组织中TGF-β1、PI3K表达水平及其临床意义,现将结果报道如下:
1 资料与方法
1.1 一般资料 选取空军军医大学唐都医院2017 年4 月至2019 年5 月40 例确诊为增生性瘢痕患者的增生性瘢痕组织(增生性瘢痕组),同时选取20 例其他手术患者切除的正常皮肤组织(正常皮肤组),所有检测均获得受试者知情同意,经医院伦理委员会批准。纳入标准:①经病理检查确诊为增生性瘢痕;②首次接受增生性瘢痕治疗;③近期未服用抑制瘢痕增生的药物;④瘢痕未出现破溃、感染。排除标准:①合并免疫、皮肤、传染性疾病;②合并妊娠期、其他结缔组织疾病者;③临床资料不全者。两组患者的性别、年龄、体质量指数(BMI)等资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。
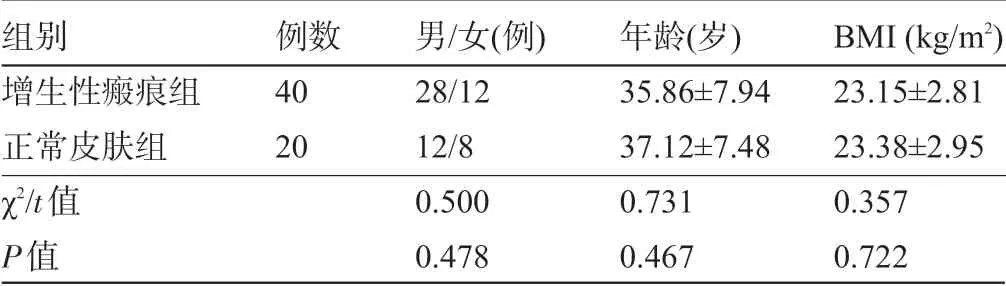
表1 两组患者的一般资料比较(x-±s)
1.2 试剂与仪器 鼠抗人TGF-β1单克隆抗体、兔抗人PI3K多克隆抗体(武汉博士德生物工程有限公司);免疫组化SP试剂盒、DAB显色剂(北京中山金桥有限技术公司);实时荧光定量聚合酶链反应(RT-PCR)试剂盒(美国GeneCopocia 公司);TGF-β1、PI3K、GAPDH引物(上海吉玛生物公司);PCR仪(生产公司:美国ABI公司,型号:ABI 7900)。
1.3 检测方法
1.3.1 石蜡切片免疫组织化学法(SP法) 增生性瘢痕组患者接受手术治疗,术后取增生性瘢痕组织及其他手术患者切除的正常皮肤组织,将其分别置于10%甲醇中,固定12 h后,使用石蜡包埋制成切片,常规组织切片脱蜡至水,将柠檬酸缓冲液加热至98℃进行热抗原修复,使用37℃3%H2O2去离子水孵育5 min,阻断内源性过氧化物酶的活性,分别使用鼠抗人TGF-β1单克隆抗体、兔抗人PI3K 多克隆抗体,室温孵育1 h,加入IgG 抗体-HRP 多聚体,室温孵育10 min,使用DAB 显色10 min,每个步骤间使用缓冲液洗3 次。苏木素复染后,使用乙酸乙醇进行分化。阴性对照使用PBS 缓冲液代替。通过光学显微镜观察免疫组化结果,TGF-β1、PI3K 阳性判定标准参考Shimizu 法[5],按照切片阳性细胞的着色强度分为无着色、淡黄色、棕黄色、棕褐色4 个等级,分别计分0、1、2、3 分;按照阳性着色面积分为按无着色、着色面积<1/3、1/3≤着色面积<2/3,着色面积≥着色面积4个等级,分别计分0、1、2、3分。评分之和<3分,即为阴性;评分之和≥3分,即为阳性。
1.3.2 RT-PCR检测 使用PCR仪,反应体系20 μL:7.1 μL ddH2O,0.4 μL ROX 燃料,2 μL cDNA,10 μL SYBR 荧光燃料,上下游引物各0.25 μL,引物序列见表2。反应条件:预变性温度为95℃,时间30 s,变性温度95℃,时间5 s,退火温度59℃,时间30 s,共40个循环。以GAPDH 为内参照,结果使用△循环阈值(Ct)法处理,△Ct=目的基因Ct值-内参Ct值,TGF-β1、PI3K表达水平使用2-△△Ct表示。
1.4 观察指标 (1)比较增生性瘢痕组和正常皮肤组组织中TGF-β1、PI3K表达情况及表达水平。(2)增生性瘢痕组术后随访6 个月,按照复发与否分为复发组和未复发组,比较复发组和未复发组组织中TGF-β1、PI3K表达水平。(3)分析增生性瘢痕组织中TGF-β1与PI3K表达的相关性。
1.5 统计学方法 应用SPSS21.0 软件进行数据分析。计量资料服从正态分布,以均数±标准差(±s)表示,组间比较采用t 检验;计数资料组间比较采用χ2检验;两个因素间相关性分析采用Pearson 相关性分析;以P<0.05为差异具有统计学意义。
2 结果
2.1 增生性瘢痕组和正常皮肤组的TGF-β1、PI3K表达情况比较 增生性瘢痕组组织中的TGF-β1、PI3K阳性表达率分别为85.0%、80.0%,明显高于正常皮肤组的15.0%、25.0%,差异均具有统计学意义(P<0.05),见表3。
2.2 增生性瘢痕组和正常皮肤组的TGF-β1、PI3K表达水平比较 增生性瘢痕组组织中的TGF-β1、PI3K表达水平明显高于正常皮肤组,差异均具有统计学意义(P<0.05),见表4。
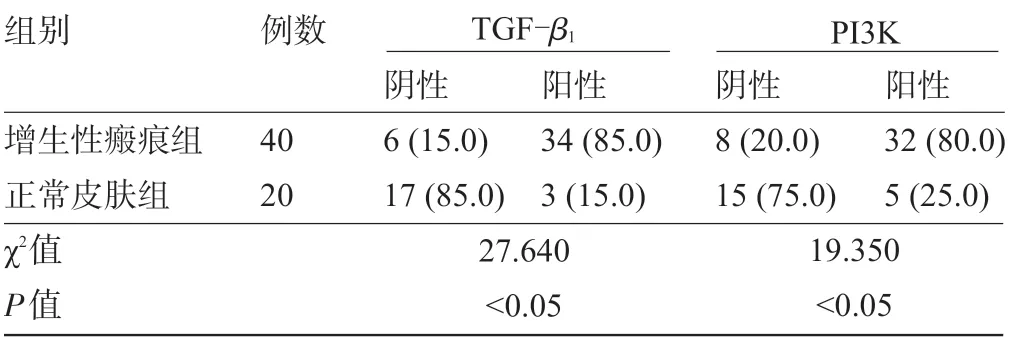
表3 两组组织中的TGF-β1、PI3K表达情况比较[例(%)]
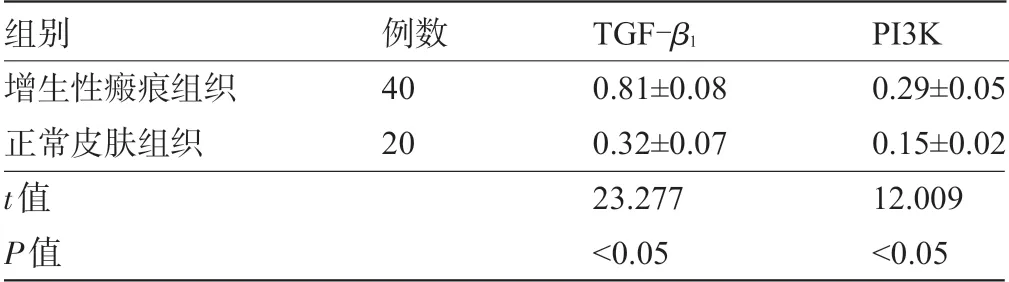
表4 两组组织中的TGF-β1、PI3K表达水平比较(x-±s)
2.3 增生性瘢痕术后未复发组和复发组TGF-β1、PI3K表达水平比较 增生性瘢痕组术后随访6个月,术后复发组的TGF-β1、PI3K表达水平高于未复发组,差异均具有统计学意义(P<0.05),见表5。
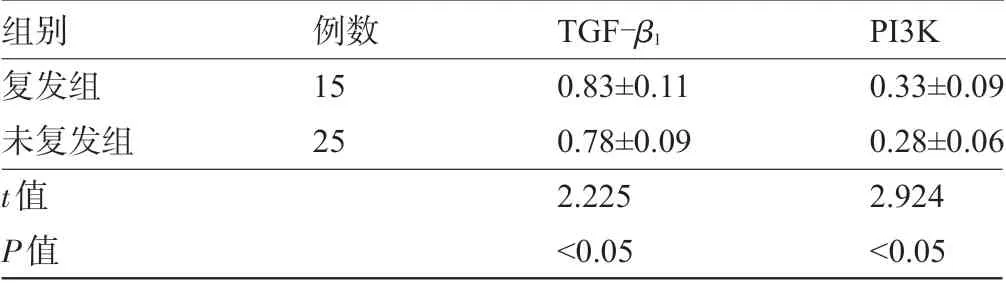
表5 未复发组和复发组的TGF-β1、PI3K表达水平比较(x-±s)
2.4 增生性瘢痕组织中TGF-β1与PI3K表达的相关性 经Pearson相关性分析结果显示,增生性瘢痕组织中TGF-β1表达水平与PI3K表达水平呈明显的正相关(r=0.745,P<0.05)。
3 讨论
增生性瘢痕是不具有正常皮肤功能及结构的病理性瘢痕,与细胞外基质和成纤维细胞的功能异常密切相关[6-7]。外科手术、烧伤、创伤后均可能出现不同程度的增生性瘢痕,常见于四肢、肩部、背部、颌面部、头颈处,对患者的外观造成影响。
增生性瘢痕的主要病理特征为成纤维蛋白增殖过度、细胞外基质沉积失控,最终引发创口愈合过度。TGF-β1是具有较强促纤维化作用的细胞转化生长因子,参与创口愈合过程,对炎症因子分泌、成纤维蛋白增殖及凋亡、胶原分解及合成、细胞外基质重建等过程均会产生影响[8-9]。LI等[10]研究发现,TGF-β1对上皮细胞的增殖及分化有较强的促进作用,有利于产生纤维连接蛋白。TGF-β1是促细胞分裂剂,其表达水平与成纤维细胞增殖水平呈正相关,与成纤维细胞凋亡水平呈负相关。据SERBAN等[12]研究,TGF-β1通过调控细胞周期影响成纤维细胞的表达。TGF-β1能够调节成纤维细胞凋亡-增殖平衡,在创口修复过程中,创口处丰富的TGF-β1会打破平衡,导致成纤维细胞增殖过度,形成增生性瘢痕[11]。本研究中增生性瘢痕组中的TGF-β1阳性表达率、表达水平均高于正常皮肤组,提示TGF-β1参与了增生性瘢痕的形成,增生性瘢痕的形成可能与TGF-β1在创口愈合过程中表达水平过高有关。在增生性瘢痕中,基质黏多糖蛋白、胶原经TGF-β1刺激后产生大量蛋白多糖、弹性蛋白、纤维连接蛋白、Ⅰ型及Ⅲ型胶原蛋白等细胞外基质,导致胶原纤维出现纤维化。TGF-β1会抑制胶原蛋白的降解及胶原酶的产生,是细胞外基质沉积失控的调控因子,与细胞外基质沉积呈正相关,有利于创口愈合,形成增生性瘢痕。ZHOU等[13]研究发现,TGF-β1在创口愈合的早期能够传递信号物质避免愈合过度,但TGF-β1表达过高时信号物质可能导致增生性瘢痕形成。
PI3K 是一种异源二聚体,由调节亚基p85 和催化亚基p110 组成,活性与蛋白激酶、脂类激酶类似[14]。激活PI3K的方式有两种,一是催化亚基p110和Ras蛋白直接结合活化PI3K,二是通过和IGF、PDGF等生长因子受体相互作用,改变异源二聚体的构象,最终被激活。活化后的PI3K发生磷酸化,生成PIP2和PIP3,在两者作用下,下游的蛋白激酶(如:PKA、PKB、PKC)被激活,进而激活PI3K/PKB 通路,调节细胞的增殖、迁移、转运及凋亡。本研究中增生性瘢痕组中的PI3K阳性表达率、表达水平均高于正常皮肤组,表明增生性瘢痕的形成与PI3K 有关,这可能是因为PI3K 通过控制PI3K/PKB 通路改变成纤维细胞的增殖与凋亡。PI3K/PKB 通路下游存在mTOR 基因,当PI3K/PKB 通路被激活后会使mTOR发生磷酸化[15]。在创口愈合过程中,PI3K/PKB/mTOR 通路可以调节细胞外基质,控制蛋白质的合成,最终调控细胞的增殖及生长。此外,整合素连接激酶的PH 结构域也可以与PI3K 相结合,整合素连接激酶被激活后会对PKB的Ser473进行磷酸化,通过PI3K/整合素连接激酶/PKB 信号通路调节成纤维细胞的分化及生长。本研究还发现,增生性瘢痕术后复发组的TGF-β1、PI3K 表达水平明显高于未复发组,Pearson相关性分析结果显示在增生性瘢痕中TGF-β1、PI3K表达呈正相关,表明两者在增生性瘢痕的形成中发挥着重要作用,并能够提示增生性瘢痕患者术后复发情况。
综上所述,在增生性瘢痕组织中TGF-β1、PI3K 均存在高表达,两者呈正相关,对增生性瘢痕术后复发有提示作用。

