微生物代谢工程在花色苷生产过程中的应用现状和前景
李 跃,李国瑞,陈永胜,,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.内蒙古民族大学生命科学学院,内蒙古 通辽 028000)
花色苷是广泛存在于植物中的水溶性天然色素,促使许多植物和果实形成红色、蓝色和紫色,属于类黄酮类物质,具有抗氧化、抗疲劳、抗衰老、抗肿瘤以及预防心脑血管疾病等多种生物活性,是植物界中重要的抗氧化剂和抗菌剂[1-2]。随着人们对天然营养品需求的不断提高,将天然提取色素(如花色苷)应用于食品加工中已成发展趋势[3-4]。花色苷的结构如图1所示,通过对花色苷R1、R2、R3、R4、R5和R6进行糖基化、羟基化、甲基化或乙酰化等修饰,可以产生多种花色苷同源物(表1)。

图1 花色苷结构示意图Fig. 1 Structure of anthocyanins
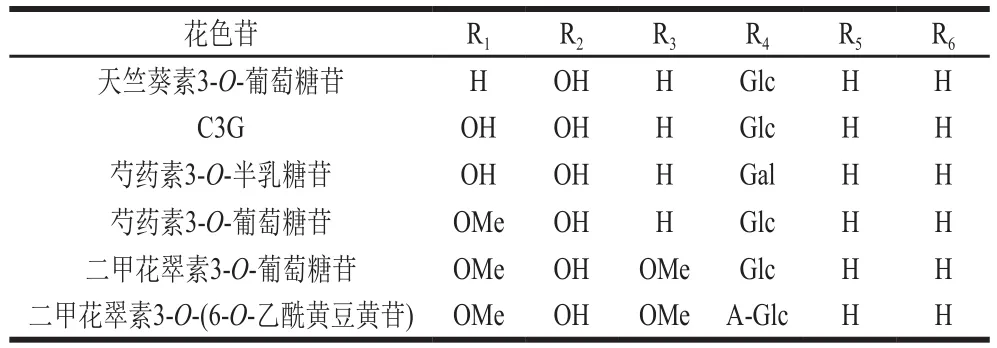
表1 代表性花色苷及其结构Table 1 Representative anthocyanins and their structures
传统花色苷主要来源于植物材料的提取,如从水果、鲜花或其他植物组织中提取纯化[5-7]。植物提取法具有原料廉价和技术先进等优点,同时,随着人们对植物中花色苷合成及花色苷遗传代谢工程的研究与应用,从植物中提取和纯化花色苷的方式已取得较大发展[8]。然而,从植物中分离获得的花色苷通常为含有多种分子与化学结构不同的混合物。此外,通过植物提取时,所得花色苷性质不稳定,同时也会受到生产力、季节以及环境条件变化的影响[9]。然而,微生物具有增长快速和容易培养等生产特性,并且自动化微生物处理技术使微生物生产天然产物更加便捷、可控和高效,因此,花色苷的微生物生产法越来越受到人们青睐[10-11]。迄今为止,已有多种植物来源的化合物利用原核和真核微生物加以生产,包括萜类、生物碱和类黄酮[12-13]。有研究表明,可通过添加特定的反应底物使微生物生产类黄酮化合物[14-15]。基因组测序、DNA合成、结构生物学、酶学和代谢网络建模等技术使微生物代谢工程在食品、现代医药、生物能源方面发挥重要作用[16-17]。
本文主要综述了转基因微生物生产花色苷的最新研究进展,重点在于提高微生物产品产量的代谢工程策略。此外,还总结了微生物生产花色苷的流程优化和影响因素,以全面理解相关分子工程和生化生产过程,以期为提高微生物生产花色苷产量提供参考。
1 花色苷的应用
花色苷具有抗氧化和抗菌作用,在功能性食品[18]、化妆品[19]和制药[20-21]等方面具有广泛应用。花色苷是水溶性色素,能使许多水果、蔬菜、花卉和其他植物呈现诱人的橙色、红色和蓝色等颜色,且具有独特的营养特性;因此,也被广泛用于食品行业[22]。4 种花色苷基着色剂已免于美国食品药品监督管理局的认证[23]。某些类型花色苷存在特定的多酚结构和侧链基团,能强烈吸收可见光和紫外线,因此可减轻紫外线对人类皮肤的氧化损伤,这些新的发现大大提高了花色苷在化妆品中的应用价值[24]。花色苷通过阻断白介素-1β、肿瘤坏死因子α和核因子κβ,抑制神经发炎、神经退化和脑衰老[25],并在预防癌症、心血管疾病、神经退行性疾病、肥胖症和糖尿病以及抗肿瘤等方面发挥重要作用。花色苷还能够抑制凝血酶受体激活肽诱导的血小板聚集,然而其作用机制仍不明确[26-27]。此外,花色苷还可作为光敏染料应用于太阳能电池中,以取代太阳能转化为电力过程中有毒、复杂和昂贵的过渡金属配合物[28-29]。
2 花色苷的生物合成
花色苷是植物中广泛存在的次生代谢产物,在自然条件下,植物合成的花色苷有助于吸引授粉昆虫,以及保护植物免受辐射危害及病原体侵蚀[30]。植物花色苷由莽草酸途径合成(图2):来自于苯丙氨酸的3分子丙二酰辅酶A和来自于酪氨酸的1分子4-香豆酰辅酶A在查耳酮合酶(chalcone synthase,CHS)催化下生成柚皮素查耳酮,进一步由查耳酮异构酶(chalcone ammonia lyase,CHI)转换为其异构体柚皮素;柚皮素通过羟化酶,如类黄酮3’-羟化酶(flavonoid 3’-hydroxylase,F3’H)和类黄酮3’,5’-羟化酶(flavonoid 3’,5’-hydroxylase,F3’,5’H)进行羟基化修饰,产生不同的二羟黄酮醇(二羟槲皮素、二氢杨梅素和二羟山柰酚)。这些分子在二氢黄酮醇还原酶(dihydroflavonol reductase,DFR)催化下生成无色花色素,如无色矢车菊素、白天竺葵苷元和无色翠雀花素;花色苷合成酶(anthocyanidin synthase,ANS)氧化无色花色素生成不稳定的阳离子花色苷,该产物在类黄酮葡萄糖基转移酶(flavonoid glucosyltransferase,FGT)的作用下发生糖基化反应,生成花色苷。

图2 植物中花色苷的合成代谢途径Fig. 2 Anabolic pathways of anthocyanins in plants
在植物中,花色苷合成后被转移并储存在液泡中,不同液泡pH值存在差异,导致花色苷呈现不同颜色[4,27]。花色苷在碱性和中性pH值条件下不稳定,但植物可以通过对花色苷进行结构修饰,或降低液泡pH值以及共色作用调节其在液泡中的稳定性[31]。但由于花色苷生物合成的复杂性和不稳定性,其商业化生产过程仍是一项艰巨的挑战。
3 微生物代谢工程生产花色苷
微生物工程生产天然化学物质是一种有前途的、满足工业需求和可持续的生产方式。大肠杆菌(Escherichia coli)是代谢工程中最常用的菌株,具有遗传背景清晰、操作技术简便、培养条件简单和可大规模发酵等优点,被广泛应用于天然类黄酮化合物的生物合成中。Jones等[32]通过优化共培养过程中菌株、碳源、温度、诱导点和接种率等条件,显著提高了E. coli生产类黄酮化合物的产率。Yan Yajun等[33]发现,重组E.coli细胞生产2 种花色苷(天竺葵素-3-O-葡萄糖苷和C3G)的产量可达到毫克级,为花色苷在药物和营养品中的商业化应用提供可能。近年来,宿主菌株范围已扩大到酿酒酵母和委内瑞拉链霉菌[33]。最近,德国科学家将植物来源的O-甲基转移酶、黄烷酮3-羟化酶和黄酮醇合成酶在谷氨酸棒杆菌中进行功能性表达,得到高浓度和高纯度的紫檀芪、山柰酚和槲皮素[34]。
作为重要的类黄酮物质,花色苷因其巨大的工业和商业价值而备受关注。Yan Yajun等[35]利用重组E. coli进行花色苷的生物合成,产物C3G产量高达110 mg/L。将ANS和类黄酮-3-O-糖基转移酶(flavonoid-3-O-glycosyltransferase,F3GT)克隆到E.coliBL21中并进行表达[36],该重组E. coli使用柚皮素和圣草酚为原料时,可分别产生6.0 μg/L C3G和5.6 μg/L氯化天竺葵素3-O-葡萄糖苷;对培养条件进行优化发现,当使用阿福豆素和儿茶酚作为前体物质时,这2 种产物的产量可分别提高到113 mg/L和350 mg/L。E. coli生物合成花色苷示意图见图3。
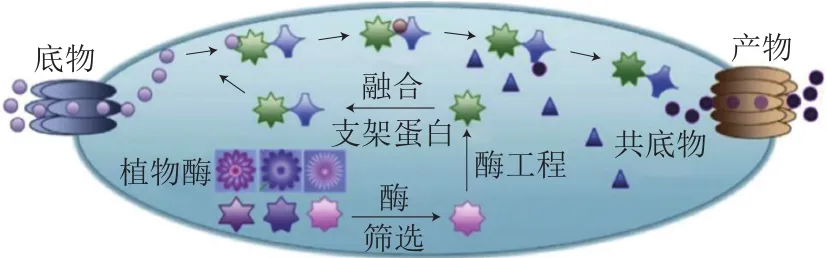
图3 E. coli生物合成花色苷示意图[23]Fig. 3 Schematic diagram of anthocyanins biosynthesis in Escherichia coli[23]
3.1 微生物生产花色苷时酶的筛选
由于不同植物中同源基因编码的酶在催化反应时表现出不同的动力学和热力学活性,当这些酶在外源微生物中表达时,会产生不同的代谢行为且目标化合物生产水平不同。因此,从不同物种中筛选合适的酶是提高花青素等黄酮化合物和花色苷等类黄酮化合物产量的关键[37]。Yan Yajun等[33]对来自非洲菊、矮牵牛、金鱼草和苹果的异源ANS活性进行体外测试,并比较其体内催化效率,发现使用矮牵牛ANS在E. coli中制备花色苷时产量最高。同样,在E. coli中生产柚皮素时,通过对不同同源物上游酶组合可以提高E. coli中柚皮素的产量,如将不同来源的4-香豆酰辅酶A上游酶4-香豆酸辅酶A连接酶、柚皮苷查耳酮上游酶CHS以及柚皮素上游酶CHI进行组合,柚皮素产量发生显著变化[32]。采用该方法利用E. coli生产白藜芦醇时,白藜芦醇产量提高了2 300 mg/L[38]。
即使最适酶系统中酶的来源和组合均为最佳,但在微生物生产花色苷时并不一定能够提高产量,这是因为这些植物来源的酶在原核细胞中属于异源表达。通常,这些酶的编码基因在表达之前需要经过一定的修饰(图3)。例如,P450还原酶的原核表达可在其C端融合来自长春花的F3’,5’H片段,通过删除其N端膜锚定位点处的4 个密码子,修改起始密码子后第5~6个碱基,使其由亮氨酸变为丙氨酸,从而构造一个适合细菌的表达结构,形成C端融合了长春花来源的F3’,5’H-P450嵌合羟化酶,该酶能更好地催化槲皮素的形成[39]。
除对个别代谢途径中的酶进行修改外,将多种酶融合表达也是一种有效提高微生物生产花色苷产量的方法。研究表明,将拟南芥F3GT与牵牛花ANS的N端通过五肽连接进行融合,与单独的ANS或F3GT相比,2 种酶融合后可极大提高C3G的产量。与独立的酶相比,这种复合酶能够更有效地进行连续生化反应,催化产生大量中间产物,并迅速糖基化,从而减少了降解的可能,极大提高了花色苷的合成效率[33]。
3.2 辅因子和辅底物对微生物生产花色苷产量的影响
充足的辅因子和辅底物对花色苷生物合成中的电子转移、酶活化以及稳定性有重要意义。亚铁离子、抗坏血酸钠是ANS的辅因子,2-酮戊二酸是ANS的辅底物,它们可以帮助ANS氧化底物,促进花色苷的生成[40-41]。研究表明,抗坏血酸钠和亚铁离子的加入显著提高了儿茶素底物的消耗和C3G的产量[33,39]。但在微生物生产花色苷过程中,辅底物2-酮戊二酸的添加并不是必须的,这可能是由于2-酮戊二酸是三羧酸循环的中间产物,因此其供应丰富[33]。
尿嘧啶核苷-5’-二磷酸葡萄糖(uridine-5’-diphosphate glucose,UDP-G)是一种重要的葡萄糖供体,能催化C3位糖基化反应,使不稳定的花色苷变得稳定,UDP-G的含量可影响糖基化花色苷的生产。常用的处理方法是提高其生物合成基因的表达或对其降解途径加以抑制,如在E. coli中上调UDP-G合成代谢途径关键基因(pyrE、pyrR、cmk、ndk、pgm、galU)的表达或抑制UDP-G消耗通路,这些改造使C3G产量较对照组提高了20 倍以上(从4 mg/L增加至97 mg/L)[15,33]。另一项研究显示,pgm、galU、ANS和3GT过表达可以使C3G产量增加57.8%[33]。
S-腺苷甲硫氨酸也是花色苷生产时必不可少的辅底物,如芍药素3-O-葡萄糖甲基花色苷的生产。通过CRISPR干扰介导的转录阻遏物MetJ沉默技术可提高S-腺苷-L-蛋氨酸的可用性,利用UDP-G和S-腺苷甲硫氨酸的双重改善技术可将E. coli中芍药花色苷产量提高到56 mg/L[42]。
3.3 转运蛋白对微生物生产花色苷产量的影响
转运蛋白通常分为3 类:摄取泵、外排泵和调节剂[43]。许多工程微生物产生的目标产物对宿主菌株有害,从而抑制了目标产物的生成。解决该问题的有效方法是利用外排泵将细胞质内的目标化合物转移到细胞外环境,使产物维持在适当的水平,从而达到减毒的作用。例如,为提高E. coli中生物燃料的产量,引入一系列外排泵,负责将细胞内产生的生物燃料排出细胞外[44]。这种方法已被广泛用于多种生物系统中,包括花色苷的生物合成。Lim等[36]选择4 种外排泵acrAB、tolC、aaeB和yadH,发现只有yadH过表达能将细胞外C3G产量提高15%,说明C3G可能是yadH外排泵的底物;而acrAB和aaeB过表达,细胞外儿茶素和花色苷的含量与野生型细胞相当;此外,去除1 种负责儿茶素的分泌外排泵可进一步提高C3G产量。
除微生物自身运输的调节外,对植物运输调节系统的引进也是改善工程微生物中花色苷产生的可能途径。花色苷在天然植物中合成后,被特定的转运蛋白转运并积聚在液泡中[45]。在玉米中,花色苷的转运主要是利用液泡膜中存在的ATP结合转运体ZmMRP3实现的[46],通过Bronze-2编码的谷胱甘肽S-转移酶实现花色苷在液泡中的沉积[47]。在其他植物中,花色苷的运输也与H+梯度有密切联系。在拟南芥中,Testa12基因编码1 种属于MATE家族的二级转运蛋白类蛋白,其可通过H+梯度逆向转运花色苷至液泡中,而缺乏这种基因的突变体会大大降低花色苷在液泡中的积累[48]。但关于这些植物中的转运机制,目前鲜有在微生物生产花色苷的工程中得以应用或尝试。
3.4 微生物生产花色苷培养条件的优化
花色苷的高度不稳定性是其微生物生产过程中面临的一个难题。在植物中,花色苷合成后稳定的存储在液泡中[8,49],与植物不同的是,细菌细胞作为人工生产的宿主缺乏花色苷稳定机制。
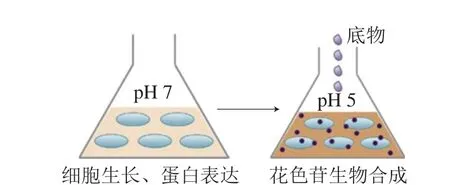
图4 E. coli两步催化法生物合成花色苷[23]Fig. 4 Two-step catalytic biosynthesis of anthocyanins by E. coli[23]
由于代谢工程细菌细胞正常生长的pH值约为7,使得花色苷合成后极不稳定。为稳定微生物中花色苷的合成,有学者提出了两步催化法(图4)[33]:第1步,在pH 7的培养基中培养细胞,以维持细胞正常生长和外源酶表达;第2步,培养到一定阶段后将细胞转移到pH 5的新鲜培养基中,以减少花色苷降解。此外,也可以添加相应保护剂,如添加谷氨酸可在低pH值条件下维持细胞生存,该方法可使E. coli的C3G产量提高15 倍左右[33]。
除pH值外,其他因素在花色苷生产中也发挥重要作用,如诱导时间、补料量、溶解氧和温度。Lim等[36]发现定期诱导时工程化E. coli中C3G的产量最高,并且UDP-G和儿茶素与定期诱导结合后花色苷产量的提高效果更佳。
溶解氧对花青素微生物生产具有双重效应。一方面,氧是ANS发挥功能的关键因素;另一方面,氧会氧化花青素。因此,最佳溶解氧浓度是微生物生产花色苷的关键。在利用微生物生产圣草酚的研究中发现,通过增加溶解氧浓度能促进儿茶素的合成,这可能与充足的还原型辅酶II供应有关[37]。然而,目前还鲜有关于氧气对花色苷产量影响的报道。
温度是影响细胞活性和外源蛋白表达的关键因素。温度的波动会影响蛋白折叠,进而影响某些蛋白质形成,从而间接影响微生物生产有用化合物。在E. coli中生产阿夫儿茶素时,反应温度为20 ℃时其产量可达到22.9 mg/L,而温度为10 ℃时只能达到6.1 mg/L[32]。微生物生产花色苷的研究进展如表2所示。

表2 E. coli生产花色苷的影响因素及优化方法Table 2 Optimization of factors influencing the production of anthocyanins by E. coli
4 结 语
微生物代谢工程在花色苷生产中具有广阔前景,本文概述了微生物代谢工程在花色苷生产中的研究进展,特别侧重于广泛应用的E. coli,同时,对微生物生产花色苷过程中影响因素的优化策略进行综述。
目前,重组微生物生产花色苷的成本仍然远远高于植物提取的成本,其中最重要的原因是微生物生产花色苷产量较低。因此,要实现生物合成途径的潜力最大化而副作用最小化,就必须对微生物合成花色苷的过程进行系列调整与优化。充分利用基因组测序、基因扩增等技术发现新的酶,以及基于目前的研究成果重新设计关键酶,构建花色苷生物合成的新途径。同时,进一步优化微生物生产花色苷中双磷酸葡萄糖供应的调节,由于UDP-G可参与海藻糖、糖原、甘油聚合物及其他生物活性化合物的合成,是细胞新陈代谢、细胞信号传导和防御体系至关重要的参与者,因此如何满足UDP-G供应问题也将成为一个巨大的挑战。Cas9依赖的工具酶已发展到可同时调控E. coli多个基因的表达[50-51],可以利用此方法对多种酶的表达水平、与花色苷生产直接或间接相关的转运蛋白和辅助因子、限速因素和潜在调节剂进行微调。
代谢平衡作为另一个重要因素,也应被纳入花色苷生产的过程优化中。代谢平衡可减少对宿主菌株的代谢负担,即使在花色苷生产过剩情况下也能最大程度地维持细胞的正常生长和代谢。目前许多技术和方法都已在平衡代谢途径中得以应用,如ePathBrick载体、ePathOptimize计划、组合启动子工程、合成RNA开关和动态调节细胞内代谢物等[52-58]。
除途径相关因子外,运输效率低下和缺乏储存器也能导致微生物生产过程中花色苷被破坏。与植物相比,微生物缺乏花色苷运输和稳定的内在机制[59]。目前,对花色苷在微生物细胞内部和跨细胞膜移动的路径知之甚少,对花色苷和微生物结构之间的相互作用研究也较少。这些机制的阐明以及特异运输蛋白的引进,将对花色苷的微生物生产提供支持。此外,类黄酮化合物前体物质价格昂贵,也增加了花色苷生产的总成本。利用这一技术以葡萄糖为起始生产C3G,将极大降低微生物培养成本,使该生产过程商业化变得可行[60]。
微生物生产花色苷的优化是一个复杂和耗时的过程。目前,研究者已鉴别出对花色苷生物转化有显著影响的多种因素,包括菌株和基质的选择、酶的表达、生长和诱导条件等。然而,仍存在很多亟待解决问题。例如,不同酶动力学对目标产品生产的影响;正常细胞代谢对酶活性的作用;以及花色苷生产过剩对宿主表观遗传学和细胞遗传学的影响等。对这些信息加以了解,有助于调整与优化控制微生物生产花色苷过程,因此,利用多学科技术相结合的方法同时对多方面因素进行评价,将成为微生物花色苷合成关键路径控制和优化的关键。

