甜玉米芯多糖对糖尿病大鼠的降血糖作用
马永强,张 凯,*,王 鑫,路雪纯,林枞雨
(1.哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150076;2.哈尔滨工业大学生命科学与技术学院,黑龙江 哈尔滨 150080)
糖尿病是人体葡萄糖的代谢紊乱造成的,是一种机体处于糖代谢和脂代谢受胰岛素不适当调节的状态,可导致空腹及餐后血糖升高,主要临床特点是长期处于高血糖状态,通常肥胖是糖尿病发展的一个常见驱动因素[1-2]。其中2型糖尿病更为常见,占所有糖尿病病例的75%~85%[3]。根据国际糖尿病联盟2017年发布的第八版全球糖尿病地图显示,全世界有4.25亿 人患有糖尿病,预计到2045年,患有糖尿病的人数将达到6.29亿 人[4]。目前,糖尿病已经成为继肿瘤、心血管疾病后在世界范围内的第三大严重危害人类健康的非传染性疾病,若其不加以干预可引发多种并发症[5-6]。
但目前治疗糖尿病的药物多具有一些副作用,例如会造成体质量增加、心脏和肾脏功能受损、胃肠道疾病等[7]。所以开发一种天然且副作用小的药物已经成为了研究糖尿病的重点。近年来,研究发现一些植物多糖具有很好的降糖作用,并能改善胰岛素抵抗,且毒副作用小[8]。例如:Li Yougui等研究发现从板蓝根提取的板蓝根多糖能显著改善胰岛素抵抗以及糖代谢、脂代谢和氧化应激[9]。Zeng Zhaohui等发现荷叶多糖可以提高糖尿病大鼠的抗氧化活性并降低胰岛素抵抗作用[10]。
目前已经有研究证明多糖具有良好的抗肿瘤、抗氧化、抗凝血、降血糖降血压等作用[11-14]。甜玉米芯多糖是以甜玉米芯为原料,经干燥、粉碎、过筛等前处理过程后,进行脱脂、脱蛋白、脱色、乙醇醇沉得到的醇沉物进行冷冻干燥后得到的具有生物活性的物质,前期实验证明甜玉米芯多糖对α-葡萄糖苷酶起到一定的抑制效果,呈现出较好的体外降血糖及抗凝血作用[15-16]。但甜玉米芯多糖在大鼠体内的降血糖、降血脂效果以及对胰腺组织的形态变化均未做深入研究。
本实验利用STZ诱导建立糖尿病大鼠模型,并灌胃不同剂量的甜玉米芯多糖来评估其降血糖作用,然后通过与糖尿病大鼠对比血糖水平、血脂水平、葡萄糖耐受量以及胰腺组织切片情况,揭示甜玉米芯多糖对糖尿病大鼠的降血糖影响。
1 材料与方法
1.1 动物、材料与试剂
雄性SPF级Wistar大鼠,体质量(180±20)g,购自吉林省长春市亿斯实验动物技术有限责任公司,生产许可证号:SCXK(吉)2016-0003。
甜玉米芯多糖(SCP-80-1)由哈尔滨商业大学食品工程学院制备;链脲佐菌素(streptozotocin,STZ)美国Sigma公司;血糖试纸 罗氏诊断产品(上海)有限公司;胰岛素、血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)试剂盒 南京建成生物科技公司;盐酸二甲双胍片为市售;其他化学试剂均是分析纯。
1.2 仪器与设备
血糖仪 罗氏诊断产品(上海)有限公司;BSA224S电子分析天平 河北双鑫试验仪器制造有限公司;ELx800酶标仪 北京线上生物科技有限公司;TU-1900紫外-可见分光光度计 深圳市亿鑫仪器设备有限公司。
1.3 方法
1.3.1 甜玉米芯多糖的制备流程
甜玉米芯多糖制备:以甜玉米芯为原料,经干燥→粉碎→过筛→脱脂→水提→浓缩→脱蛋白→脱色→体积分数80%的乙醇醇沉→冷冻干燥→DEAE-52阴离子纤维素柱层析→冷冻干燥→葡聚糖凝胶Sephadex G-200柱层析→冷冻干燥→制得SCP-80-1[16]
1.3.2 高血糖模型的建立
SPF级Wistar雄性大鼠,在温度为22~24 ℃、正常昼夜周期以及相对湿度(60±5)%的条件下适应性饲喂3 d,并让大鼠自由进食及饮水[17-18]。大鼠高血糖模型的建立参照《保健食品检验与评价技术规范》[19]中的方法。给予高脂高糖饲料(20%(质量分数,下同)蔗糖、10%猪油、2.0%胆酸钠、67.5%基础饲料)喂养3 d后称体质量,按照65 mg/kg mb一次性腹腔注射STZ,高脂高糖饲料喂养7 d[20-21]。禁食3 h后进行尾部取血,并用血糖仪检测空腹血糖浓度,空腹血糖浓度,连续2 次测定空腹血糖浓度不小于11.1 mmol/L即认为造模成功[22-24]。
1.3.3 动物分组及处理
将STZ诱导的50 只糖尿病大鼠随机均分为5 组:糖尿病模型组、阳性药物组(200 mg/kg mb二甲双胍)、SCP-H组(400 mg/kg mbSCP)、SCP-M组(200 mg/kg mbSCP)、SCP-L组(100 mg/kg mbSCP)。并选择10 只正常大鼠作为空白对照组,空白对照组和糖尿病模型组给予生理盐水。饲喂期间每天进行灌胃,持续4 周。大鼠每天自由饮水及进食。每日观察食物、水的消耗量以及毛发色泽和精神状态,每3 d检测大鼠体质量,每7 d检测各组大鼠空腹血糖浓度。治疗28 d后,取禁食12 h的大鼠摘眼球进行眼底静脉取血后处死、解剖[25]。观察肝脏、肾脏、胰腺以及心脏组织的状态后称质量并收集备用。
1.3.4 葡萄糖耐受量的测定
大鼠禁食3 h后,经口给予葡萄糖2.0 g/kgmb,测定给葡萄糖0、0.5 h以及2 h的血糖浓度,观察给葡萄糖后各时间点血糖曲线下面积的变化[26]。
1.3.5 胰岛素含量测定
使用胰岛素试剂盒测定血清中胰岛素含量。
1.3.6 血脂指标测定
使用相应试剂盒测定血清TC、TG、HDL-C和LDL-C浓度[27]。
1.3.7 组织切片观察
大鼠处死解剖后取胰腺和肝脏用体积分数10%甲醛溶液固定,进行包埋、切片、苏木精-伊红染色、封片等处理,最后镜检照相[28]。
1.4 数据统计学分析
2 结果与分析
2.1 大鼠一般状况
在实验期间观察各组大鼠的状况发现,空白组大鼠摄食、饮水及排尿量正常,健康活泼,毛色鲜亮,体质量增长较快;糖尿病模型组大鼠进食、饮水及排尿量明显增加,精神状态不好,毛色暗淡,体质量下降明显;阳性药物组和各剂量SCP组大鼠与糖尿病组相比在进食量、饮水量及排尿量上均减少,且精神状态有不同程度的改善。

图1 各组大鼠体质量状况Fig. 1 Body mass of rats in each group
如图1所示,经STZ造模后,模型组大鼠体质量较空白组大鼠极显著下降(P<0.01)。灌胃二甲双胍和甜玉米芯多糖4 周后,与模型组相比,SCP-L组大鼠体质量显著增加(P<0.05),阳性药物组、SCP-H和SCP-M组大鼠体质量极显著增加(P<0.01)。
2.2 SCP对大鼠血糖及葡萄糖耐受量的影响
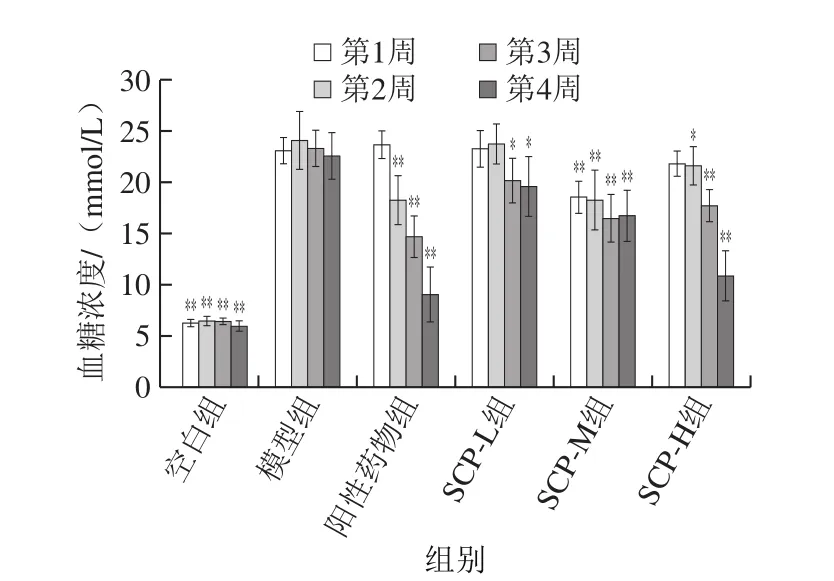
图2 SCP对大鼠血糖浓度的影响Fig. 2 Effect of SCP on blood glucose in rats
由图2可知,空白组大鼠空腹血糖浓度基本无变化,处于6~7 mmol/L之间。饲喂期间模型组空腹血糖浓度均在22 mmol/L以上,与空白组比较差异显著(P<0.05),即认为造模成功且糖尿病模型稳定性良好。灌胃后,大鼠空腹血糖没有降到空白组水平的原因推测是阳性药物剂量偏低或造模时血糖浓度太高造成的。各SCP剂量组均有不同程度的降血糖作用,且呈现一定的量效关系,随着SCP药物剂量的减少,降低血糖的能力也随之下降。
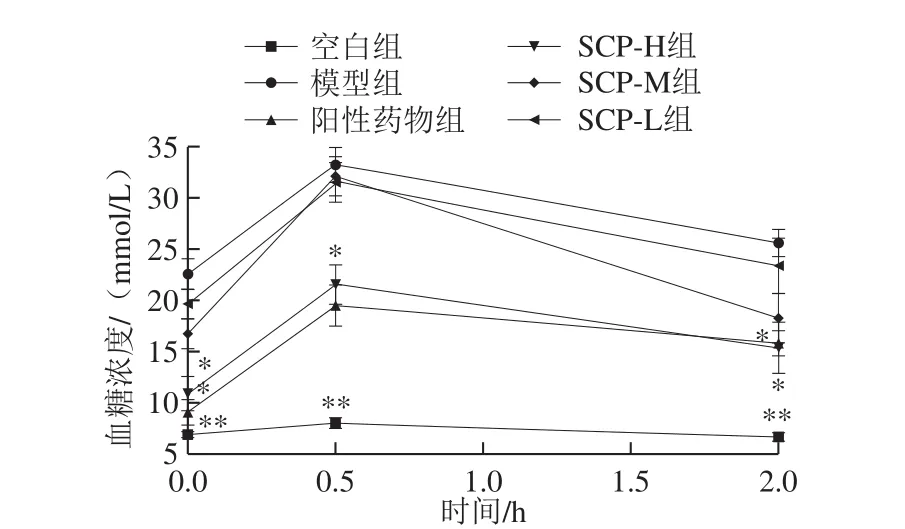
图3 SCP对大鼠葡萄糖耐受量的影响Fig. 3 Effect of SCP on glucose tolerance in rats
葡萄糖耐量实验可判断大鼠耐受葡萄糖的能力,可以根据耐受葡萄糖的强弱判断给药后胰岛β细胞对血液中血糖调节的能力[29]。由图3可知,空白组大鼠血糖浓度随时间变化趋势平缓,糖尿病模型组大鼠血糖浓度在各时间段都较高,经二甲双胍以及高剂量SCP治疗后,各时间段血糖浓度均显著下降(P<0.05),但SCP-M以及SCP-L组经过治疗后与模型组比较无显著性差异(P>0.05)。根据各组大鼠经口给予葡萄糖0、0.5、2 h的血糖浓度分别计算出血糖曲线下面积分别为:空白组为14.7,模型组为58.1,阳性组为33.6,SCP-H组为35.8,SCP-M组为50.0,SCP-L组为53.9。模型组与空白组比较差异显著(P<0.05),阳性药物组与模型组比较差异显著(P<0.05),各SCP给药组均具有降低血糖曲线下面积的趋势,且呈一定的量效关系,其中SCP-H组与模型组比较差异显著(P<0.05)。
2.3 SCP对糖尿病大鼠血清中胰岛素含量的影响
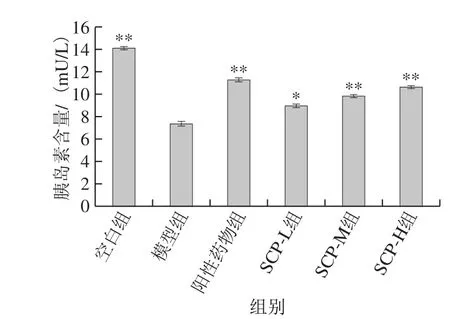
图4 SCP对糖尿病大鼠血清中胰岛素含量的影响Fig. 4 Effect of SCP on serum insulin content in diabetic rats
胰岛素在调节血糖过程中起到至关重要的作用,当胰岛素生物学效应发挥不足时,胰岛素的直接靶组织肌肉和脂肪会产生对血糖的利用、转运或储存效率降低的现象,同时也会增加肝脏中葡萄糖的输出,最终导致血糖浓度升高。由图4可见,灌胃后,与模型组比较发现,各灌胃组大鼠血清中胰岛素含量均有不同程度的升高,除SCP-L组差异显著外(P<0.05),阳性药物组和SCP-M、SCP-H组大鼠血清中胰岛素含量均较模型组大鼠极显著上升(P<0.01)。
2.4 SCP对糖尿病大鼠血脂指标的影响
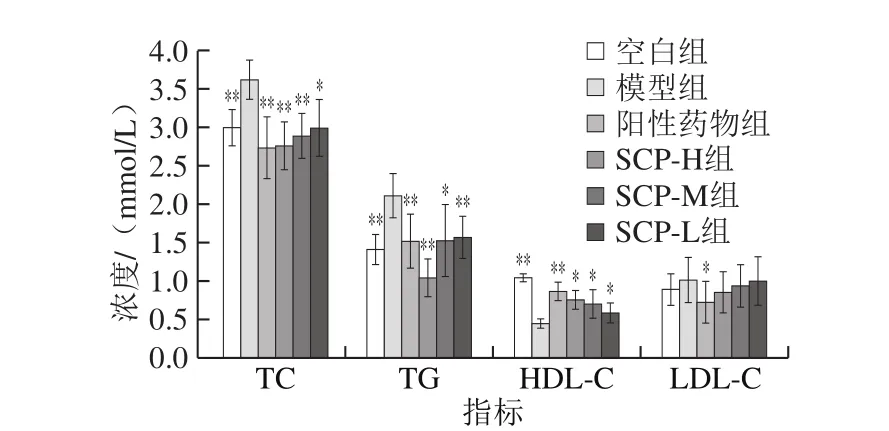
图5 SCP对糖尿病大鼠血脂的影响Fig. 5 Effect of SCP on blood lipids in diabetic rats
糖尿病与血脂水平密切相关,降低血脂水平有助于改善糖尿病[30]。由图5可见,与空白组相比,模型组的TC、TG和LDL-C水平显著增加,HDL-C水平显著降低(P<0.05),与张锦研究发现褪黑素可显著降低血脂的结果一致[31]。与模型组比较,阳性药物组和SCP高、中、低剂量组降低了TC、TG和LDL-C水平,并提高了HDL-C水平。其中HDL-C和LDL-C的水平与SCP浓度呈量效关系,且SCP-H组效果最佳。
2.5 SCP对糖尿病大鼠脏器指数的影响
如图6所示,与空白组比较,糖尿病模型组大鼠肝脏、肾脏的脏器指数极显著升高(P<0.01),表明高脂糖尿病大鼠呈现明显的肝脏、肾脏肿胀现象[32]。阳性药物组以及SCP各剂量组治疗后对脏器肿胀具有一定程度的减轻作用。
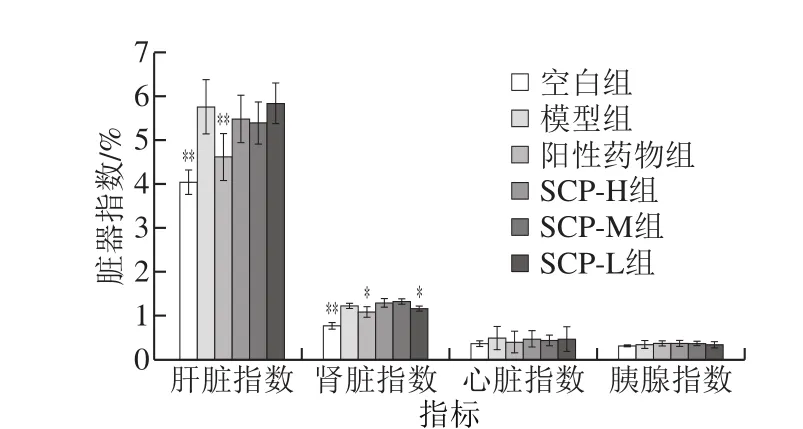
图6 SCP对糖尿病大鼠脏器指数的影响Fig. 6 Effect of SCP on organ coefficients in diabetic rats
2.6 SCP对大鼠胰腺组织的影响
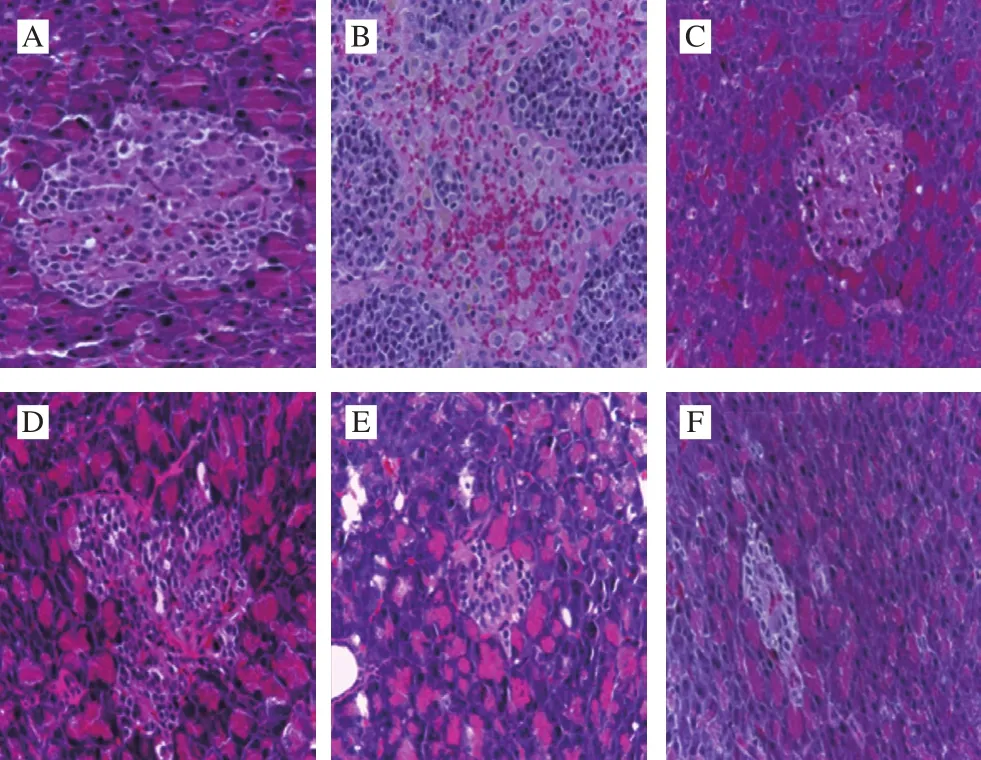
图7 SCP对大鼠胰腺组织的影响(×400)Fig. 7 Effect of SCP on pancreatic tissues in rats(× 400)
胰岛损伤是糖尿病发病的机理之一,而胰岛损伤程度可根据胰岛的完整性以及胰岛B细胞的排列和数量来判断[33]。苏木精-伊红染色后各组胰岛形态如图7所示。空白组大鼠胰岛组织结构完整,胰岛细胞排列整齐,边界清晰圆润;而模型组大鼠胰岛破坏明显,无明显的边界,胰岛细胞排列不规则;阳性药物组胰岛结构恢复完整,边界清晰,胰岛细胞数增加[34]。各SCP给药组对于胰岛组织和胰岛细胞起到一定的修复作用,与SCP剂量呈量效关系,且SCP-H组效果最佳。
3 讨 论
在本研究中,STZ诱导的糖尿病大鼠血糖水平明显升高,体质量降低。体质量下降的原因可能是由于没有碳水化合物作为能源从而导致的大鼠蛋白质消耗[35]。模型组肝、肾的脏器指数均显著高于空白组和药物组,表明高脂糖尿病大鼠呈现明显的肝脏、肾脏肿胀现象[36-37],而SCP-80-I可以改善STZ诱导的糖尿病大鼠的脏器指数。此外,糖尿病的发现与血脂代谢异常密切有关,而且血液中脂质水平的升高在某些情况下还可能导致心血管疾病的风险较高[38]。本实验中,与模型组比较,SCP-80-I组TC、TG、LDL-C、HDL-C水平均有显著变化,与李新明等的研究结果[39]一致。表明SCP-80-I可显著降低高脂血症大鼠的血脂水平,原因可能是SCP-80-I升高了血清中HDL水平,使胆固醇向肝脏转运、加速肝脏脂质降解从而降低了血脂水平。表明SCP-80-I可以改善STZ诱导的糖尿病大鼠的脂质代谢,降低心血管疾病的发生。通过分析胰腺组织中胰岛细胞的排列、形状以及分布,发现SCP-80-1对STZ诱导的型糖尿病大鼠胰腺组织细胞形态损伤有一定缓解作用,推测SCP可能具有修复糖尿病引起的胰腺脏器病变的功能。
综上所述,SCP-80-1可改善STZ诱导的糖尿病大鼠血糖以及血脂状况,其作用机制可能与胰岛细胞的修复及改善血脂水平过程有关,但降血糖以及降血脂的机制还需要进一步研究来阐明。甜玉米芯多糖作为具有一定开发潜力和研究价值的天然降糖物质,在糖尿病治疗中的应用具有广泛前景。

