仙草多糖对细胞氧化损伤的保护作用
何传波,邓 婷,魏好程,吴国宏,上官宇晨,熊何健*
(集美大学食品与生物工程学院,福建 厦门 361021)
生物体内自由基的过量积累会造成机体在分子水平、细胞水平及组织器官水平的各种不可逆的氧化损伤[1],从而加快机体氧化衰老进程,引发各类疾病[2]。适当摄入外源抗氧化剂,可通过清除体内自由基和抑制体内脂质过氧化反应,从而保护机体生物大分子免受氧化损伤。在各种外源抗氧化剂中,天然多糖类物质具有种类多、来源广、安全性高、抗氧化效果显著等优点,已经引起众多学者关注,近年来的研究发现,各种动植物提取的天然多糖物质如黄芪多糖、枸杞多糖、鲍多糖等具有显著的体内或体外抗氧化活性[3-6]。不少研究也表明,多糖的抗氧化活性可能是其促进免疫、抗肿瘤、抗衰老等其他活性的有效作用机制之一[7]。
仙草(Mesona blumes)系唇形科(Labiatae)凉粉草属(Mesona BI.)一年生草本宿根植物,主要分布于我国福建、广东、广西、台湾及东南亚等地[8],其中以福建省栽培面积最大。仙草味涩、性寒,具有清暑凉血及利尿之功效,主治中暑、消渴、感冒、高血压、黄疸、肾脏病和糖尿病等[9-11],全草可入药。同时,仙草食用历史悠久,加工利用价值高,以其为原料的凉茶、仙草冻、仙草茶、烧仙草等多种食品广受欢迎。目前仙草主要用于凉茶饮料生产,近年来在国内凉茶产业的带动下,仙草的种植面积和产量迅速增加。作为仙草主产区的福建省,2005—2014年,仙草栽培面积从500 hm2增加至5 000 hm2,产量从4 000 t迅速增加达到3.8万 t[12]。但是,仙草用途的单一性也造成其对凉茶产业的过度依赖,增加了种植风险。为此,亟需深入研究仙草的活性成分,充分挖掘其深层次开发利用价值,丰富产品结构,这对延伸和完善仙草种植和加工产业链,发展地方经济具有重要的现实意义。
仙草含有多糖、黄酮类、三萜类、酚类化合物等多种化学成分,多糖是其中含量最多、应用最广的有效成分,占仙草质量的20%左右[13]。有报道证实仙草多糖具有促进凝胶、抑菌和抗氧化等功能作用[14-15]。随着人们对安全与健康的日益关注,以天然抗氧化剂取代合成抗氧化剂是食品行业的发展趋势,因此仙草多糖作为高效安全的天然抗氧化剂具有广阔的开发前景。本研究以福建仙草为原料,通过离子交换层析和凝胶柱层析对碱法提取的仙草粗多糖进行分级纯化,构建了人体肝细胞LO2的过氧化氢(H2O2)损伤模型,通过测定乳酸脱氢酶(lactate dehydrogenase,LDH)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活力和丙二醛(malondialdehyde,MDA)含量等指标,从细胞水平上探讨仙草多糖对氧化损伤细胞的保护作用,以期为仙草多糖天然抗氧化剂的开发利用提供数据支持。
1 材料与方法
1.1 材料与试剂
仙草,产自福建省龙岩市,洗净晒干,粉碎后过筛(80 目),置于干燥器中,贮存备用。人体肝细胞LO2细胞株,来源于中国药科大学药学医学基础实验教学中心。
层析柱填料DEAE Sepharose CL-6B、Sephacryl S-300HR 美国GE Healthcare公司;1-苯基-3-甲基-5-吡唑啉酮(3-methyl-1-phenyl-2-pyrazolin-5-one,PMP)、乙腈(色谱纯)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)、台盼蓝、单糖标准品(甘露糖、葡萄糖、鼠李糖、半乳糖、阿拉伯糖、木糖、岩藻糖、半乳糖醛酸) 美国Sigma公司;胎牛血清(fetal bovine serum,FBS) 德国PAN公司;DMEM高糖基础培养基、双抗(青霉素/链霉素)、质量分数0.25%胰酶 美国HyClone公司;BCA(2,2-联喹啉-4,4-二甲酸二钠)蛋白定量试剂盒、LDH、GSH-Px、CAT、SOD、MDA测定试剂盒 南京建成生物工程研究所;其余化学试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
BT1-100L-LCD蠕动泵、SBS-100-LCD自动部份收集器、TH-1000A梯度混合仪 上海琪特分析仪器有限公司;WK-200B高速药物粉碎机 青州市精诚机械有限公司;JDG-0.2T真空冻干机 兰州科近真空冻干技术有限公司;3K3D高速冷冻离心机 德国Sigma公司;RNF0460-011多功能卷式膜设备 厦门福美科技有限公司;UV-8000A紫外-可见分光光度计 上海尤尼柯仪器有限公司;BS-124S电子天平 德国赛多利斯股份有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;pH211台式酸度测定仪 北京哈纳科技有限公司;MSI微型漩涡振荡器 广州科技实验室技术有限公司;Ultimate3000高效液相色谱仪 美国DIONEX公司;E2695凝胶渗透色谱仪、2417示差检测器 美国Waters公司;LEAD-2 18角度激光光散射仪 奥豪斯仪器(上海)有限公司;EVOS倒置显微镜 美国AMG公司;DW-FL253低温冰箱 中科美菱公司;M200PRO酶标仪 瑞士Tecan公司;SeriesIIWater CO2细胞培养箱美国Thermo公司。
1.3 方法
1.3.1 仙草粗多糖的制备
称取一定量仙草粉末,按液料比30∶1加入质量分数1.2%的NaHCO3溶液,沸水浴浸提3 h,离心收集上清液,过超滤膜后收集截留液,减压浓缩后加入5 倍体积的体积分数95%乙醇溶液沉淀,离心,沉淀加水溶解,经浓缩、透析、冻干后即为仙草多糖,命名为JMBP-C样品。
1.3.2 仙草多糖的层析纯化流程
仙草粗多糖JMBP-C→DEAE Sepharose CL-6B离子交换层析→收集目标洗脱液→透析→旋转蒸发浓缩→Sephacryl S-300HR柱层析→收集目标洗脱液→旋转蒸发浓缩→冷冻干燥→纯化仙草多糖组分JMBP-N、JMBP-A1、JMBP-A2
1.3.3 多糖样品化学组成测定
多糖质量分数的测定:苯酚-硫酸法[16];糖醛酸质量分数测定:硫酸-咔唑法[17];蛋白质量分数的测定:参照GB 5009.5—2010《食品安全国家标准 食品中蛋白质的测定》。
1.3.4 单糖组成分析
取8 种标准单糖(甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖和岩藻糖)各5 mg,配制成1 mg/mL的标准品溶液。取500 μL单糖标准品,加入500 μL 0.3 mol/L NaOH溶液,再加入500 μL 0.5 mol/L PMP-甲醇溶液,混匀后于70 ℃水浴条件下衍生60 min,冷却后,加入500 μL 0.3 mol/L HCl溶液,混匀。再滴加1 mL三氯甲烷,漩涡振荡2 min,弃去下层,重复操作3 次,最后过0.45 μm微孔滤膜备用。
称取2 mg仙草多糖样品,加入2 mol/L三氟乙酸溶液1 mL,充入氮气密封,110 ℃烘箱中水解6 h,冷却至室温。加入1 mL甲醇溶液(色谱纯),50 ℃旋转蒸发,重复旋转蒸发操作3~5 次直到全部去除三氟乙酸,用500 μL超纯水溶解,参照上述单糖标准品衍生法制备多糖样品衍生物。
分离柱采用Symmetry C18色谱柱(4.6 mm×250 mm,5 μm);检测波长250 nm;柱温:25 ℃;上样量:20 μL;流速:1.0 mL/min;流动相:0.1 mol/L磷酸盐水溶液-乙腈(8∶2,V/V);洗脱方式:等梯度洗脱;洗脱时间:30 min。
1.3.5 分子质量测定
样品处理:多糖样品用200 mmol/L NaCl(含有0.02% NaN3)溶液溶解至2 mg/mL,4 ℃保存过夜,12 000 r/min离心10 min,上清液过0.22 μm微孔滤膜备用。
色谱条件:采用GPC-MALLS技术[18-19],液相系统:e2695 HPLC;检测器:2414示差检测器和DAWN HELEOS-Ⅱfrom Wyatt激光散射仪;色谱柱:Shodex SB-804凝胶分离柱;流动相:200 mmol/L NaCl+0.02% NaN3溶液;进样量:100 µL;流速:0.5 mL/min;柱温:40 ℃。
1.3.6 细胞抗氧化实验
1.3.6.1 LO2细胞的培养
接收到新的LO2细胞后,换成新配制的含有质量分数10% FBS、1%双抗的DMEM高糖完全培养基,置于37 ℃、5% CO2、饱和湿度的CO2培养箱中继续培养,培养2~3 代后大量冻存细胞,以保证后续细胞实验的稳定性。新复苏的LO2细胞传代至少3 代后开始实验,所有的实验应在细胞传代20 代前完成。
1.3.6.2 仙草多糖对细胞存活率的影响
取对数生长期的LO2细胞,调整其细胞密度1×105cells/mL,100 μL/孔接种于96 孔板中,37 ℃、5%的CO2恒温培养箱中培养24 h,弃上清液,用磷酸盐缓冲液(phosphate buffered saline,PBS)清洗1~2 遍后分为空白组、实验组和正常对照组。空白组不加细胞只加完全培养基;实验组加入不同质量浓度(初次筛选时为0.005、0.05、0.5、2.5、5、10 mg/mL,进一步筛选时为0.125、0.25、0.5、1、2 mg/mL)的仙草多糖样品JMBP-C、JMBP-N、JMBP-A1、JMBP-A2,各质量浓度设置6 组平行;正常对照组用完全培养基代替多糖溶液。3 组继续培养24 h,弃上清液,PBS清洗2 次,加入20 µL MTT,继续培养4 h,加入150 µL二甲基亚砜,振荡5 min,用酶标仪于490 nm波长处测定吸光度。通过下式计算细胞存活率。

1.3.6.3 细胞H2O2氧化损伤模型的建立
调节处于对数生长期的细胞密度为1×105cells/mL,接种于96 孔板,每孔100 μL,于37 ℃、5%的CO2恒温培养箱中培养24 h。弃去培养液,用PBS清洗2 次。将细胞分为空白组、正常对照组和损伤模型组,其中,空白组和正常对照组同1.3.6.2节,损伤模型组分别加入100 μL不同浓度的H2O2溶液(以完全培养基配制,浓度分别为0、0.5、1、2、4、6、8、10 mmol/L),各浓度设置6 个平行,继续培养2 h。H2O2损伤后,弃上清液,PBS清洗2 遍,再按照1.3.6.2节中MTT法测定细胞存活率。
1.3.6.4 仙草多糖对H2O2损伤细胞保护作用的测定
细胞培养同1.3.6.1节,设正常对照组、H2O2损伤模型组、实验组和VC阳性对照组。正常对照组和损伤模型组加入完全培养基,实验组加入不同质量浓度的仙草多糖,阳性对照组加入不同浓度的VC,再培养24 h后,弃去培养液,PBS清洗2 遍,正常对照组加入完全培养基,其余组加入4 mmol/L H2O2溶液进行氧化损伤2 h,培养结束用MTT测定细胞存活率。
1.3.6.5 抗氧化指标的测定
调整对数生长期的LO2细胞密度为5×105cells/mL,1.5 mL/孔接种于6 孔板中,放置细胞培养箱中培养24 h。设正常对照组、H2O2损伤模型组、JMBP-C组、JMBP-A1组、JMBP-A2组、VC阳性对照组,具体操作同1.3.6.4节。细胞经仙草多糖样品和H2O2处理后,收集细胞培养液和细胞进行各种指标的测定。其中细胞培养液直接用于LDH活力的测定;细胞用PBS清洗2 次,1 mL 0.25%胰蛋白酶进行消化,1 000 r/min离心5 min,收集细胞沉淀,加入1 mL PBS,冰浴条件下超声破碎细胞(功率300 W,5 s/次,间隔时间30 s,重复5 次)。GSH-Px、CAT、SOD活力及MDA生成量的计算均以蛋白含量为基础,蛋白含量测定采用BCA法。以上抗氧化指标的测定均使用试剂盒检测,所有操作严格按说明书进行。
1.4 数据统计分析
数据采用SPSS 17.0软件进行统计学分析,实验结果用±s表示,通过Duncan检验法进行显著性分析,P<0.01为极显著性差异,P<0.05为显著性差异。
2 结果与分析
2.1 仙草多糖的组成
采用NaHCO3溶液浸提仙草多糖,在前述制备条件下,多糖得率为8.1%。得到的仙草粗多糖JMBP-C经离子交换和凝胶柱层析纯化后得到3 个组分JMBP-N、JMBP-A1和JMBP-A2,其中,JMBP-N为超纯水洗脱的中性糖组分,JMBP-A1和JMBP-A2为NaCl梯度洗脱的酸性多糖组分。各组分占初始进样量(1 g)的比例分别为22.14%、28.97%和34.07%(以多糖含量计算),多糖总回收率为85.18%。
观察其外观形态,4 种组分的颜色为白色或浅黄色;质地轻,溶解性良好,溶于水后接近透明。粗多糖除了表1中所列成分外,还含有较多的黄酮,经NaNO2-Al(NO3)3-NaOH比色法测定质量分数为7.71%,这与文献[13]报道结果一致。4 种组分蛋白含量都很少,除了中性糖组分JMBP-N外,另外3 种多糖均含有较多的糖醛酸,以JMBP-A2的质量分数最高,达到59.14%。这与Lai等[20]的结论一致,其研究发现台湾仙草胶主要成分是多糖,含有大量的糖醛酸,并推测仙草胶属于阴离子性多糖。仙草的凝胶性是其食品加工的重要特性,根据糖醛酸含量较高的果胶成胶机理推测,糖醛酸可能在仙草凝胶过程中也起着重要的作用。在后续的研究中也证实了这一点,中性糖JMBP-N无法与淀粉形成凝胶,只有2 种酸性多糖组分才可以成胶。
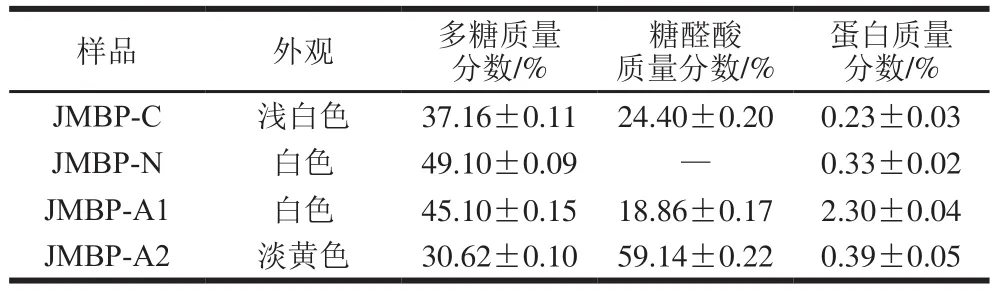
表1 仙草多糖的外观及化学组成Table 1 Appearance and chemical composition of Mesona blumes polysaccharides
单糖组成分析是研究多糖结构、性质等的基础,对纯化后的3 种多糖样品进行水解衍生后,通过高效液相色谱测定仙草多糖的单糖组成,结果如表2所示。中性糖JMBP-N的单糖组成较为简单,由甘露糖(Man)、葡萄糖(Glu)和半乳糖(Gal)组成,以半乳糖质量分数最高。2 种酸性糖中,JMBP-A1由甘露糖、鼠李糖(Rha)、半乳糖醛酸(GalA)、葡萄糖、半乳糖、木糖(Xyl)组成,以木糖质量分数最高,JMBP-A2由甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖(Ara)和岩藻糖(Fuc)组成,以半乳糖醛酸的质量分数最高。目前,已有文献报道仙草粗多糖由甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和木糖等多种单糖组成[21-22],这与本实验结果一致。
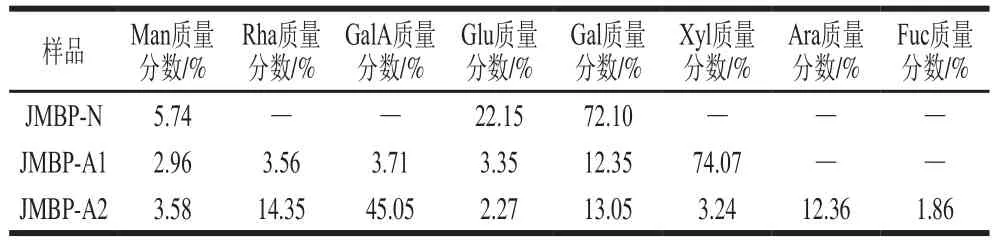
表2 仙草多糖的单糖组成Table 2 Monosaccharide compositions of Mesona blumes polysaccharides
2.2 仙草多糖的分子质量
采用凝胶渗透色谱-多角度激光光散射法分析3 个纯化组分的重均分子质量(Mw),结果如表3所示。对比各组分的多分散性(Mw/Mn)可知,JMBP-N和JMBP-A2的多分散性值接近1,说明该样品纯度较高,而JMBP-A1的纯度相对较低。3 种多糖组分中JMBP-A1的分子质量最大,为15.19 kDa,其次是JMBP-A2,为12.06 kDa,JMBP-N的分子质量最小,为1.25 kDa,表征分子尺寸的均方根旋转半径由大到小也是JMBP-A1>JMBP-A2>JMBP-N。

表3 仙草多糖的重均分子质量及分子尺寸Table 3 Molecular masses and sizes of Mesona blumes polysaccharides
2.3 仙草多糖对H2O2损伤细胞的影响
2.3.1 仙草多糖对正常细胞生长的影响
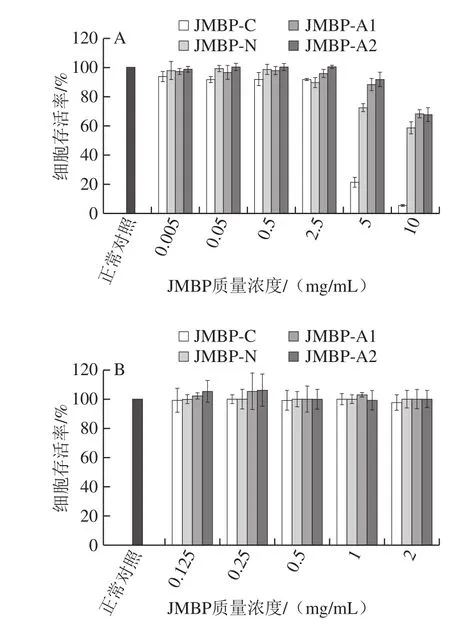
图1 不同质量浓度的仙草多糖对LO2细胞生长的影响Fig. 1 Effects of different concentrations of Mesona blumes polysaccharides on LO2 cell growth
为了确定仙草多糖对正常细胞的毒性作用,在构建细胞氧化损伤模型前,首先探讨了不同质量浓度的仙草粗多糖及3 种纯化样品对正常LO2细胞生长的影响,以细胞生长率为检测指标,结果如图1所示,细胞存活率的检测采用MTT比色法。结果表明,仙草多糖在质量浓度0.005~2.5 mg/mL范围内均对LO2细胞的生长无明显影响,细胞存活率都达到90%以上。当质量浓度达到5 mg/mL时,4 种多糖样品组的细胞存活率明显下降,分别下降到正常对照组的21.63%、72.72%、88.70%和92.02%,说明高质量浓度的仙草多糖对LO2细胞的生长有一定的抑制作用,缩小多糖处理质量浓度范围为0.125、0.25、0.5、1、2 mg/mL(图1B)。LO2细胞的存活率均在90%以上,细胞增殖率均在10%以下,多糖对细胞生长无显著增殖或衰亡作用,因此确定以此多糖质量浓度范围进行进下一步实验。
2.3.2 细胞氧化损伤模型的建立
不同细胞对H2O2氧化损伤的耐受程度不同,需要确定氧化损伤模型的H2O2浓度,筛选条件为与空白对照组比较达到半数细胞致死。不同浓度H2O2处理对LO2细胞存活率的影响如图2所示。结果表明,细胞存活率随H2O2浓度的增加明显呈下降趋势,浓度为4 mmol/L时,细胞的存活率为51%,接近半数致死,当浓度为10 mmol/L,细胞存活率甚至低至20%左右。因此,选择H2O2浓度4 mmol/L建立LO2细胞损伤模型。
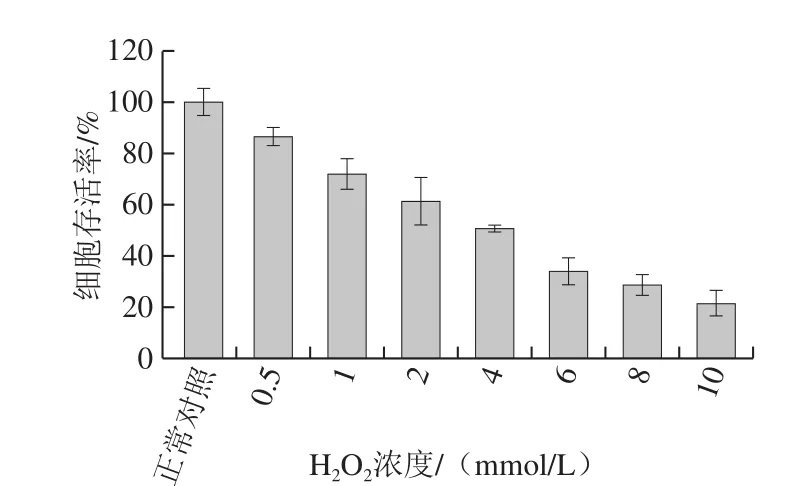
图2 不同浓度H2O2对LO2细胞相对存活率的影响Fig. 2 Effects of different concentrations of H2O2 on the relative survival rate of LO2 cells
2.3.3 仙草多糖对氧化损伤细胞的保护作用
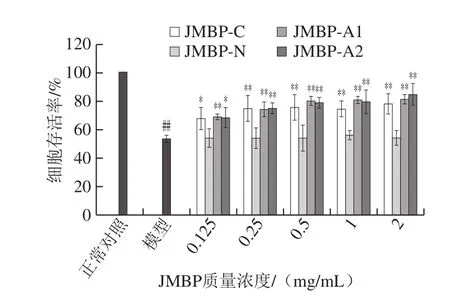
图3 仙草多糖对LO2细胞氧化损伤的保护作用Fig. 3 Protective effect of Mesona blumes polysaccharides on oxidative damage in LO2 cells
仙草多糖对H2O2诱导LO2细胞氧化损伤的保护作用见图3。与H2O2模型组相比,JMBP-N对细胞氧化损伤基本无保护作用,JMBP-A1的保护效果最好,其各质量浓度组的细胞存活率均极显著增长(P<0.01),0.5 mg/mL时,细胞存活率比模型组增加49.47%。JMBP-C组和JMBP-A2组在质量浓度为0.125 mg/mL时细胞存活率增长显著(P<0.05),质量浓度达到0.25 mg/mL以上时细胞存活率增长极显著(P<0.01),表明仙草多糖对H2O2诱导LO2细胞氧化损伤有保护作用。因此选择JMBP-C、JMBP-A1及JMBP-A2进行后续的抗氧化实验,选取多糖样品质量浓度0.125、0.5 mg/mL和2 mg/mL进行后续抗氧化指标的测定。
2.3.4 仙草多糖对氧化损伤细胞LDH的影响
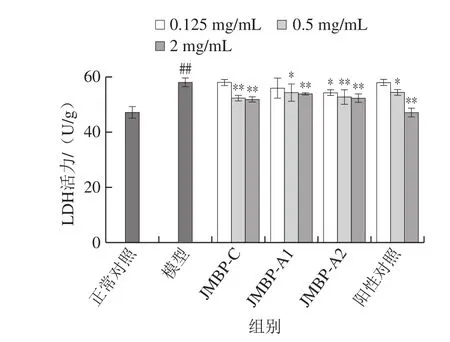
图4 仙草多糖对LDH活力的影响Fig. 4 Effect of Mesona blumes polysaccharides on LDH activity
LDH广泛存在于生物体内,细胞受到氧化损伤后,体内活性自由基增加,破坏细胞膜,细胞膜破裂会使胞内LDH漏出,上清液中LDH释放量能间接反映细胞的损伤程度。从图4中可看出,H2O2作用于LO2细胞后,LDH释放量为正常对照组的1.24 倍,呈极显著升高(P<0.01)。仙草多糖能明显减少培养液中LDH的释放,且随着多糖剂量的增大,效果越明显,呈现一定的量效关系,与模型组相比,3 种多糖样品组在高剂量(2 mg/mL)时均达到达到极显著水平(P<0.01)。粗多糖和2 种纯化多糖相比,各剂量组均没有显著差异。与阳性对照组相比,3 种多糖样品的中、低剂量组降低LDH释放的水平相当,无显著差异。但VC高剂量组降LDH的效果极显著高于多糖样品组(P<0.01)。这表明仙草多糖能有效降低氧化损伤细胞的LDH释放,对氧化损伤细胞有一定的保护作用。
2.3.5 仙草多糖对氧化损伤细胞抗氧化酶活力的影响
GSH-Px、CAT、SOD是机体内抗氧化酶系统的重要组成部分,可以有效清除机体产生的氧自由基,保护细胞免受自由基攻击[23]。因此,3 种抗氧化酶活力的高低可以反映机体抗氧化能力的强弱。
GSH-Px能够催化GSH转化为GSSG,对防止体内自由基引起的膜脂质过氧化起着重要作用。仙草多糖对细胞内GSH-Px活力影响结果如图5所示,可以看出,模型组细胞内GSH-Px活力降低到正常对照组的48.49%,达到极显著水平(P<0.01),表明氧化损伤后会大幅降低细胞GSH-Px活力。与模型组相比,3 种多糖样品组能明显提高GSH-Px活力,且随着多糖质量浓度升高,GSH-Px活力也呈上升趋势。JMBP-A2对GSH-Px活力的提高作用最强,3 个剂量组提升作用均达到极显著水平,JMBP-A1作用次之,在中、高剂量组能达到极显著效果,而JMBP-C在高剂量时才能极显著提高GSH-Px活力。说明仙草多糖可以有效提高氧化损伤细胞的GSH-Px活力,可以通过抑制膜脂质过氧化而发挥其抗氧作用。与阳性对照VC相比,仙草多糖提高GSH-Px活力的效果稍差,VC的高剂量组能将损伤细胞的GSH-Px活力提高到正常细胞的83.60%,而JMBP-A2的高剂量组只能提高到正常细胞的71.01%。但是,仙草多糖的低剂量组提高酶活力的效果要远高于VC,JMBP-A2的低剂量组能将GSH-Px活力提高到正常细胞的69.20%,而VC的低剂量组只能提高到正常细胞的53.59%。
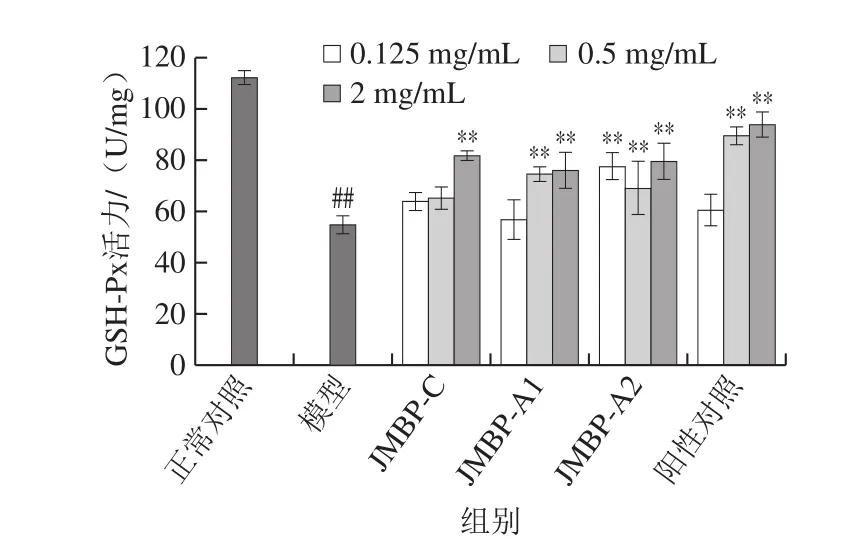
图5 仙草多糖对GSH-Px活力的影响Fig. 5 Effect of Mesona blumes polysaccharides on GSH-Px activity
SOD通过清除O2-·而发挥抗氧化作用,图6显示,模型组细胞内SOD活力较正常对照组极显著降低64.48%(P<0.01),表明氧化损伤能降低SOD活力。与模型组相比,3 种多糖样品组能提高SOD活性,但提升效果不如GSH-Px,且JMBP-C和JMBP-A1随质量浓度升高,呈现一定的量效关系。3 种多糖样品中,JMBP-A1提高SOD活力能力最强,其高剂量组将SOD活力恢复到正常对照组的80.32%,极显著高于模型组(P<0.01),与VC高剂量组接近(正常对照组的84.37%)。表明仙草多糖能提高受损细胞中SOD活力,防止其受损后快速氧化,具有一定的保护能力。
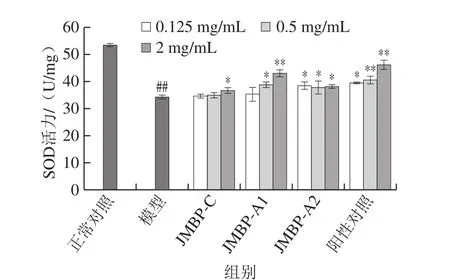
图6 仙草多糖对SOD活力的影响Fig. 6 Effect of Mesona blumes polysaccharides on SOD activity
CAT主要存在于能呼吸的生物体内,如植物的叶绿体、线粒体、内质网、动物的肝和红细胞中,它能分解H2O2而保护细胞免受氧化损伤。图7是仙草多糖对细胞内CAT活力的影响,结果显示,氧化损伤能显著降低CAT活力,模型组细胞内CAT活力降低到正常对照组的42.20%,且达到极显著水平(P<0.01)。仙草多糖能明显提高受损细胞内CAT活力,与模型组比较,3 种样品的各质量浓度均达到极显著水平(P<0.01)。3 种多糖样品中,JMBP-A1提高CAT活性能力最强,3 个剂量组均与对照组无显著差异,其高剂量组将受损细胞的CAT活力提高了108.82%,将CAT活力恢复到正常对照组的88.14%。
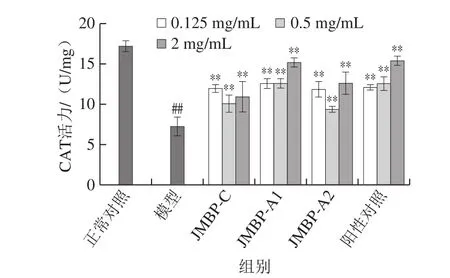
图7 仙草多糖对CAT活力的影响Fig. 7 Effect of Mesona blumes polysaccharides on CAT activity
2.3.6 仙草多糖对氧化损伤细胞MDA含量的影响
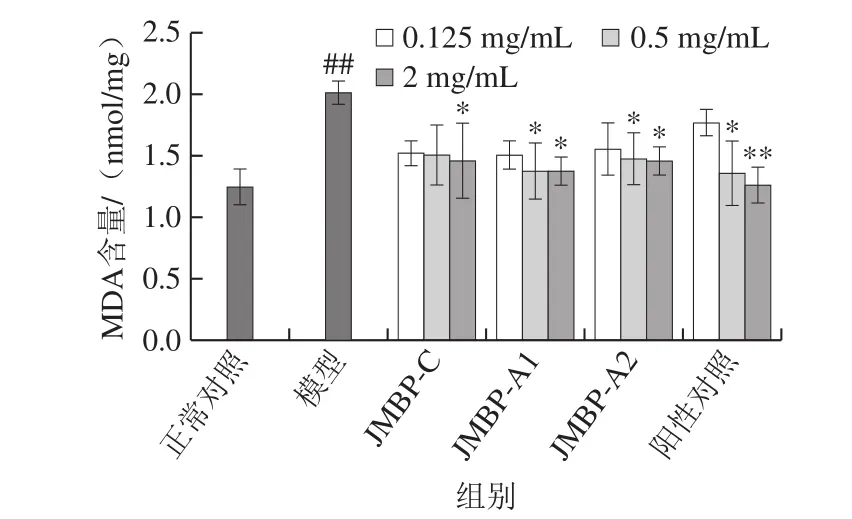
图8 仙草多糖对MDA含量的影响Fig. 8 Effect of Mesona blumes polysaccharides on MDA content
MDA是机体自由基攻击细胞生物膜中的不饱和脂肪酸产生的脂质过氧化物,其含量与细胞氧化损伤的程度呈正相关[24],因此,MDA作为脂质过氧化的生物标记物之一,其含量可以间接地反映细胞受损伤程度。由图8可知,模型组细胞MDA含量为正常对照组的1.63 倍,极显著升高(P<0.01),表明细胞受到氧化损伤后会大量增加MDA生成。与模型组相比,3 种多糖样品均能有效减少MDA生成,两种纯化多糖的中、高剂量组均达到显著水平(P<0.05)。3 种多糖中,JMBP-A1降MDA效果最好,中剂量组使受损细胞的MDA含量降低了31.50%,与VC中剂量组效果(32.00%)接近。
3 讨 论
生活水平的提高、饮食方式的变化,以及工作压力的增大和生活环境的日益恶化,都会促使人体内氧自由基快速增加[25-26],不可避免地产生氧化损伤。目前市售的合成抗氧化剂主要用于食品、药品的保存,包括二丁基羟基甲苯和丁基羟基茴香醚等,其对人体有一定的不良反应;因此,高效低毒的天然抗氧化剂受到越来越多关注。大量研究发现,天然多糖不仅能通过捕获链式反应中的自由基直接阻断自由基链式反应,还能对引发链式反应的自由基进行清除[27],具有显著的抗氧化活性。本实验采用碱液浸提法从仙草中提取多糖,通过离子交换、凝胶柱层析和超滤方法对粗多糖成分进行分离纯化,获得3 种单一的多糖组分,并构建了人肝LO2细胞的H2O2损伤模型,通过细胞质膜标记酶LDH的释放、抗氧化酶GSH-Px、SOD、CAT的活力和脂质过氧化物MDA的含量探讨不同仙草多糖对氧化损伤细胞的保护作用。
目前,评价抗氧化活性的实验方法主要包括动物模型法、化学检测法和细胞模型法[6]。细胞模型能够模拟机体内部环境和生物行为,比传统的体外化学抗氧化测定更具生物相关性,且实验周期较短,可以有效弥补体外评价方法的不足。常用的细胞氧化损伤模型有H2O2损伤模型和过氧化脂损伤模型两种,其中H2O2的应用最为广泛。H2O2极易穿透细胞膜,并通过Fenton反应形成具有铁分子的高反应性自由基,从而引起细胞正常结构和功能的损伤,是构建细胞氧化损伤模型最常用的物质。已有大量学者利用H2O2损伤模型进行多糖抗氧化活性的研究,刘洋等[28]用H2O2诱导的氧化损伤细胞模型对黑果枸杞叶多糖LRLP3的抗氧化活性进行研究,结果表明,LRLP3能明显提高细胞存活率,当质量浓度为200 μg/mL时,细胞相对存活率达到101.4%,与未损伤细胞存活率无显著差异。Shan Tieying等[29]通过构建H2O2诱导的子宫内膜间质细胞ESCs氧化损伤模型探讨枸杞多糖LBPs的抗氧化活性,采用形态学观察、细胞增殖测定、SOD和MDA检测等方法,证实LBPS能够抑制H2O2诱导的EEC细胞凋亡,并且能对ESCs细胞的氧化应激提供显著的保护。本实验采用H2O2对人肝LO2细胞进行氧化损伤,结果表明,细胞存活率随H2O2浓度的增加明显呈下降趋势,H2O2浓度为4 mmol/L时,细胞的存活率为51%。经2 h的H2O2处理,LDH释放量极显著增加到正常细胞的1.24 倍,细胞内抗氧化酶GSH-Px、SOD和CAT活力分别降低到正常对照组的48.49%、64.48%和42.20%,且均达到极显著水平(P<0.01),同时,还使得脂质过氧化物MDA含量极显著增加到正常细胞的1.63 倍。
抗氧化机制的研究已经深入到体内信号通路层面,天然活性物质作为诱导剂,能够影响核转录因子与结合蛋白的结合,进而对下游抗氧化酶的表达进行调控,发挥抗氧化保护作用,Keap1-Nrf2-ARE、PI3K/Akt/eNOS等信号通路都是当前细胞氧化应激机制研究中的热点[4]。而这些信号通路最终体现的结果就是生物体内各种抗氧化酶的变化,并且体内多余的自由基也是在这些酶的催化作用下最终还原生成对人体无害的H2O和O2[30-31],因此GSH-Px、SOD、CAT的活性能直接反映机体抗氧化能力。此外,血清中脂质过氧化终产物MDA含量和LDH的漏出量也能够间接反映细胞损伤程度。本研究采用上述建立的氧化损伤模型对不同质量浓度仙草粗多糖JMBP-C及纯化样品JMBP-A1和JMBP-A2的抗氧化活性进行评价。结果表明,仙草多糖能显著增加氧化损伤细胞的存活率,JMBP-A1在0.5 mg/mL质量浓度时,细胞存活率比模型组增加49.47%,高于阳性对照。3 种多糖样品能明显降低上清液中LDH的泄漏量以及MDA的生成量,同时,显著增加受损细胞内GSH-Px、SOD和CAT 3 种抗氧化酶的活力。很多研究者认为植物多糖通过清除各种活性氧自由基,减少脂质过氧化产物丙二醛的生成量,提高如SOD、GSH-Px等抗氧化酶的活性,通过多种途径发挥抗氧化作用。Jin Yue等[32]从中药穿山龙中提取多糖(Rhizoma dioscoreaenipponicae polysaccharides,RDNP),通过H2O2对人脐静脉内皮细胞HUVECs进行氧化损伤,采用LDH活力、MDA含量、SOD活力、T-AOC和GSH-Px活力等指标对抗氧化活性进行评价,证实RDNP可以降低H2O2处理的HUVECs细胞的LDH和MDA水平,增强细胞内SOD活力、T-AOC以及GSH-Px活力。另外,有关仙草活性的众多报道也证实仙草提取物和仙草多糖具有抗氧化功能。杨敏[33]发现仙草提取物能通过提高提高大鼠肝匀浆中GSH-Px的活性,抑制MDA的生成,发挥抗氧化作用。Yeh等[34]发现,仙草水提物WEHT具有降血压和提高抗氧化活性,能有效降低自发性高血压大鼠的血压及血浆和肝脏中MDA含量,并显著增加肝脏抗氧化酶的活性,氧自由基清除能力和总谷胱甘肽水平也明显高于对照组。Lai等[35]以碳酸氢钠溶液提取的仙草粗多糖,对超氧自由基的清除作用和Fe2+螯合能力优于市售的α-生育酚和二丁基羟基甲苯,并且对MDA的形成具有一定的抑制作用。综合现有关于仙草多糖抗氧化活性的报道发现,鲜有对纯化多糖的抗氧化活性进行研究,因此,本实验是对现有研究的有效补充。
多糖的结构决定了多糖的性质和活性,多糖的化学组成、分子质量、单糖组成、糖苷键构型等一级结构和高级结构都与其功能活性密切相关。有研究报道,茶叶多糖清除超氧自由基和DPPH自由基的能力与其糖醛酸含量呈正相关[36]。本实验得到的4 种多糖样品,JMBP-N不含有糖醛酸,没有表现出明显的抗氧化活性,JMBP-C、JMBP-A1、JMBP-A2均含有糖醛酸,都表现出一定的抗氧化活性。JMBP-A2糖醛酸含量最高,但在多项抗氧化指标中并没有表现出最强的活性,这说明糖醛酸基团的存在与否可能是影响其抗氧化活性的重要因素,但是糖醛酸含量和活性并不是简单的正相关。另外,比较粗多糖和纯化多糖的活性发现,粗多糖表现的活性最弱,表明采用柱层析和超滤方法不仅能较好地对粗多糖进行分级纯化,并且也有助于获得生物活性更高的组分。但是,在个别指标,如降低LDH漏出量方面表现较好,推测可能是因为粗多糖中除多糖外,还含有黄酮等抗氧化活性物质所致。
福建作为全国仙草种植面积最大的省份,在行业里存在加工产品单一,全值化、高值化利用水平低的问题。而作为仙草中含量最高的多糖,其工业化提取、纯化、加工及活性研究更是仙草综合利用过程中首先需要解决的问题。本研究证实了仙草多糖对氧化损伤细胞具有良好的保护作用,是一种具有很大开发潜力的天然抗氧化功能因子,因此,后续应进一步完善制备工艺,并深入探讨其抗氧化作用机制。

