自由基联合超声降解法在海带岩藻聚糖硫酸酯中的应用
郭峰君 杨乐乐
摘要:为研究广西海域海带岩藻聚糖硫酸酯的基本组成,用水提醇沉法提取岩藻聚糖硫酸酯,用自由基联合降解法降解广西海域海带岩藻聚糖硫酸酯,获得低分子量杂多糖,对广西海域海带的硫酸根含量、岩藻糖含量等指标进行测定,用聚丙烯酰胺凝胶电泳法对自由基降解方法获得的低分子量多糖分子量分布进行研究。结果表明,利用自由基氧化降解联合超声降解法能得到分子量较低且分布比较广的杂多糖,说明该方法简单、降解速率块、无毒副作用,正交试验得出,当超声功率为400 W,温度为60 ℃,时间为60 min,pH值为8.0时降解速率最佳。
关键词:广西海带;岩藻聚糖硫酸酯;自由基降解;超声降解;凝胶电泳法
海带(Laminaria japonica),别称纶布、昆布、江白菜,不但可以食用,其药用价值在本草纲目等医书中也早有记载,是生长在低温海水中的一种多年生大型藻类[1]。广西海岸线较长,北部湾盛产海带。岩藻聚糖硫酸酯(Fucoidan),别称褐藻胶,是褐藻、海参和海胆中特有的一种以岩藻糖为主的硫酸酯多糖[2],主要富集在细胞壁中[3-4]。不同产地、不同提取方式,岩藻聚糖硫酸酯结构存在差异[5]。岩藻聚糖硫酸酯主要由硫酸化的岩藻糖和少量的糖醛酸、半乳糖、木糖、甘露糖、葡萄糖等组成,是一种水溶性杂多糖[6]。海带中岩藻聚糖硫酸酯的分子量大,糖组成复杂,分子量分布范围较广。Alban等发现,分子量高的岩藻聚糖较难被吸收,而分子量低的则溶解性好、黏度小、吸收利用率高、生物活性较高[7]。目前,美国、日本、俄罗斯、德国、挪威等国家的岩藻聚糖产品均已上市或进行临床应用,在中国也有岩藻聚糖硫酸酯开发上市[8-10]。岩藻聚糖硫酸酯具有多种生物活性,而生物在消化利用大分子量多糖上存在障碍[11]。
岩藻聚糖硫酸酯的药理活性与其分子量大小、单糖组成、硫酸根含量、糖苷键连接方式都具有相关性[12-13]。药理功效已被许多学者证明,但构效关系仍需深入研究,是研究的重點和难点,所以多糖的结构仍然是研究热点。制备安全的低分子量多糖是发展趋势[14]。低分子量海带岩藻聚糖硫酸酯的制备,目前常采用的方法有自由基降解法、酶解法、酸降解法、碱降解法、超声波法等[15-20]。酸、碱降解法由于有残留,安全性存在问题,自由基法、酶解法和超声波法可应用于海洋药物的研发。目前,岩藻聚糖硫酸酯是海洋多糖药物研究中的热点之一。
本研究采用自由基降解法联合超声波降解法对岩藻聚糖硫酸酯进行降解,通过正交试验得出最优降解条件,并用电泳法对降解后多糖的分子量分布进行比较分析,以期为低分子量岩藻聚糖硫酸酯结构研究和产品开发提供试验支撑。
1 材料与方法
1.1 材料与试剂
海带,购于北海南珠市场;岩藻糖标准品,Sigma公司生产;乙醇、稀盐酸、浓硫酸、苯酚、明胶硫酸钡、过氧化氢、醋酸铜等均为国产分析纯。
1.2 仪器与设备
主要仪器设备有FW-100万能粉碎机、DHG-9037A型电热恒温鼓风干燥箱、AR224CN电子分析天平、UV-1800紫外分光光度计、Nicolet-Nexus 470红外分光光度计、Tanon EPS300电泳仪、ZL10-250C超声仪。
1.3 方法
1.3.1 岩藻聚糖硫酸酯的提取 采用水提醇沉的方法进行岩藻聚糖硫酸酯的提取,主要步骤:将海带清洗、烘干、粉碎后过筛,制成粉末;采用水提醇沉法(80 ℃热水提取,上清液用30%、60%、85%乙醇醇沉)用透析袋透析除去金属离子和盐;旋蒸浓缩后烘干,得到海带粗多糖GF0。
1.3.2 广西海域海带岩藻聚糖硫酸酯基本成分测定 (1)水分含量采用GB 5009.3—2010《食品安全国家标准 食品中水分的测定》中的直接干燥法进行测定。(2)蛋白质含量测定采用 GB 5009.5—2010 《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法。(3)脂肪含量测定采用GB/T 5009.6—2003《食品中脂肪的测定》中的索氏提取法。(4)总糖含量测定采用苯酚硫酸法[21],主要步骤:称取适量岩藻糖标准品,配成 1 mg/mL 的溶液,分别加水稀释制成0.12~0.20 mg/mL 不同浓度的标准溶液,并分别吸取一定量于试管中,加入等量6%苯酚溶液,摇匀后迅速加入5倍体积的浓硫酸,漩涡振荡混匀,室温放置0.5 h后于490 nm波长处测定其吸光度,并绘制标准曲线;将海带粗多糖样品配成0.1%溶液,按上述步骤测定。(5)岩藻糖含量的测定采用Gibbons比色法[22],具体方法:取岩藻糖标准溶液(100 μg/mL)0、0.1、0.3、0.5、0.7、0.9 mL,用蒸馏水定容至1.0 mL;冰水浴下加入4.5 mL 87%的浓硫酸,混匀;1 min后,沸水浴加热10 min,迅速冷却至室温,加入0.1 mL 3%的半胱氨酸盐酸盐,混匀,静置90 min后,在400 nm和430 nm处分别测定吸光度,并绘制标准曲线;配制0.1%的海带粗多糖溶液,取0.2 mL,测定吸光度,通过标准曲线计算岩藻糖含量。(6)硫酸根含量的测定采用明胶比浊法[23],具体方法:分别取标准硫酸钾溶液(0.35 mg/mL)0、0.5、1.0、1.5、2.0、2.5 mL,定容至3.0 mL,加0.2 mol/L稀盐酸3.8 mL,明胶硫酸钡 1 mL,混匀后静置30 min,在500 nm处测量吸光度。取海带粗多糖样品0.025 g,加0.2 mol/L稀盐酸 8 mL,密封水浴加热4 h后,冷却至室温,定容至 25 mL,配制成0.1%的样品,取1 mL测定吸光度。
1.3.3 基本结构测定 采用红外光谱法[24]测定海带粗多糖基本结构,用溴化钾研磨压片后,在 4 000~4 00 cm-1波长范围内进行光谱扫描。
1.3.4 自由基降解 采用自由基降解法[25]进行降解:取1 mL 20 mg/mL海带粗多糖,加入 0.026 7 mol/L 醋酸铜,保持pH值在7.5左右,60 ℃ 恒温加热条件下加 20 μL/h 的15% H2O2反应6 h。10 000 r/min离心30 min,除去大部分Cu2+,将pH值调至中性。
1.3.5 电泳法分析多糖的分子量分布 采用丙烯酰胺凝胶电泳(PAGE)法测定海带多糖的分子量分布。利用一定浓度的硼酸、Tris和乙二胺四乙酸(EDTA)配制外室缓冲液,甘氨酸、Tris配制内室缓冲液。丙烯酰胺、甲叉双丙烯酰胺和蔗糖用外室缓冲液配成15%分离胶和5%浓缩胶,脱气备用。电泳分析时电压为200 V,时间为30 min左右。用阿利新蓝染色30 min左右后,用乙酸脱色。根据硫酸软骨素标准品电泳距离计算出标准曲线。
1.3.6 超声法复合自由基降解法 取1 mL用“1.3.4”节中的方法降解过的多糖,分别以超声功率、温度、时间、pH值进行正交试验(表1)。DNS标准曲线法[26]:以还原糖释放量为降解指标,以葡萄糖为标准品,在520 nm的吸收光谱下测定吸光值。计算公式:还原糖释放量=降解后还原糖浓度-降解前还原糖浓度。将1 mg/mL海带粗多糖在不同的超声功率、时间、温度、pH值下进行正交试验。
2 结果与分析
2.1 基本成分测定结果
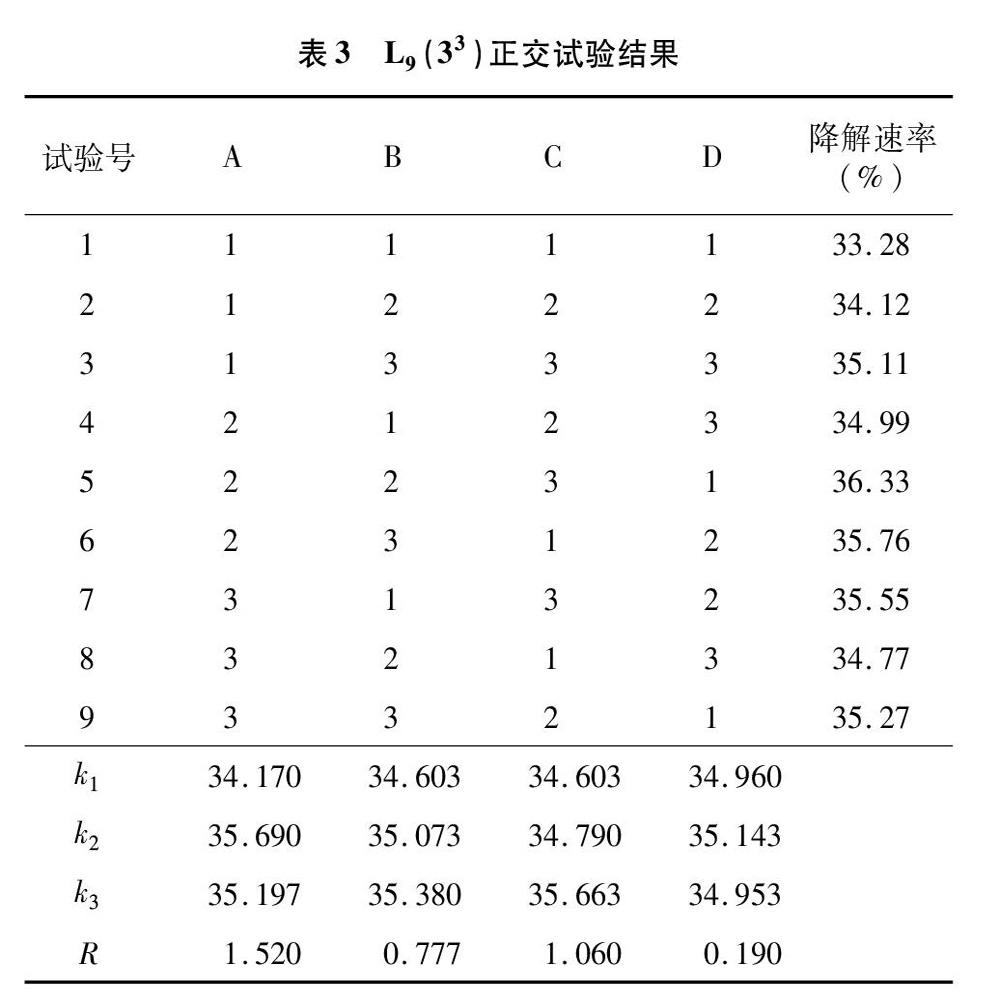
测得岩藻糖含量标准曲线为y=0.000 7x+0.000 3,r2=0.993 3;硫酸根含量标准曲线为y=2.776x+0.007,r2=0.999 2。经过计算,粗多糖的提取率为1.44%,岩藻糖占总糖含量的30.09%,硫酸根含量为38.21%(表2),说明广西海域海带岩藻聚糖硫酸酯硫酸根含量较高,具有很高的药用价值。
广西海域海带多糖与其他海域多糖结构相似。由图1可知,在3 000~2 800 cm-1处出现不同程度的振动吸收,2 936 cm-1处为C—H伸缩振动峰,是岩藻糖的甲基吸收峰,较弱;1 632 cm-1处出现的强吸收峰是N—H变角振动峰,1 417 cm-1处是C—O的伸缩振动峰,为吸收峰,说明有糖醛酸;1 259 cm-1 处是SO官能团的伸缩振动峰,是強吸收峰;C—O—S伸缩振动峰与多糖链上硫酸根的位置有关,是连接在岩藻糖C4位上的直立键硫酸根,818 cm-1左右出现的吸收峰表示该多糖的硫酸根连接在该糖的C2或C3上,属于α-D-半乳吡喃糖。
2.2 分子量计算
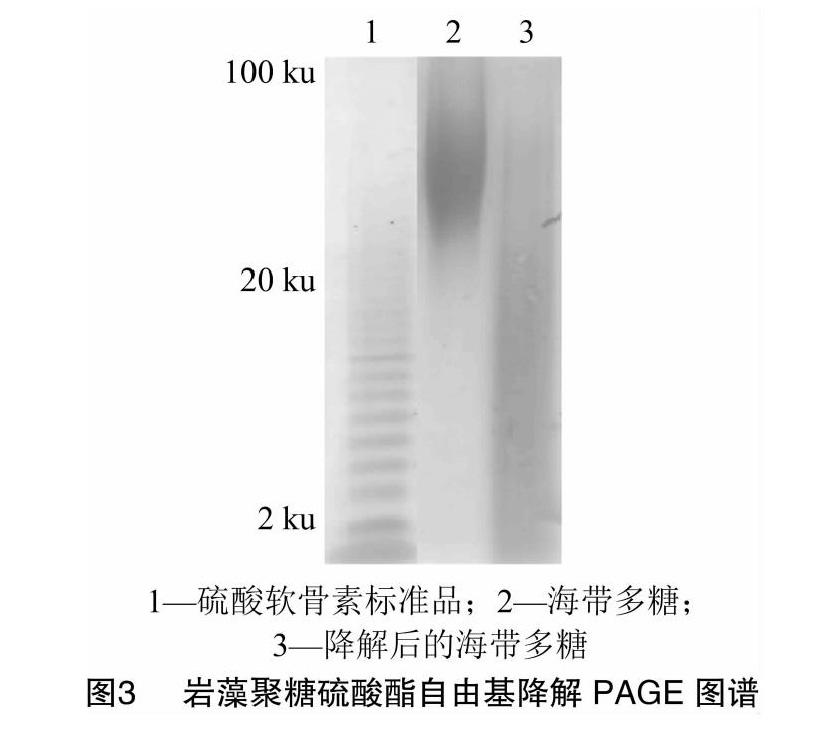
根据图2中硫酸软骨素分子量标准品计算分子量与移动距离之间的标准曲线,y=-0.000 9x+4.445 5,r2=0.997 9。通过计算,分子量为2~8 ku的硫酸软骨素,分子量与电泳距离呈线性关系。已知硫酸软骨素的分子量为14 ku,以标准品为对照,可估算得到,降解前硫酸多糖分子量为20~100 ku,降解后硫酸多糖的分子量小于20 ku(图3)。说明自由基氧化降解得到低分子量岩藻聚糖硫酸酯,产物主要是寡糖和分子量低于8 ku的低分子量组分,得到的是分子量分布比较广的杂多糖。
2.3 降解工艺优化结果
通过正交试验结果(表3)可知,影响降解的主次因素为超声功率>时间>温 度> pH值。可以看出,最佳配比为A2B3C3D2。当超声功率为 400 W,温度为60 ℃,时间为60 min,pH值为8.0时降解速率最佳。
3 讨论与结论
海带岩藻聚糖硫酸酯的分子量大且分布范围较广,糖组成复杂。大分子量的多糖在服用过程中会出现出血等副作用,因此,分析海带岩藻聚糖硫酸酯分子量大小对其功能型产品的开发及海带高值化利用具有重要意义。本试验对广西海域海带的基本成分进行确定,并用自由基降解法结合电泳法分析岩藻聚糖硫酸酯的分子量分布。结果表明,广西海域海带岩藻聚糖硫酸酯硫酸根含量较高。由于在一定范围内硫酸多糖的分子量与电泳距离呈线性关系, 采用离子交换PAGE凝胶电泳法分析分子量分布,利用0.026 7 mol/L醋酸铜,60 ℃恒温加热条件下,加20 μL/h的15% H2O2反应6 h后,采用联合超声法降解自由基,联合超声功率为 400 W,温度为60 ℃,时间为60 min,pH值为8.0时降解速率最佳。说明该方法简单、经济,能直观准确地反映多糖分子量的分布状况。自由基降解法联合超声降解法具有操作简单、降解速率快、无毒副作用等优点,得到的低分子量岩藻聚糖硫酸酯是分子量分布比较广的杂多糖。
参考文献:
[1]范 晓,韩丽君,郑乃余. 我国常见食用海藻的营养成分分析[J]. 中国海洋药物,1993,12(4):32-38.
[2]张彦民,李宝才,朱利平,等. 多糖化学及其生物活性研究进展[J]. 昆明理工大学学报(理工版),2003,28(3):140-145,149.
[3]Jiao G L,Yu G L,Zhang J Z,et al. Chemical structures and bioactivities of sulfated polysaccharides from marine algae[J]. Marine Drugs,2011,9(2):196-223.
[4]Vo T S,Kim S K. Fucidans as a natural biosctive ingredient for functional foods[J]. Journal of Functional Foods,2013,5(1):16-27.
[5]Ermakova S,Kusaykin M,Trincone A,et al. Are multifunctional marine polysaccharides a myth or reality?[J]Front Chem,2015,3:39.
[6]纪明侯. 海藻化学[M]. 北京:科学出版社,1997:318-319.
[7]Alban S,Franz G. Characterization of the anticoagulant actions of a semisynthetic curdlan sulfate[J]. Thromb Research,2000,99(4):377-388.
[8]Wang J,Zhang Q B,Jin W H,et al. Effects and mechanism of low molecular weight fucoidan in mitigating the peroxidative and renal damage induced by ademine[J]. Carbohydrate Polymers,2011,84(1):417-423.
[9]Wang J,Wang F,Yun H,et al. Effect and mechanism of fucoidan derivatives from Laminaria japonica in experimental adenine-induced chronic kidney disease[J]. Journal of Ethnopharmacology,2012,139(3):807-813.
[10]Wu Y N,Ye M,Du Z Z,et al. Carboxymethylation of an exopolysaccharide from Lachnum and effect of its derivatives on experimental chronic renal failure[J]. Carbohydrate Polymers,2014,114:190-195.
[11]Nagamine T,Nakazato K,Tominoka S,et al. Intestinal absorption of fucoidan extracted from the brown seaweed,Cladosiphon okamuranus[J]. Marine Drugs,2014,13(1):48-64.
[12]曲桂燕. 5种褐藻岩藻聚糖硫酸酯提取纯化及其功能活性的比较研究[D]. 青岛:中国海洋大学,2013:19-25.
[13]李 芳. 不同分子量海带岩藻聚糖硫酸酯消化吸收、免疫及抗病毒活性的比较研究[D]. 青岛:中国海洋大学,2012:28-29.
[14]孙 华,张彦昊,张 翔,等. 普鲁兰多糖在食品保鲜和生物医学中的应用综述[J]. 江苏农业科学,2019,47(20):48-52.
[15]陈亚静,王维民,谌素华,等. 马尾藻岩藻聚糖硫酸酯降解工艺的研究[J]. 食品工业科技,2012,33(20):284-287.
[16]Zhang Q B,Qi H M,Zhao T T,et al. Chemical characteristics of polysaccharide from Porphyra capensis(Rhodophyta)[J]. Carbohydrate Research,2005,340(15):2447-2450.
[17]Li B,Lu F,Wei X,et al. Fucoidans structure and bioactivity[J]. Molecules,2008,13(8):1671-1695.
[18]Cumashi A,Ushakova N A,Preobrazbenskaya M E,et al. A comparative study of the anti-inflammatory,anticoagulant,antiangiogenic,and antiadhesive activities of nine different fucoidans from brown seaweeds[J]. Glycobiology,2007,17(5):522-541.
[19]Wijesinghe W,Jeon Y J. Biological activities and potential industrial applications of fucose rich sulfated polysaccharides and fucoidans isolated from brown seaweeds:a review[J]. Carbohydrate Polymers,2012,88(1):13-20.
[20]Kwak J Y. Fucoidan as a Marine anticancer agent in preclinical development[J]. Marine Drugs,2014,12(2):851-870.
[21]張惟杰. 糖复合物生化研究技术[M]. 杭州:浙江人民出版社,1994:56-78.
[22]Gibbons M N. The determination of methylepentoses[J]. Analyst,1955,80:268-276.
[23]Dodgson K S,Price R G. A note on the determination of the ester sulphate content of sulphated polysaccharides[J]. Biochemical Journal,1962,84(1):106-110.
[24]嵇国利,于广利,吴建东,等. 暴发期条浒苔多糖的提取分离及其理化性质研究[J]. 中国海洋药物,2009,28(3):7-12.
[25]Chen R H,Chang J R,Shyur J S. Effects of ultrasonic conditions and storage in acidicsolutions on changes in molecular weight and polydisperity of treated chitosan[J]. Carbohydrate Research,1997,299(4):287-294.
[26]胡锡阶,肖建辉,肖 瑜,等. 3,5-二硝基水杨酸比色法定糖的条件优化[J]. 遵义医学院学报,2005,28(1):9-11.赵 丽,农蕊瑜,师 真,等. 分散固相萃取-气相色谱-质谱联用测定茶叶中的28种农药残留[J]. 江苏农业科学,2020,48(12):208-215.

