热损伤计量相关方法研究进展
蒋徽豪 张国安
(北京大学第四临床医学院,北京积水潭医院,北京 100035)
热损伤(thermal injury)是机体接触高温物体、热辐射源或是因体温异常而导致的损伤。热损伤不仅与烧伤、热射病等疾病相关,其相关概念也被应用于热疗、消融等治疗及其安全范围界定。因而,热损伤的计量方式是多学科研究的重点之一。目前,以温度等效时间[如累计等效43 ℃加热时间(cumulative equivalent minutes at 43 ℃,CEM43 ℃)]为代表的等效剂量法已被广泛应用于肿瘤热疗领域[1],但在其他领域的推广仍在进行之中。本文对热损伤相关指标及其在不同组织、不同研究方式中的研究进展综述如下。
1 热损伤的常用指标
1.1 等效剂量法测定的指标 早期,对于热损伤的描述曾使用单一变量,如仅描述加热温度,而不考虑其他变量。后基于对高热导致的肿瘤缩小现象,Henriques 等[2]认为生物化学反应类似简单物质的基元化学反应,其反应速率k 满足阿伦尼乌斯方程,即速率k 与温度T 呈指数关系,如下式:
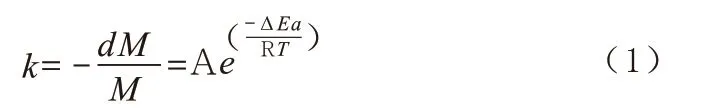
其中k 为化学反应速率,dM、M 分别为损伤(即已经发生反应)以及反应前总共的组织细胞或分子浓度,A 为相关系数,e 为自然对数的底,为该反应的活化能,R 为通用气体常数,T 为组织温度。Dewhrist 等[3]以此为基础,经过研究建立了以CEM43 ℃为代表的等效剂量法。该方法认为细胞热损伤是以温度为单一限速因素,从而以公式(1)的阿伦尼乌斯方程为基础,以持续在某个温度加热某段时间长度的组织或细胞为对象,转换为等效于43 ℃下的加热时间,其计算式如下:

其中,CEM43℃为累计等效43 ℃加热时间,t 为实验对象加热时间,R 为转换系数,T 为实验对象加热温度。其理论基础为体外细胞加热实验,Dewhirst 等[3]总结中国仓鼠卵巢细胞、人黑色素瘤细胞的体外加热实验,发现其在42 ℃及以下温度加热时细胞生存率不随时间延长降低,而升至42 ℃以上后生存率即随时间延长而下降;对人、鼠的多种细胞系进一步实验均发现,随着温度上升,细胞生存率的变化会出现明显单一的拐点(多为42 ~43 ℃);在此拐点之上,用不同加热温度及时间组合对在体动物组织进行加热,研究不同温度下造成相同程度损伤所需时间,实验数据显示温度与对数转换后的时间呈线性关系,由此建立了公式(2)这一等效公式,用以在某个组织或细胞中将不同加热温度与时间合并,视作43 ℃下加热达到相同效应所需的等效时间,从而简化研究标准、利于相互比较;其中的转换系数由研究与经验共同决定。后续的研究也多证实了在不同组织部位的应用,以及在临床肿瘤热疗之中的可靠性[4-5]。而随着研究发展,不同组织的转换系数取值却相同,无法体现不同血流灌注、不同散热组织的区别,依赖实验对象内部温度均一相同的假设,以及肿瘤的放化疗联合下对热疗结果的影响,使得其无法良好预测临床结果,也难以指导热损伤的进一步研究[4,6]。可能是出于发展肿瘤热疗的目的,此类研究多集中于43 ~55 ℃、数分钟至数小时的较低温度加热、较长时间的热损伤现象研究,而将其应用在60 ℃以上的较高温度、或是数秒的较短时间时,实验与计算结果出现明显的不同[7]。
1.2 损伤指数法测定的指标 与等效剂量法转化、描述加热时间相反,损伤指数法直接测量的是加热前后存活细胞数量,其推算式也是以温度为单一限速因素的阿伦尼乌斯方程为基础,认为存活细胞数之比的对数与加热温度、时间呈对数关系[1]:
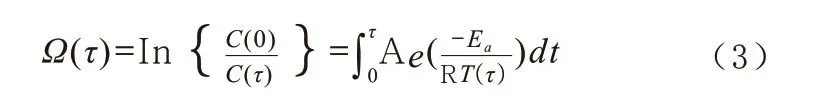
上式中,Ω 为损伤指数,C(0)和C(τ)分别为加热前以及加热到τ 时刻存活细胞数;后半部分即为τ 时刻的推算,A 是一个频率系数,R 为通用气体常数,T 为绝对温度,t为加热时长。经Viglianti 等[1]计算,公式(1)与公式(2)可相互转化;损伤指数描述的为存活细胞的比例,难以用于指导临床治疗的实施而较少使用,多见于消融治疗的疗效评价,本文不再深入介绍。
2 组织与细胞的热损伤计量
在证明特定温度范围内热损伤的等效效应之后,大量研究进一步探讨了不同器官、不同组织的热损伤。有学者曾对其进行总结分类,按照CEM43 ℃大小、实验物种、离体还是在体、观察时间等区别,归纳此类研究下脑、骨髓、肌肉、神经、乳腺、肝脏、肾脏、食管等不同组织器官的热损伤在血管通透性、细胞损伤等方面的差异,证明不同器官、甚至相同器官内的不同组织对热损伤的耐受不同,同时也指出了多数实验仅能测量表面温度、内部热能分布不均、加热程度或时间较短等不足[5,8-11]。
局部及全身的热疗被广泛用于肿瘤的辅助治疗,并取得了较好的临床效果[12-13]。传统的热水浴依旧被用于实验加热、模拟较低温度的热疗以及较高温度的消融[7,14],而临床除热水以外,还多用射频、微波、超声及激光光纤等方式进行热疗或消融[15-16],而射频及微波因加热装置多使用探针结构,故而出现了随距离增加热能明显衰减的现象[15]。近来核磁共振联合金属纳米颗粒用于加热受到重视,其通过外源交变磁场来加热通过静脉或局部注射而放置的金属颗粒,被认为是一种对肿瘤组织选择性高、操作更精细的方法,但其安全性、温度维持、操作可重复等应用问题仍在研究中[6,13,17]。在烧伤研究领域,多用热水、加热后的金属等物体来模拟短时间高温度暴露,用碳弧、电火花引燃金属镁等方法模拟上千摄氏度的高温暴露[18]。虽然在近年出现了一定程度的质疑和争论,上述大多数加热方法仍使用CEM43 ℃及其延伸出的CEM43 ℃T90,以及按照某个实验中、不同探测位置的平均升温与作用时间的乘积进行加总、再除以总的作用时间的热计量-效应参数TRISE 等参数作为热计量[4,13,15,17],而高温短时间的部分烧伤及消融实验则多以温度与时间进行描述[16,18]。
细胞的热损伤与耐热机制也得到了进一步的研究,热休克蛋白(heat shock protein,HSP)家族被认为从维持细胞膜稳定、维护转录翻译稳定、启动DNA 修复酶等方面在热耐受中起到重要作用,并进一步被延伸到紫外线照射、辐射等多种应激场景[19-20]。
3 不同测温方法的发展
随着CEM43 ℃在肿瘤治疗领域日益广泛的应用,对加热控制的重要性也日益显著。研究重点之一即为不同的温度测量方法。在这一方向上,有些研究偏重于加强对实验数据的采集,例如对热疗持续加热期间的对象反复采集温度数据,以第90 百分位数的数据作为指标的CEM43 ℃T90,或是以实际热疗的时间、升温乘积与总体治疗时间比值的TRISE[4];也有研究偏重于增加侵入性的传感器数量,以热电偶、热电阻多见[9],以期能更准确地描述实验对象内温度的分布、实际温度的变化,如Bakker 等[21]为了减少热疗中烫伤的发生,就通过实验来探讨在乳腺癌热疗中所需最少的传感器数量,其实验以乳腺癌初始放疗合并热疗、发生复发、且初始热疗时热电偶传感器数目超过60 个的患者为基础,将复发患者随机分配至不同亚组,在再次热疗中使用不同数目的热传感器,以比较两次热疗之中使用不同数量传感器时读取温度数据的区别,结论是推荐传感器应超过50个/400 cm2,但未能明确证明复发前后肿瘤的一致性。侵入性的设备除了传统的热电偶、热电阻外,光纤测量也被用于热测量领域,通过测量其发射光线的衰减来测量温度,因其化学性质稳定、不易受其他加热方法影响、操作相对简单而受重视,但也仅能用于侵入性的局部测量[9,15]。
同样的研究方向上,也有学者着重于寻找不同的温度测量方法。核磁共振(MRI)已被证实是适于不同组织、不同治疗过程的热测量的可靠标准[9,22],Rieke 等[23]曾总结了其在热测量之中的应用。这种方法由于测量对象氢原子广泛存在、可观察物体内部且又多为非侵入性而受到重视。总结从T1 及T2 弛豫时间等常用指标、到温度敏感对比剂等,可实现温度绝对值及参考标定的相对值的较为精确的测量;但因精度与测量时间呈相反关系,实时反馈未能实际实现,而且还存在其他的缺陷,如存在组织特异性,校准难度较大,成本高昂,操作较复杂等。
微波辐射、红外线测量作为测量不同频率热辐射的方法,因其快捷、安全、创伤少、测量面积大,在非侵入性的浅表面及表面温度测量方面有着较多的研究,但存在测量需要良好的参照与校准程序、测得数据仍需复杂算法运算、仅能局限于物体表面温度测量等缺陷[9,24-26]。
超声通过对声学参数受热影响的变化,也可间接测定温度变化,但温度变化与测量结果不呈线性关系、数据处理较为复杂,且限于50 ℃以下的相对温度变化、需要校准比对,而且需要考虑射频等加热方法对于测量的干扰[9,26]。
热物理及工程等学科也在生物热测量领域有研究,其重点在于生物传热模型的建构、生物组织热物性参数的测量及测量方法,以及生物体三维温度场的无损重构[27]。生物传热模型的突出代表为20 世纪60 年代Pennes 等提出的圆筒型径向温度分布的热传导模型,虽然仍假定对象的各物理参数分布均匀一致,但除温度差外还考虑了血液灌注、生物代谢而增加、交换的热量,被广泛接受和应用[2,18,28-30],并且出现了许多延伸公式[27,31-32],从而以热量、传热为基础,结合热弥散系数、热导率、比热容等热力学物理参数[33],对特定参数进行测量,或是计算温度场以估计实验对象内温度随空间及时间的变化。这些物理性质可以进一步利用,如模拟皮肤烧伤过程时,Dewhirst 等[3]将其用于计算不同深度、温度与时间下的皮肤烧伤损伤程度、细胞坏死率;而Abraham 等[8]则相反,利用不同组织层次的热物性,设定不同温度来计算皮肤烧伤达特定深度所需时间,两者都以阿伦尼乌斯方程为基础的CEM43 ℃计算,并得出相接近的结果。Wan 等[34]则用以论证气道之中的散热及保护方式。也有将其综合、推导温度场分布,并以热红外成像[29]或温度传感器[30]进行验证,证明其能够实时反映温度场随空间及时间变化,可能应用于指导热疗或消融。
而在实用方面,中国标准研究中心与机械工业部机械科学研究院早在2000 年就以欧洲推出的机械表面安全温度标准为参考,推出了我国的机械表面可接触安全温度的标准,以避免皮肤烧伤[35],其中,接触温度、接触时间以及接触材料都被认为是重要指标。例如,当接触时间在1 ~10 s 时,该标准列出的皮肤接触不同材料、不引起烧伤的温度阈值不同,皮肤与裸露金属等热导率高的材料接触的不烧伤阈值在60 ~70 ℃,与涂层金属、陶瓷、塑料等材料接触的安全阈值在70 ~90 ℃,而与导热性差的木材接触安全阈值能在90 ~130 ℃,提示热量传导等热物理性质也对生物的热耐受有明显影响。
4 总 结
综上所述,以等效剂量法为基础的CEM43 ℃是目前热损伤的重要计量指标。在其理论提出后,该指标被逐步证实适用于不同组织器官,引导了多种肿瘤热疗工具与部分消融治疗的研究,并延伸出了许多参数。热损伤的监测工具技术及其热物理工程也仍以CEM43 ℃、或其密切相关的温度-时间关系为基础发展。但在以烧伤为代表的高温短时间加热的领域内,仍以温度-时间的组合居多,而CEM43 ℃的应用仅有初步研究,尚未能得到广泛认可。热物理方向的研究与建模在皮肤烧伤分层的模型、气道高温损伤的模型等复杂场景有了一定的建树,但在解释热损伤过程、机体保护机制、预测损伤程度等方面仍有待发展。

