细粒棘球绦虫Eg10诱导树突状细胞产生Th2免疫反应
王娅娜,王 婵,王 双
细粒棘球绦虫病又称包虫病,是一种人兽共患寄生虫病,在我国的中西部畜牧业地区流行较广[1]。2017年在四川成都市召开了全国包虫病防控技术研讨会,互相交流包虫病的防控经验,希望尽快找出对包虫病有效的防控措施。人们一直对疫苗防控包虫病给予厚望[2-3],虽然已经发现一些包虫疫苗候选分子,但是目前尚无一种疫苗推广应用。主要原因是由于包虫虫体发育阶段多(包括六钩蚴、细粒棘球蚴、成虫、虫卵),虫体体积大,成分复杂,以及人们对包虫疫苗诱导机体的免疫感染机制不明确所致。前期研究发现抗原Eg10能够诱导小鼠产生特异性抗体[4],但在免疫小鼠后进行攻击感染的实验中,小鼠体内包囊数目及体积均高于对照组[5]。为了探究原因,通过体外培养DC,模拟疫苗进入机体,对抗原提呈细胞捕获抗原这一过程进行研究。
1 材料与方法
1.1材料 6~8周C57BL/ 6雄鼠购自宁夏医科大学实验动物中心。包虫囊液(hydatid fluid HF)取自宁夏医科大学附属医院外科手术的包虫病患者,术中无菌从包囊中抽取,分装、冻存于-20 ℃。重组表达菌株Eg10/pET28a/BL21由宁夏医科大学科学技术研究中心包虫病实验室提供。
1.2主要试剂 Triton114及红细胞裂解液购自Solarbio;RPMI1640、1%的青霉素和链霉素购自美国Gibico公司;胎牛血清、PBS购自美国Hyclone公司; LPS(Escherichiacolistrain 0111:B4)、FITC-dextran、蛋白酶抑制剂苯甲基磺酰氟(PMSF)购自美国Sigma公司;丝裂霉素C购自德国Merk公司;荧光染料羧基荧光素双乙酸盐,琥珀酰亚胺酯(CFSE)购自美国Introvgen公司;IPTG、甲叉双丙烯酰胺、丙烯酰胺购自Promega 公司;蛋白、酵母提取物购自OXOID 公司;考马斯亮兰购自BIOMOL 公司;L-谷氨酰胺、β-巯基乙醇、咪唑购自Amersco公司;蛋白纯化树脂购自Roche公司;Mouse IL-6、Mouse IL-10、Mouse IFN-γ、Mouse IL-12p70ELISA 检测试剂盒购自杭州联科生物;anti-mouse CD11c-PE、anti-mouse CD80-FITC、anti-mouse CD40-PE-Cyanin5、anti-mouse MHCII-PE-cyanin5、anti-mouse CD86-FITC、IL-4、巨噬细胞粒细胞集落刺激因子(GM-CSF)、Treg细胞检测试剂盒购自eBioscience;CD4+T-FITC磁珠提取试剂盒购自Miltenyi公司;内毒素检测试剂盒ToxinSensorTM Chromogenic LAL Endotoxin Assay Kit购自Genescript公司;细胞培养板12孔、24孔、96孔购自Corning公司;其它化学试剂为国产分析纯。
1.3 方 法
1.3.1抗原的纯化 按照罗氏亲和层析法说明书,Ni2+亲和层析纯化Eg10。因细胞培养中加入的蛋白为无菌的可溶性蛋白,因此对Eg10和HF进行0.45 μm过滤除菌、BSA定量及内毒素检测。
1.3.2小鼠BMDC的获取及培养 C57BL/6 6~8 w 2只雄鼠采用颈椎脱臼处死,无菌获取股、胫骨的骨髓细胞。红细胞裂解4~7 min,离心1 000 r/min,弃上清,计数。用含10% 胎牛血清(fetal bovine serum FBS),50 μmol/L β-巯基乙醇,2 mmol/L谷氨酰胺,5 ng/mL IL-4,10 ng/mL GM-CSF培养基调整细胞浓度,按2×106/mL接种到12孔细胞培养板中,37 ℃,5% CO2培养,于3 d、5 d进行半量换,补充IL-4及GM-CSF的量。培养至第7 d,收集BMDC。
1.3.3Eg10致敏DC的浓度及时间的优化 收集第7 d的BMDC,用不含GM-CSF、IL-4的10% FBS培养液稀释至1×106/mL,接种24孔细胞培养板中,分别用Eg10 0.1 μg、1 μg、10 μg的浓度致敏DC,同时观察不同浓度下致敏DC在6 h、20 h、48 h表面分子表达情况,从而筛选出最佳浓度及最佳时间。
1.3.4BMDC的分组 收集第7 d的BMDC,用不含GM-CSF、IL-4的10% FBS培养液稀释至1×106/mL,接种24孔细胞培养板中,分6组。 HF组为阴性对照组(加入HF 30 μg/mL)、Eg10组(加入抗原Eg10 1 μg/mL)、LPS阳性对照组(加入LPS 100 ng/mL)、RPMI 1640为control组,37 ℃,5% CO2培养20 h;联合组Eg10+LPS组(加入抗原Eg10 1 μg/mL和 LPS 100 ng/mL)和HF+LPS组(加入HF 30 μg/mL和 LPS 100 ng/mL),先加入Eg10或HF 37 ℃,5% CO2培养20 h后,再加入LPS培养20 h。
1.3.5BMDC细胞表面分子的检测 收集第7 d的各组DC,分别加各组表面分子抗体anti-mouse MHCⅡ-PE-Cy5、anti-mouse CD80-FITC、anti-mouse CD11c-PE、anti-CD40-PE-cy5、anti-mouse CD86-FITC,加入含2%PFA500 μL,设立空白对照,4 ℃,避光,30 min,Guava流式细胞仪检测BMDC表面分子表达。每个样本检测细胞不少于1×104。
1.3.6 形态学观察
1.3.6.1扫描电镜的观察 DC的表面形态培养第7 d,收集各组DC,取1×105的DC制备爬片,37 ℃培养20 h,2.5%戊二醛固定1 h,1%锇酸再固定0.5 h,30%~100%乙醇梯度脱水,加入叔丁醇,真空泵干燥处理,真空离子喷镀铂金膜,扫描电镜日立S-3400N观察各组DCs的表面形态。各组随机视野选100个DC,统计细胞表面有突起的细胞和无突起的细胞数量进行比较(突起<3记为无突起)。再从各组DC表面含有突起细胞中随机选20个,对突起的数目计数。
1.3.6.2透射电镜观察BMDC的超微结构 培养第7 d,各组收集DC 3×106,离心1 000 r/min,10 min,弃上清,迅速加入2.5% 戊二醛固定2 h,PBS洗涤3 次,每次10 min,用1% 锇酸后固定1 h,PBS洗涤2 次,每次10 min,30%~100%乙醇梯度脱水,每次10 min,再用环氧丙烷置换2 次,每次0.5 h,最后用环氧树脂618包埋,Leica UC7型超薄切片机切片,醋酸铀-枸橼酸铅染色,透射电镜日立H-7650B观察DC的超微结构。
1.3.7吞噬能力测定培养 第7 d,收集各组DC,加入右旋多糖FITC-dextran (40 kDa 1 mg/mL),37℃孵育1 h,1 000 r/min离心,加入2% PFA 500 μL,流式细胞仪检测各组DCs吞噬FITC-dextran的含量。结果重复3次,每个样本检测细胞不少于1×104。吞噬能力的强弱通过FITC荧光强度来反应。
1.3.8 T细胞增殖能力测定
1.3.8.1CD4+T 细胞的获取及标记 C57 BL/6小鼠6~8 w脱颈处死,无菌条件取脾脏,制备脾细胞悬液,裂解红细胞,按照CD4+磁珠说明书,获取CD4+T细胞,1×107细胞加入CFSE(2.5~5 μmol/L),37 ℃避光,15 min,终止反应用预冷的FBS,10% FBS洗2 次。
1.3.8.2同种异体混合淋巴细胞培养 DC作为刺激细胞2×105加入丝裂霉素C(25 μg/ mL)37 ℃,处理30 min,CD4+T细胞为效应细胞,DC:CD4+T(按1∶10、1∶20、1∶50不同比例)培养,每孔终体积达200 μL,每样本设复孔,在37 ℃,5% CO2培养5 d,流式细胞仪检测,以出现在背景荧光之前区域的荧光强度反应T细胞的增殖能力,实验重复3次。
1.3.8.3Treg细胞的含量按DC与CD4+T 1∶10进行培养5 d,通过Treg细胞检测试剂盒,流式细胞仪检测不同组中Treg细胞的含量(方法按照Mouse Regulatory T Cell Staining Kit #3)
1.3.9各组DC迁移能力的检测 培养第7 d,收集各组DC,RPMI 1640洗2 次,除去血清白蛋白,按比例加入CFSE(终浓度为2.5~5 μmol/L),混匀,37 ℃避光15 min,每5 min振荡1次,然后用预冷的FBS终止反应,37 ℃,5 min,1 200 r/min, 10 min,用含10% FBS洗2次,细胞计数2×105,注射小鼠足垫,48 h后,通过Cri Maestro小动物活体成像系统观察DC的迁移能力,对不同组小鼠选取相同的感兴趣区域ROI(Region Of Interest),进行荧光平均强度的比较。实验重复4次,结果取平均值。
1.3.10细胞因子的检测 培养第7 d,收集各组DCs的培养上清液,按照小鼠细胞因子IL-12p70,TNF-α、IL-6、IL-10试剂盒说明书,通过酶联免疫吸附实验检测上清液中各因子的含量,每个样本设立3个复孔,通过双波长570 nm和630 nm进行检测。
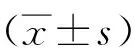
2 结 果
2.1经过Ni+亲和层析柱可以纯化出1条约31 kD的蛋白条带(图1)。

1:protein marker; 2:Eg10图1 Eg10 Fig.1 Eg10 protien
2.2Eg10对DC致敏条件优化 实验中发现Eg10在浓度为1 μg/mL时致敏DC,DC表面分子MHCII, CD80,CD86的表达均与 0.1 μg和10 μg两个浓度相比轻微上提,无统计学差异(t=0.80、1.72、0.92、1.93、0.53、1.83,P均>0.05),见图2A, 对于Eg10作用DC不同时间点比较发现,20 h组DC各表面分子均高于6 h和48 h组(t=4.09、7.48、6.12、8.76、7.37、3.08、2.09、4.87、5.9、1.88,P均<0.05)图2B,之后实验都采用Eg10 1 μg/mL致敏DC 20 h。

A.Eg10致敏DC的浓度优化;B.Eg10致敏DC的时间优化图2 Eg10致敏DC调节的优化Fig.2 Optimizing the conditions of DCs stimulated with Eg10
2.3DC表面分子表达 显示HF组和Eg10组的表面分子CD80和CD40均与control组相比,无统计学差异(t=1.34、1.53、1.10、1.93,P均>0.05)。但是Eg10 的CD86的表达量高于其它组。各组DC先受到Eg10或HF的作用后,又加入LPS联合刺激,显示Eg10+ LPS和HF+LPS的DC表面分子表达量均不同程度的变化,尤以Eg10组显著,MHCII和CD40提高,CD86的表达却降低(表1)。

表1 各组DC表面分子表达%Tab.1 Fluorescence intensities for expression of surface molecular of DC stimulated with different antigens/%
2.4DC吞噬能力测定 发现Eg10组的吞噬FITC-dextran的能力高于其它各组, 除HF组均有统计学差异(t=3.16、10.56、3.87、8.18,P均<0.05),联合组中由于LPS加入,将Eg10的吞噬能力从25.06%降到18.21%,而对HF的影响更为明显从21.785降到10.58%(图3)。
2.5DC形态学变化 扫描电镜观察各组DC发现Eg10和HF组DC与control组相比,体积稍微增大,细胞表面褶皱增多,但是未见明显的表面突起。说明Eg10和HF这两种抗原均不能有效刺激DC成熟,LPS组DC呈现出成熟形态,表面褶皱明显增多,突起清晰可见。在联合组中通过LPS的加入DC表面呈现出不同的形态,体积拉长为梭形,Eg10+LPS组尤为明显,并且可以观察到细胞表面有突起产生(图4-A)。各组随机观察100个细胞,并对细胞是否有表面突起进行计数,结果LPS阳性组表面突起数目占细胞百分比达到90%,HF、Eg10与control组之间无统计学差异(t=1.29、1.76,P均>0.05)。LPS的加入Eg10和HF组可以促进DC表面突起显著增多,从18%和21%上提至61%和73%(表2)。同时对各组中含有突起的细胞的突起计数。结果与之前描述一致。LPS的加入不仅能够促进更多的DC表面产生突起,还可以促进突起数目和长度的增加(表3)。进一步通过透射电镜对各组DC的超微结构进行观察,发现Eg10组细胞内的囊泡(vacuolesV)增多,线粒体mitochondria M) 体积增大,略肿胀,电子致密度变浅,同时与LPS组相比,粗面内质网(rough endoplasmic reticulum RER)的含量明显减少, 而且排列无规则。LPS组可以观察到RER数目非常多,靠近细胞膜成排排列(图4-B)。

注:红色反应的是吞噬FITC 右旋多糖的能力, 绿色反应的是背景荧光图3 各组DC吞噬能力的测定Fig.3 Phayocyticability in different DCs group

A. 扫描电镜观察不同组DC的形态 B.透射电镜观察不同组DC的超微结构图4 电子显微镜观察不同组DC的形态Fig.4 Morphology of different groups of DCs observed by electronic microscope

表2 不同组含有树突的DC与不含树突的DC数目的比较(每组随机选100个DC)Tab.2 Number of DCs with dendrite and the number of DCswithout dendrite of different group comparantive (random selection 100 DCs in each group)
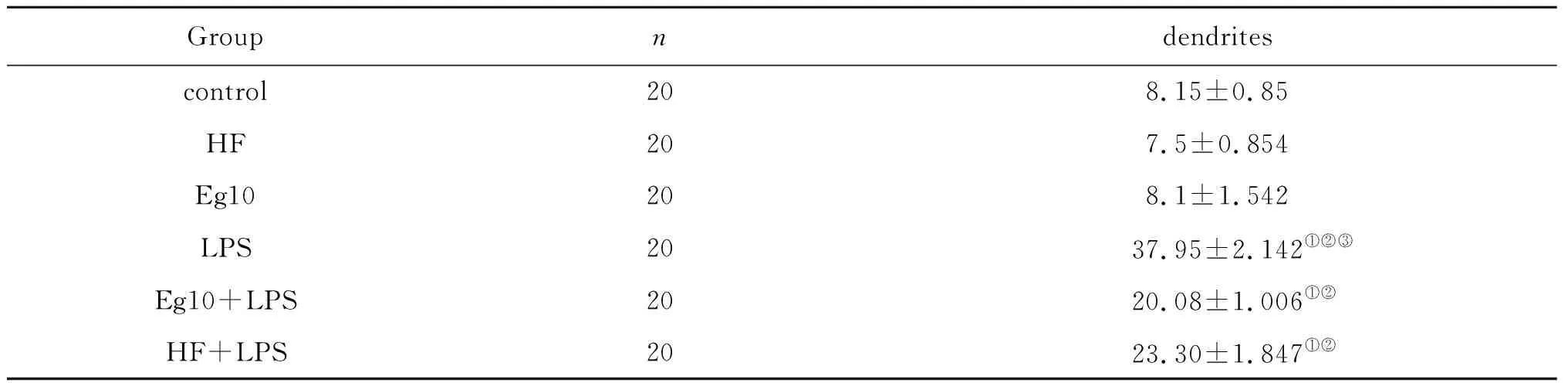
表3 各组含树突的DC平均所含毛刺的数目比较(每组选取20个DC)Tab.3 DC with dendrites of different groupscomparative each other (selection 20 DC with dendrites in each group)
2.5T细胞增殖能力的测定 各组DC与T细胞均在1∶10的比例下能促进T细胞增殖。 HF与Eg10组无统计学差异,刺激T细胞增殖能力较弱,显著低于LPS组,高于control组(图5-A B)。通过流式检测T细胞中Treg的含量发现,Eg10组的Treg的数目增加,HF组与control组无差异。LPS组略低于control组,也无统计学差异(图5-C)。

A. DC与T细胞不同比例下,各组T细胞的增殖情况 B. 在1∶10的比例下各组T细胞的增殖能力 C. Treg在CD4+T细胞中所占比例图5 各组DC对T细胞增殖能力的检测及Treg细胞的含量检测Fig.5 Effect of differentiated DCs on T-cell proliferation and Treg cell
2.6各组DC细胞在体内的迁移发现HF组和Eg10组并未见到体内有特异性荧光区域,只有注射了荧光标记细胞的脚垫上存在。除脚垫外的绿色荧光均为皮毛产生的非特异性荧光(图6-A)。与对照组的ROI的荧光强度无差异(图6-B)。

A. 不同组小鼠DC迁移能力的检测;B. 感兴趣区域的平均荧光强度的比较图6 DC的迁移Fig.6 Migration of DC stimulated with different antigen
2.7各组DC上清中细胞因子含量的测定 HF组分泌大量IL-6和少量的IL-10;不分泌IL-12p70;与LPS联合刺激,IL-6、IL-12p70和TNF-α的表达量均有提高,IL-10的表达量则下降。 Eg10组分泌的IL-10的表达量高于其它各组(t=12.32、10.83、9.26、7.80、12.26,P均<0.05); IL-6的表达量与HF组之间无差异(t=2.035,P>0.05);IL-12p70与TNF-α 的分泌量高于control组(t=3.93、3.19、3.14、3.42,P均<0.05)和HF组;加入LPS联合刺激,IL-6及IL-10的表达量均下降,与之相反TNF-α 的表达量则显著增高与HF+LPS组无差异, 而IL-12 p70 的分泌量变化不明显(图7)。
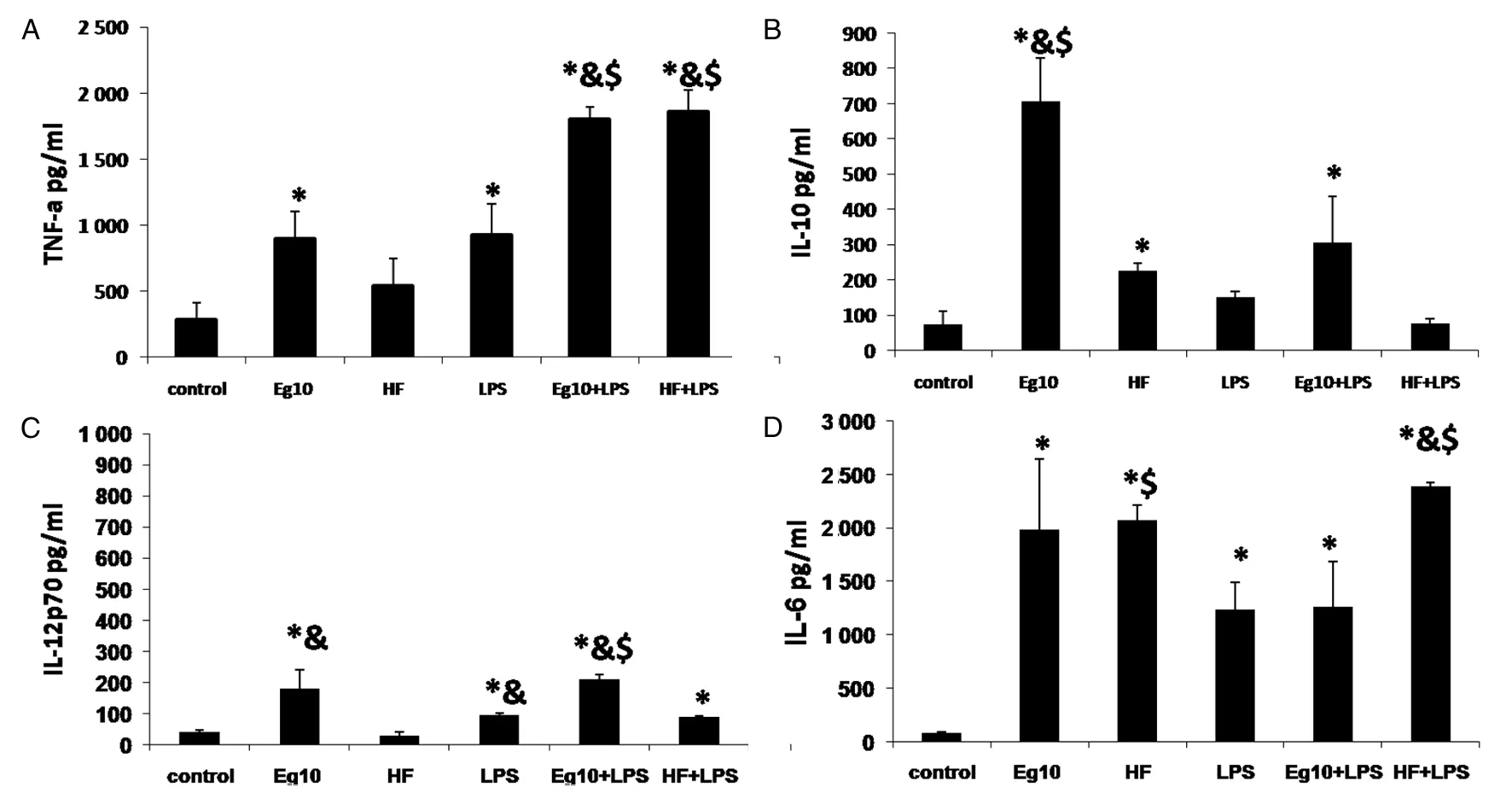
A. The level of TNF-α in supernatants of DCs B. The level of IL-10 in supernatants of DCs C. The level of 12p70 in supernatants of DCs D. The level of IL-6 in supernatants of DCs‘*’P<0.05, vs. control group;‘&’ P<0.05,vs. HF group;‘$’ P<0.05vs.LPS group;图7 各组培养DC的上清中细胞因子的含量Fig.7 Expression of cytokines in DCs stimulated with different antigens
3 讨 论
当寄生虫或寄生虫疫苗进入机体,最先捕获它们的是DC。DC是目前所知的功能最强大的抗原提呈细胞,在白细胞中所占比例很小。它是连接机体固有免疫和获得性免疫的桥梁,能很好的平衡免疫耐受和炎症反应[6-7]。研究发现无论宿主是鼠还是人,寄生虫或寄生虫的标志性分子均能直接诱导DC产生免疫反应[8]。本研究就采用了细粒棘球绦虫虫体自身抗原Eg10和囊液混合抗原HF,观察他们诱导DC产生的免疫应答反应。
Eg10是由559 个氨基酸残基组成,位于原头节表面的一种亲水性蛋白,与多房棘球绦虫10具有98.6%的高度同源性[9],并且与参与真核细胞骨架的质膜连接ERM蛋白家族有高同源性,推测其可能与虫体的生长代谢有关[10]。
HF在实验中作为阴性对照的抗原,通过以往的研究发现HF主要以抑制DC分泌IL-12p70,阻止Th0向Th1型细胞分化,而向Th2型细胞分化,参与寄生虫逃避[11-12]。
对于优化Eg10抗原致敏DC的时间过程中,我们发现该组DC 20 h的表面分子表达量明显高于6 h和48 h的DC。推其原因:抗原作用DC 6 h,时间太短,不能很好的致敏DC,所以表达量较低,然而作用48 h,表达量反而下降,考虑是由于DC不能耐受Eg10的长时间作用,否则会导致死亡,数目减少,表面分子表达量下降。在实际观察过程中我们已证实这个推测,抗原作用DC 48 h 的时候,培养孔中出现大量的细胞碎片,高倍镜下可见活细胞中有大量空泡存在,可能是由于细胞内很多结构被破坏,同时透射电镜结果也显示,Eg10组DC细胞中囊泡增多,线粒体肿胀等现象。
在用扫描电镜观察不同组的DC形态中,我们观察到了DC的不成熟,半成熟及成熟形态[13-14]。DC形态的不同即反应不同的成熟程度,Diaz A发现不同成熟度的DC会导致其抗原提呈能力及诱导T细胞增殖能力的不同,并诱导不同的免疫反应[15-16]。在我们的实验中发现了一致的结果,Eg10和HF诱导DC成熟的能力非常弱,与HF阴性对照组相比,仅仅是增加了细胞表面的褶皱,而对增加细胞表面突起无作用,细胞表面的突起是T与DC之间的传输通路,突起的数目与DC激活T细胞的增殖能力成正相关[17]。因此它们对T细胞增殖能力无显著提高,进一步检测T细胞中Treg的含量,发现Treg所占比例增高。Treg细胞主要作用抑制固有免疫和获得性免疫,并可分泌大量的抑制性炎性因子IL-10[18]。同时通过检测DC上清中细胞因子发现Eg10组可诱导大量的IL-6, IL-10的产生。尤以IL-10的显著,甚至高于HF组。它为寄生虫生长、繁殖、存活提供了很好的环境,诱导机体产生免疫耐受反应[19]。当加入LPS进行联合刺激发现DC的形态从不成熟状态转为细胞两极为梭形或蝌蚪状的半成熟形态。细胞表面突起增加,表面分子MHCII、CD80、CD40上调,CD86下调。CD40作为是TNF受体家族中的一员,对DC成熟有促进作用[20],CD86增高则激活Th2型反应[21],反则亦之。同时IL-10和IL-6的表达量降低,TNF-α含量的上提,均显示DC的成熟度有所提高。
综上所述,Eg10不能诱导DC成熟,可产生大量的Th2型细胞因子,提高T细胞中Treg细胞的含量,诱导机体产生Th2型免疫应答。
利益冲突:无

