TLR9联合CD40信号对ITP患儿外周血中IL10+CD3-细胞亚群改变的研究
郑蒙蒙,施建栋,周海霞
(1.温州医科大学 科研实验中心 流式细胞技术平台,浙江 温州 325035;2.温州医科大学附属第二医院育英儿童医院 儿童血液科,浙江 温州 325027)
免疫性血小板减少症(immune thrombocytopenia,ITP)是儿童常见的出血性疾 病[1],病情严重的患儿可发生内脏甚至颅内出血而危及生命,病死率为1%~3%[1-2]。ITP的病因多样,机体免疫耐受状态的失衡是导致该病发生的重要机制,其中由血小板受体与T细胞受体的相互交叉免疫反应引发T/B细胞针对自身抗原的异常活化,而触发一系列免疫反应,并最终引发ITP的相关机制研究较多[2-3]。此外,感染、妊娠、药物和遗传因素等也与ITP发病有着密切关系[2,4]。然而,由于儿童免疫细胞的发育和应答与成人免疫系统存在一定的差异,目前有关儿童ITP发病原因尚未完全明确。IL-10是一种具有免疫抑制功能的细胞因子,巨噬细胞、树突状细胞、调节性T/B淋巴细胞(Treg/Breg)等均能表达抑炎因子。血小板除了具有经典的促凝血功能外,也能表达多种功能受体包括TLR和CD40L[5]。血小板来源的CD40L能促进T细胞效应功能、抑制树突状细胞分化、促进B细胞分化及抗体类别改变[6-8]。在血小板减少的过程,机体会增加促血小板生成素(thrombopoietin,TPO)的合成。而在ITP体内模型中,内毒素刺激介导的TLR4信号能刺激TPO的合成[9]。但TLR9激动剂(CpG)联合CD40L对ITP患儿CD3-细胞的IL-10表达及存活率的影响尚不清楚。本研究通过流式细胞多因子分析技术(CBA)检测ITP患儿血浆IL-10含量,并通过CpG联合CD40L体外刺激ITP患儿和正常对照PBMC,流式细胞胞内外染色分析CD3-、CD3+、CD3-IL10+细胞的比例及细胞存活率等,为阐明儿童ITP的发病机制及探索新的潜在治疗靶点和预后指标提供科学依据。
1 材料和方法
1.1 材料
1.1.1 临床样本及资料:选取经确诊的ITP患儿8例(男5例,女3例),中位年龄4岁,所有患儿均为初发,诊断符合原发性ITP[10],均无肝炎病毒、巨细胞病毒、EB病毒感染依据,自身免疫抗体均阴性。ITP患儿外周血样本于治疗前采集于温州医科大学附属第二医院育英儿童医院儿童血液科,该过程经过患儿监护人知情同意并且通过温州医科大学附属第二医院育英儿童医院伦理委员会审查。同时选取7名年龄性别匹配的健康体检儿童正常外周血作为对照组。
1.1.2 材料试剂:IMDM细胞培养液和1 000×β巯基乙醇均购于美国Gibco公司;青霉素-链霉素溶液(100×)购于上海碧云天生物技术公司;新生牛血清(FBS)购于杭州四季青生物技术公司;红细胞裂解液和人外周血淋巴细胞分离液均购于北京索莱宝生物技术公司;CpG(OND2006)购于美国Invivogen公司;CD40L购于美国eBioscience公司;流式细胞胞内染色试剂盒及Golgiplug均购于美国BD Bioscience公司;LEGENDplex人炎症因子检测阵列、FITC anti-human CD3及PE anti-human IL-10均购于美国Biolegend公司;LIVE/DEAD Fixable Violet Dead Cell Stain Kit购于美国Invitrogen公司。
1.2 人外周血血浆及PBMC分离 人外周血样本使用EDTA抗凝管进行采集,外周血样本先利用PBS稀释混匀,再缓慢加入人外周血细胞分离液,2 500 r/min 室温离心20 min,小心吸取管中云雾状薄层细胞及血浆层,并分别转移至干净离心管,含有细胞的离心管再加入4倍体积PBS洗涤2次后重悬于IMDM完全培养基进行细胞计数。
1.3 PBMC体外刺激培养 将计数后的PBMC按4× 105/孔的细胞密度置于96孔细胞培养板中,并按照实验条件,设置仅Golgplug作用组(未刺激组)或加入终浓度为10 μg/mL CpG联合1 μg/mL CD40L(含Golgplug)为刺激组。将上述细胞置于37 ℃二氧化碳细胞培养箱,培养5 h。
1.4 流式细胞染色及分析 刺激后的细胞重悬于含2% FBS的PBS(FACS缓冲液)中,加入FITC antihuman CD3及LIVE/DEAD Fixable Violet Dead Cell染料,冰上染色30 min进行细胞表面抗原的染色。染色后样本用FACS缓冲液离心洗涤2次后,再按BD胞内染色试剂盒说明书配制PE anti-human IL-10,然后进行胞内抗原的染色。染色后的细胞将用于流式分析。ITP患儿及正常对照血浆样本中IL-10的含量采用LEGEND plex技术进行染色,染色方法按照Biolegend LEGENDplex试剂盒说明书进行。染色后样本将用于流式检测分析。
1.5 统计学处理方法 流式多因子染色数据采用Biolegend公司LEGENDplexTM软件进行分析处理和作图。流式细胞胞内外染色数据采用Flowjo 9.3.2分析作图,其他数据采用GraphPad Prism 7.0作图和统计学分析。所有流式数据采用BD FACSAria II流式细胞仪进行采集,每个样本收集10~15万个细胞。2组计量资料比较采用独立样本t检验或配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 ITP患儿外周血血浆IL-10含量检测结果 流式细胞多因子检测技术分析了7例正常对照和8例患儿血浆中IL-10的含量,结果显示,相比正常对照组(5.677±0.808),ITP患儿血浆中IL-10的含量(8.063±0.892)显著升高,其IL-10含量约为正常对照组的1.42倍,差异有统计学意义(P<0.05)。
2.2 CpG联合CD40L体外刺激前后ITP患儿PBMC中CD3+和CD3-细胞亚群的变化 采用CpG联合CD40L体外刺激7例正常对照和8例ITP患儿PBMC样本,结果显示,体外刺激5 h后相比未刺激组,正常对照及ITP患儿CD3-细胞比例均显著升高,而CD3+细胞比例均下降,差异有统计学意义(P<0.05),见图1-2。

图1 流式检测刺激前后PBMC中CD3+及CD3-细胞比例(%)

图2 刺激前后PBMC中CD3+及CD3-细胞比例统计图
2.3 CpG联合CD40L体外刺激前后ITP患儿PBMC中IL-10+CD3-细胞亚群的变化 通过流式细胞胞内外染色技术进一步分析CD3-细胞中IL-10表达情况,发现ITP患儿刺激前,其PBMC中IL-10+CD3-细胞比例(0.697±0.056)相比正常对照组(0.521±0.044)有升高,约为正常对照组的1.34倍,差异有统计学意义(P<0.05)。而CpG+CD40L刺激5 h后,正常对照组及ITP患儿IL-10+CD3-细胞比例(2.723± 0.358)相比正常对照组(0.796±0.068)均显著升高,且相比正常对照刺激后样本,体外刺激后的ITP患儿PBMC中IL-10+CD3-细胞比例升高更为明显,约为正常对照组的7.6倍,提示ITP患儿PBMC对于CpG联合CD40L体外刺激诱导CD3-表达IL-10可能更为敏感,见图3-4。

图3 流式检测刺激前后PBMC中IL-10+CD3-细胞比例(%)
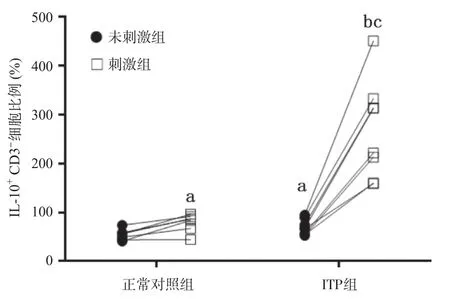
图4 刺激前后PBMC中IL-10+CD3-细胞比例统计图
2.4 CpG联合CD40L体外刺激前后ITP患儿PBMC中IL-10+CD3-细胞存活率变化 进一步采用可固定的活细胞分析染料(Live/Dead Fixable Violet Dye)检测CpG联合CD40L刺激前后对PBMC中IL-10+CD3-细胞存活率的影响。我们发现,刺激后正常对照组和ITP患儿PBMC中IL-10+CD3-细胞存活率均显著低于未刺激组,ITP患儿IL-10+CD3-细胞存活率均低于正常对照组,差异均有统计学意义(P<0.05),见图5-6。
3 讨论
ITP是成人和儿童常见的血液疾病,该病最早于1915年由Frank报道。ITP发病原因复杂,诱导因素亦较多。成人患者中多见于诸如自身抗体及CD8+细胞毒性T细胞介导的抗血小板免疫反应导致巨噬细胞和树突状细胞活化并吞噬血小板功能,导致成人患者血小板含量下降。大约有70%的ITP患者中存在抗GP IIb/IIIa抗体,有20%~40%的ITP患者中存在抗GP Ib复合物抗体[11]。另外,有研究也发现,辅助型T细胞(Th)如Th1/Th2/Th17/Th22型CD4+T细胞比例异常[12]、调节性T细胞(Treg)数量的失衡和功能异常[13]、滤泡样辅助性Tfh异常增殖导致B细胞分化和抗血小板抗体生成异常等也参与了该病的发生[14]。然而,对于非T细胞(CD3-的免疫细胞,如髓系细胞、B细胞等)如何参与该病发生,尤其对于儿童ITP发病的影响仍未完全明确。
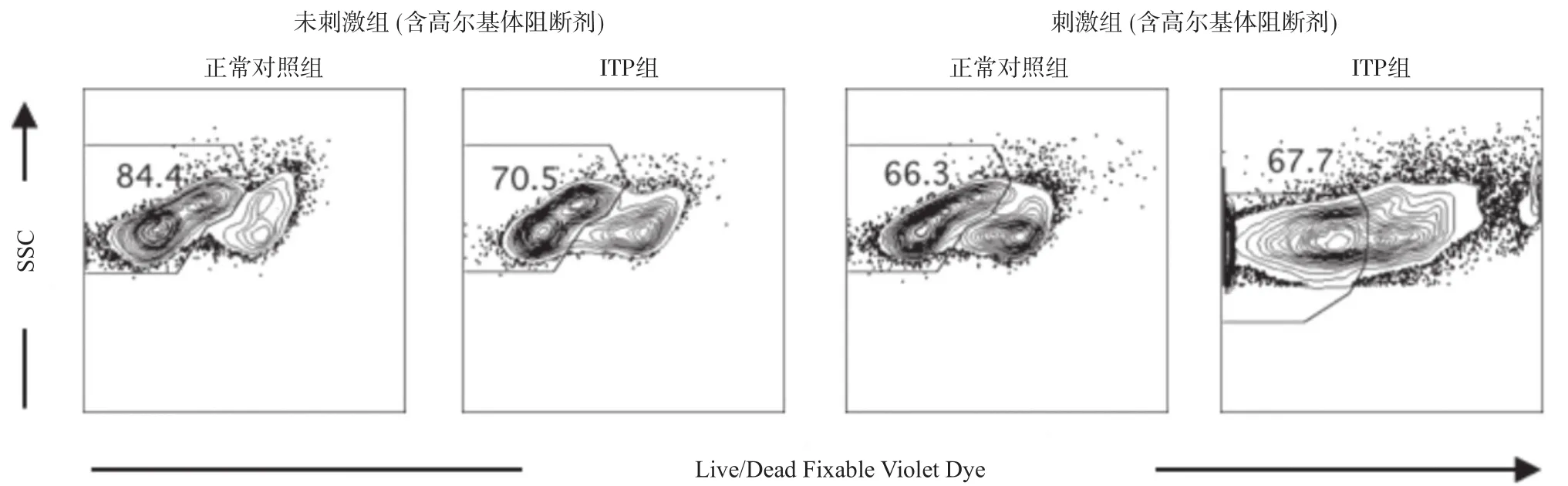
图5 流式检测刺激前后IL-10+CD3-细胞存活率情况(%)

图6 刺激前后IL-10+CD3-细胞存活率统计图
以往报道中发现ITP成人患者编码IL-1、IL-2、IL-4、IL-10、IL-17、TNF-α、TGF-β和IFN-γ等细胞因子的基因存在较多的SNP位点,且这些SNP位点与ITP的发生存在较大的相关性[15-19]。虽然,在以往成年ITP患者的研究中发现成年ITP急性活动期患者外周血血清中IL-10水平低于健康对照及处于临床稳定期的ITP成年患者[20]。然而,本研究通过LEGEND plex多因子检测技术分析了8例ITP患儿和7例正常对照的血浆样本的IL-10含量,发现ITP患儿样本中IL-10的含量显著高于正常患儿,该结果与成人患者血清样本中的IL-10变化趋势存在差异,提示ITP患儿中可能存在某些机制能诱导IL-10的表达。血小板表面的CD40L已被认为是导致T细胞异常活化及增加树突状细胞等功能的重要因素[21],成人ITP患者树突状细胞的TLR9 mRNA的异常表达可能也与该病的发生发展有重要联系[22]。因此,本研究中,我们进一步应用TLR9激动剂(CpG)并联合CD40配体,共同体外刺激8例ITP患儿和7例正常对照PBMC,利用流式细胞胞内外染色技术检测发现,刺激后ITP患儿和正常对照中CD3-细胞亚群比例均显著上调,提示TLR9和CD40L体外联合刺激5 h即能导致影响CD3-细胞比例的变化。相比正常对照,ITP患儿在CD3-细胞中IL-10+细胞的比例显著增高,表明ITP患儿CD3-细胞对于TLR9和CD40信号的刺激可能更为敏感,结果提示ITP患儿PBMC的CD3-细胞中TLR9及CD40信号可能存在异常。
综上,我们发现ITP患儿PBMC中CD3-细胞对TLR9联合CD40L刺激介导的IL-10表达相比正常对照更为敏感。在将来的研究工作中,通过探索ITP患儿中CD3-阴性细胞中响应TLR9和CD40L信号免疫细胞类型和作用机制,以深入阐明ITP的发病机制。

