RanBPM对肾小管钠-氯共同转运子的调控作用及对ERK1/2信号通路的影响
张益前,庄芝芝,沈猛,庄捷秋,蔡晖
(温州医科大学附属第二医院育英儿童医院,浙江 温州 325027,1.肾内科;2.儿童肾内科)
高血压是脑卒中、冠心病的危险因素,也是世界范围内导致死亡的主要原因之一,其确切发病机制尚未完全明确。钠-氯共同转运子(sodium chloride cotransporter,NCC)表达在肾脏远曲小管上皮细胞,负责重吸收5%~10%的过滤 钠[1]。过度活跃的NCC功能被认为是导致高血压发展的因素之一。因此,研究肾小管NCC上游调控蛋白对高血压的防治具有重要意义。Ran结合蛋白M (Ranbinding protein M,RanBPM)是一种核质蛋白,涉及转录调节、细胞形态调节和受体激活细胞内信号通路的调节[2]。研究表明,RanBPM可通过调节c-Raf稳定性抑制ERK1/2的活化[3]。本课题组早期的研究表明,WNK4通过激活ERK1/2信号通路来抑制NCC,酵母双杂交筛选工具和共免疫沉淀的预实验初步数据也显示WNK4与RanBPM存在相互作用[4]。本研究探讨RanBPM是否通过ERK1/2信号传导通路调控肾小管NCC的蛋白表达以及对WNK4功能的影响,为高血压的诊治探索新的治疗靶点。
1 材料和方法
1.1 材料 小鼠远曲小管(mouse distal convoluted tubule,mDCT)细胞获赠于芝加哥大学Robert S.Hoover教授实验室,HEK 293T细胞购自中国科学院细胞库。脂质体2000、RNAiMax脂质体购自美国Invitrogen公司;抗myc抗体、抗HA抗体等兔多克隆抗体来自美国Abcam公司;总NCC抗体购自美国PhosphoSolutions公司;t-ERK1/2、 p-ERK1/2、β-actin等多克隆兔抗为美国Cell Signal Tech-nology公司产品;其余试剂均为市售分析纯。
1.2 细胞培养和转染 mDCT和HEK 293T细胞常规培养于含5% FBS+1%青/链霉素的DMEM/F12(1:1)培养液中,置于细胞培养孵育箱(37 ℃,5% CO2,饱和湿度)内孵育[4]。根据试剂盒说明书利用脂质体2000转染质粒myc-RanBPM,转染48 h后,裂解细胞进行进行Western blot。利用RNAiMax脂质体将RanBPM siRNA反转染入细胞。
1.3 免疫共沉淀检测RanBPM蛋白与WNK4蛋白是否存在直接相互作用 HEK 293T细胞分接种于3个 6 cm培养皿,分别共转染HA-WNK4质粒和myc-vector(质粒空载体作为对照),或myc-RanBPM(149~729全长)质粒,或myc-RanBPM(149~353功能区域)质粒后,48 h后收集细胞裂解液。用一抗(RanBPM的抗myc抗体)孵育2 h,然后加入蛋白G/A分离磁珠,在4 ℃处进一步混合和孵育。使用裂解液洗涤2次,PBS液洗涤1次后,珠子将用莱姆利缓冲液(Bio-Rad)洗净。洗脱的蛋白质将由SDS-PAGE分离,然后使用一抗(WNK4的抗HA抗体)进行Western blot分析。剩余细胞裂解液使用一抗(RanBPM的抗myc抗体)进行Western blot分析。具体步骤依据本实验室既往常规方法进行[4]。
1.4 RanBPM对ERK1/2信号传导通路的影响 HEK 293T细胞接种于4个6 cm培养皿,分为PBS组和表皮生长因子(epidermal growth factor,EGF)组,各组分别转染myc的质粒空载体或者myc-RanBPM。EGF组用0.3 ng/mL EGF预处理HEK 293T细胞15 min,刺激ERK1/2磷酸化水平,PBS组加入等量PBS液作为对照,在EGF刺激ERK1/2磷酸化前后Western blot检测RanBPM蛋白、ERK信号通路蛋白。
1.5 RanBPM过表达对NCC蛋白含量和ERK1/2磷酸化水平的影响 含有内源性NCC的小鼠mDCT细胞接种于4个6 cm培养皿,2盘转染myc空白质粒,2盘转染myc-RanBPM质粒。48 h后采集细胞裂解液,经过SDS-PAGE电泳,利用相应的抗体检测总NCC、myc-RanBPM、磷酸化ERK1/2、总ERK1/2和β-actin的蛋白质水平。
1.6 siRNA抑制RanBPM基因对NCC的蛋白表达及ERK1/2磷酸化水平的影响 小鼠mDCT细胞分离培养在4个60 mm培养皿中24 h,细胞丰度至30%~50%时,2盘对照组转染20 μL空siRNA,另2盘转染20 μL RanBPM siRNA(应用siRNA基因下调RanBPM)。48 h后将换成含抗生素不含FBS的DMEM/F12(1:1)培养液中继续培养12 h,收集细胞裂解液,经过SDSPAGE电泳和Western blot分析,利用相应的抗体检测出总NCC、RanBPM、磷酸化ERK1/2、总ERK1/2和β-actin的蛋白质水平。
1.7 RanBPM和WNK4通过ERK1/2磷酸化调控NCC表达 为验证WNK4是否通过与RanBPM的相互作用来调节NCC的。将含有内源性NCC的小鼠mDCT细胞接种于3个6 cm培养皿,分别共转染了myc-RanBPM质粒(1 μg)和逐步递增WNK4质粒(0.5、1.0、3.0 μg)。 48 h后采集细胞裂解液,经过SDS-PAGE电泳和Western blot分析,利用相应的抗体检测出总NCC、WNK4、myc-RanBPM、磷酸化ERK1/2、总ERK1/2和β-actin的蛋白质水平。
1.8 统计学处理方法 用SPSS22.0统计学软件进行数据分析。数据进行正态性检验,用表示,2组间数据比较采用成组t检验;多样本均数比较进行方差齐性检验,若方差齐,组间比较采用单因素方差分析,若数据不具有方差齐性则采用DunnettT3检验。P<0.05为差异有统计学意义。
2 结果
2.1 免疫共沉淀检测RanBPM蛋白与WNK4蛋白是否存在直接相互作用 RanBPM全长或者功能区域质粒能够与WNK4发生免疫共聚焦作用,而质粒空载体不与WNK4发生共聚焦作用(见图1),证实RanBPM与WNK4之间有蛋白直接相互作用,并具有特异性。

图1 WNK4与RanBPM之间存在蛋白相互作用
2.2 RanBPM对ERK1/2信号传导通路的影响 结果显示,0.3 ng/mL EGF处理HEK 293T细胞15 min后,ERK1/2磷酸化水平明显增加,然而,在HEK 293T细胞转染RanBPM的情况下,ERK1/2磷酸化水平呈现减少现象,证实RanBPM是ERK1/2磷酸化信号传导通路的抑制剂。见图2。

图2 RanBPM抑制EGF诱导的ERK1/2磷酸化
2.3 RanBPM过表达对NCC蛋白含量和ERK1/2磷酸化水平的影响 mDCT细胞转染myc-RanBPM 48 h后,与对照组比,过表达RanBPM可以显著抑制ERK1/2磷酸化(P<0.01),并显著增加NCC的蛋白表达(P<0.01),见表1,提示RanBPM通过抑制ERK1/2信号通路增加NCC蛋白表达。
表1 RanBPM过表达对NCC蛋白及ERK1/2蛋白相对表达量的影响(n=4, )
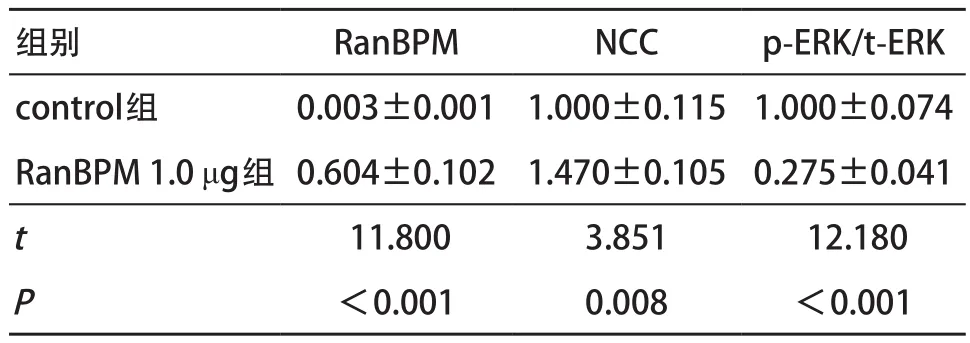
表1 RanBPM过表达对NCC蛋白及ERK1/2蛋白相对表达量的影响(n=4, )
组别 RanBPM NCC p-ERK/t-ERK control组 0.003±0.001 1.000±0.1151.000±0.074 RanBPM 1.0 μg组 0.604±0.102 1.470±0.1050.275±0.041t11.800 3.851 12.180P<0.001 0.008 <0.001
2.4 siRNA抑制RanBPM基因对NCC蛋白表达及ERK1/2磷酸化水平的影响 转染RanBPM siRNA后,RanBPM蛋白表达显著下降。与对照siRNA组相比,RanBPM siRNA转染组ERK1/2磷酸化水平显著增加(P<0.01)。与对照siRNA组比较,NCC蛋白表达水平显著下降(P<0.01),见表2。进一步证实,RanBPM基因下调后增加了ERK1/2信号通路活性,并下调了NCC蛋白表达。
表2 RanBPM表达下调对NCC、ERK1/2蛋白相对表达量的影响(n=4, )

表2 RanBPM表达下调对NCC、ERK1/2蛋白相对表达量的影响(n=4, )
组别 RanBPM NCC p-ERK/t-ERK control组 1.100±0.106 1.000±0.223 1.000±0.194 RanBPM siRNA组 0.008±0.003 0.556±0.132 2.301±0.220t20.710 4.666 4.770P<0.001 0.003 <0.001
2.5 RanBPM阻止了WNK4对ERK1/2磷酸化的刺激作用及对NCC的抑制作用 在同时转染RanBPM质粒的情况下,在小鼠mDCT细胞上转染WNK4质粒,与低剂量的WNK4比较(0.5 μg作为对照组),逐步增加WNK4的质粒剂量,没有进一步改变ERK1/2磷酸化的水平,也没有明显抑制NCC的蛋白表达作用(P>0.05),见表3。这一结果提示由于RanBPM对ERK信号通路有抑制作用,RanBPM阻止了WNK4对ERK1/2信号通路的影响和对NCC蛋白表达的抑制作用,进一步说明RanBPM与WNK4蛋白相互作用在NCC调节中的重要性。
3 讨论
高血压是慢性肾脏病相关的最常见合并症,并且是慢性肾脏病进展和心血管疾病的最重要的但可以改变的危险因素之一[6]。然而,在临床实际工作中,慢性肾脏病患者通常难以真正实现适当的血压控制,主要原因是肾小管盐敏感性增加。例如NCC磷酸化级联的过度激活会增加肾远端肾单位中钠的重吸收,从而导致盐敏感性高血压[7]。因此,深入研究NCC上游调控蛋白对防治难治性高血压具有重要临床价值。
表3 RanBPM阻止了WNK4对ERK1/2磷酸化的刺激作用及对NCC的抑制作用(n=4, )
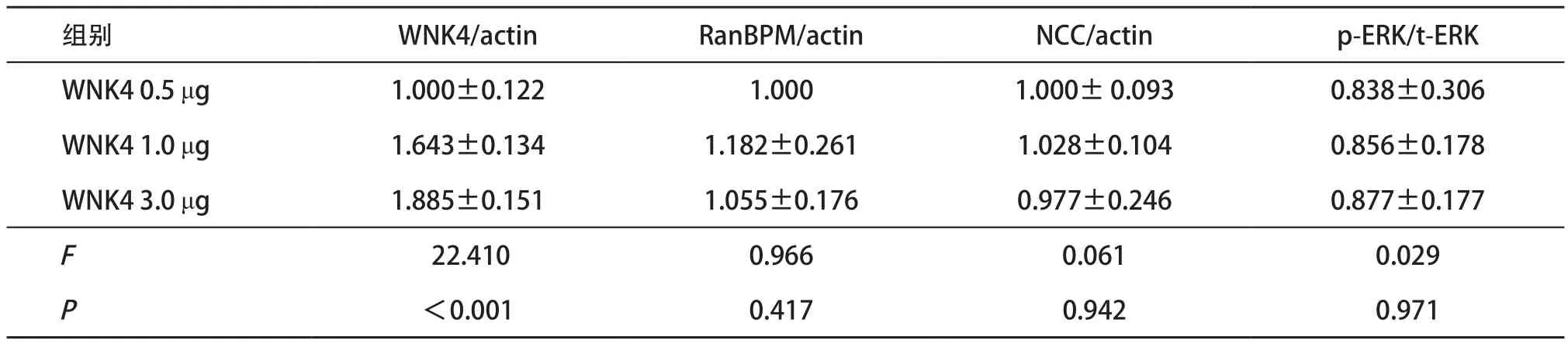
表3 RanBPM阻止了WNK4对ERK1/2磷酸化的刺激作用及对NCC的抑制作用(n=4, )
组别 WNK4/actin RanBPM/actin NCC/actin p-ERK/t-ERK WNK4 0.5 μg 1.000±0.122 1.000 1.000± 0.093 0.838±0.306 WNK4 1.0 μg 1.643±0.134 1.182±0.261 1.028±0.104 0.856±0.178 WNK4 3.0 μg 1.885±0.151 1.055±0.176 0.977±0.246 0.877±0.177F22.410 0.966 0.061 0.029P<0.001 0.417 0.942 0.971
肾脏的NCC主要分布于远曲小管,是肾小管重吸收钠离子的通道蛋白之一。NCC受到多种因素的广泛调节,包括膳食盐、激素(醛固酮、血管紧张素II和血管加压素)以及多种激酶,如WNK-SPAK/OSR1信号通路和MAPK-ERK1/2信号通路[8-9],也包括NCC上游调控蛋白WNK家族(属于丝氨酸/色氨酸激酶)。临床上部分患者出现WNK1和WNK4激酶的突变可导致II型假性醛固酮减少症,具有高血压、高钾血症和代谢性酸中毒的临床特征[10]。相关机制研究也证实WNK激酶不但可以通过刺激SPAK/OSR1信号传导通路来上调NCC的功能和蛋白表达水平[11-12],还通过激活ERK1/2信号通路来抑制NCC[4]。
RanBPM为一个核质蛋白,其功能仍不明确,但与多种细胞功能有关,包括转录调控、细胞形态的调控以及受体激活的细胞内信号的调控[3,13-14]。ERK通路调节凋亡蛋白的水平和活性,与细胞存活和增殖密切相关有关[15]。ERK1/2通常作为Ras/Raf/MEK1/2/ERK1/2信号级联的一部分,我们的前期研究表明,WNK4激酶可激活MAP-ERK1/2激酶信号通路[4,16]。WNK1通过MEK5激活ERK5[17]。同样,WNK2也通过Raf/MEK1/2激活ERK1/2[18]。这些发现表明,WNK激酶可以被视为MAPK信令级联的一部分,且位于后者的上游。最近的一项研究表明,RanBPM具有抑制ERK1/2活化的作用[3]。本研究通过免疫共沉淀实验表明,全长和功能性RanBPM与WNK4均存在相互作用,故我们推测RanBPM可能参与对WNKERK1/2信号通路的调控。
本研究通过在培养小鼠DCT细胞中过表达Ran-BPM蛋白,发现ERK1/2磷酸化水平明显下降,同时增强NCC总蛋白的表达。应用siRNA技术将RanBPM基因表达下调,结果发现刺激了ERK1/2磷酸化,从而降低NCC蛋白的表达。进一步实验发现在存在RanBPM的情况下,WNK4失去了刺激ERK磷酸化的能力,并且也不能抑制NCC的蛋白表达。上述结果表明RanBPM由于其对ERK信号传导通路的抑制作用,可能阻止了WNK4调节ERK1/2信号通路所依赖的NCC调节作用,也证实了RanBPM与WNK4之间存在蛋白相互作用,共同参与肾小管NCC调节作用。
——一道江苏高考题的奥秘解读和拓展

