桑白皮总黄酮对哮喘小鼠气道炎症反应的保护作用
葛淑瑜,李岚,孙萍萍
(1.浙江省立同德医院 药学部,浙江 杭州 310005;2.浙江中医药大学附属第一医院 呼吸科,浙江 杭州 310006)
支气管哮喘是由多种细胞及细胞组分参与的一种高发病率慢性炎症疾病,炎症反应在哮喘中发挥着重要作用[1-2]。哮喘气道炎症反应往往伴随着嗜酸性粒细胞、巨噬细胞、中性粒细胞等白细胞浸润以及各种炎症因子如IL-4、IL-5、IL-13水平上调[3]。目前临床上多采用糖皮质激素、β受体激动剂、免疫抑制药物治疗急性或慢性哮喘,虽然疗效显著,但均存在一定的不良反应,可能会导致患者出现药物依赖性、肺功能下降、患肿瘤概率增加以及诱发多种感染。因此寻找疗效显著但不良反应更小的哮喘治疗药物意义重大[4]。
桑白皮为桑科植物桑的干燥根皮,是一种传统中草药,具有平喘、止咳、润肺、利水消肿等疗效。现代药理学研究也表明桑白皮具有免疫活性、降血脂、抗氧化、抗炎症、抗菌和抗病毒等活性。桑白皮的主要成分为酚类化合物和黄酮类化合物。黄酮类化合物广泛存在于多种药用植物中,被认为是最安全的生物活性物质之一。有研究报道桑叶中的黄酮化合物可以抑制糖毒性导致的细胞凋亡[5],陈皮中的黄酮可以显著降低哮喘气道炎症反应过程中的IgE、IL-4、IL-13水平的上调,缓解哮喘症状[6]。 目前桑白皮中的黄酮类物质对于哮喘的作用效果尚不明确。本研究旨在探讨桑白皮总黄酮(total flavonoids of cortex mori,TFCM)对哮喘模型小鼠气道炎症反应的影响以及影响机制,以明确其对哮喘的治疗效果。
1 材料和方法
1.1 材料
1.1.1 实验动物:健康清洁级雌性C57BL/6小鼠60只,由上海西普尔-必凯实验动物有限公司提供,动物许可证号:SCXK(沪)2018-0006,体质量18~ 20 g。于室温(22±2)℃,湿度50%~60%,光照每12 h明暗交替饲养,小鼠饲料采用不含致敏原的特殊饲料。
1.1.2 试剂:卵清蛋白(ovalbumin,OVA)购自北京国药集团化学试剂有限公司,地塞米松购自上海源叶生物科技有限公司,IL-4、IL-5、IL-13、黏蛋白MUC5AC、MUC5B、IgE、嗜酸性粒细胞活化因子Eotaxin ELISA试剂盒购自武汉酶免生物科技有限公司。
1.1.3 仪器:超声波清洗器购自上海知信实验仪器技术有限公司,小动物雾化给药仪购自南京赛昂斯生物科技有限公司,动物肺功能检测系统购自德国EMKA公司,酶标仪购自美国Molecular Devices公司,光学显微镜购自日本尼康公司,低温高速离心机购自美国赛默飞公司。
1.2 方法
1.2.1 TFCM制备:称取桑白皮200 g,粉碎后加入乙醚500 mL,浸泡4 h。过滤后得到浸出液,在滤渣中再次加入500 mL乙醚冲洗滤渣,重复操作2次,将乙醚回收。随后在滤渣中加入50%乙醇600 mL,于50 ℃超声萃取30 min后过滤,滤渣再用600 mL 50%乙醇超声萃取后过滤,重复操作2次,合并所有乙醇滤液95 ℃水浴蒸干得TFCM,冰箱冷藏备用[7]。
1.2.2 动物分组及哮喘模型建立:按随机数字表法将60只小鼠分为正常组、模型组、TFCM低剂量组(50 mg/kg)、TFCM中剂量组(100 mg/kg)、TFCM高剂量组(200 mg/kg)和阳性对照组(地塞米松 0.5 mg/kg),每组10只。模型组、TFCM各剂量组及阳性对照组均给予总共0.5 mL的2 mg/mL的OVA溶液(用4%的氢氧化铝凝胶配制)于两后足、腹股沟、背部皮下、颈部皮下及腹腔注射致敏,致敏第14天继续腹腔注射0.2 mL OVA溶液加强致敏,第23天开始雾化吸入含10 mg/mL的OVA的0.9%氯化钠溶液,每周3次,每次30 min,连续8周。正常组给予等量0.9%氯化钠溶液致敏和雾化激发。每次雾化前1 h,各剂量组灌胃给予50、100、200 mg/kg TFCM,阳性对照组灌胃给予0.5 mg/kg地塞米松,正常组、模型组给予等量0.9%氯化钠溶液。
1.2.3 气道反应性测定:每组随机选取3只小鼠进行气道反应性测定,在末次雾化吸入24 h后,将清醒状态的小鼠放入EMKA动物肺功能检测系统,待小鼠呼吸稳定后,依次吸入0.9%氯化钠溶液、0.0625、0.125、0.25、0.5、1.0 mg/mL的乙酰甲胆碱(methacholine,Mch)溶液50 μL,记录小鼠肺阻力和肺动态顺应性数据。
1.2.4 标本收集:在末次雾化激发24 h后,用戊巴比妥钠麻醉小鼠,气管插管,结扎左肺上叶,行肺泡灌洗得到支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)。将BALF于4 ℃、3 000 r/min离心10 min,取上清液,用于IL-4、IL-5、IL-13、MUC5AC、 MUC5B、Eotaxin水平测定。收集细胞沉淀用于细胞总数及白细胞分类计数。对小鼠进行眼球采血,采集的血液于4 ℃、3 000 r/min离心10 min,收集上清用于IgE水平测定。后处死动物,取右肺组织,用4%中性甲醛固定,石蜡包埋、切片,用于HE染色和AB-PAS染色。
1.2.5 BALF中总细胞及白细胞分类计数:用60 μL PBS重悬BALF细胞,吸取10 μL细胞悬液至细胞计数板于显微镜下计数细胞总数;取20 μL细胞悬液涂片做瑞氏-吉姆萨染色,在显微镜下依据形态学特点将细胞分为淋巴细胞、中性粒细胞、嗜酸性粒细胞、巨噬细胞,然后进行计数。
1.2.6 BALF中IL-4、IL-5、IL-13、MUC5AC、MUC5B、Eotaxin水平测定:采用ELISA试剂盒严格按照说明书操作,根据吸光度(OD)值计算各待测物质含量。
1.2.7 血清中IgE水平测定:严格按照IgE ELISA试剂盒说明进行操作,根据OD值计算IgE含量。
1.2.8 HE染色:将小鼠肺组织用4%中性甲醛固定后脱水包埋制成蜡块,将蜡块切成4 μm厚切片,HE染色,观察气道炎症细胞浸润情况。
1.2.9 AB-PAS染色:将小鼠肺组织用4%中性甲醛固定后脱水包埋制成蜡块,将蜡块切成4 μm厚切片,AB-PAS染色,观察黏液分泌情况判断杯状细胞增生。
1.3 统计学处理方法 采用SPSS20.0统计软件分析。计量资料以表示,采用单因素方差分析进行组间比较,方差齐时采用LSD法进行组间两两比较,方差不齐时采用Games-Howell检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠气道反应性比较 各组小鼠肺阻力和肺顺应性基础值相近,每组小鼠肺阻力均随着Mch激发浓度升高而升高,肺顺应性均随着Mch激发浓度升高而降低;当用0.9%氯化钠溶液和0.0625 mg/mL Mch激发时,各组间的肺阻力和肺顺应性差异均无统计学意义(P>0.05)。当分别采用0.125、0.25、0.5、1 mg/mL Mch激发时模型组肺阻力显著高于正常组,肺顺应性显著低于正常组(P<0.05);当分别采用0.25、0.5、1.0 mg/mL Mch激发时,TFCM剂量组肺阻力显著低于模型组,肺顺应性显著高于模型组(P<0.05),且呈剂量依赖性(见表1-2)。
表1 各组小鼠不同剂量Mch激发时的肺阻力比较[n=3, ,cmH2O/(mL·s)]
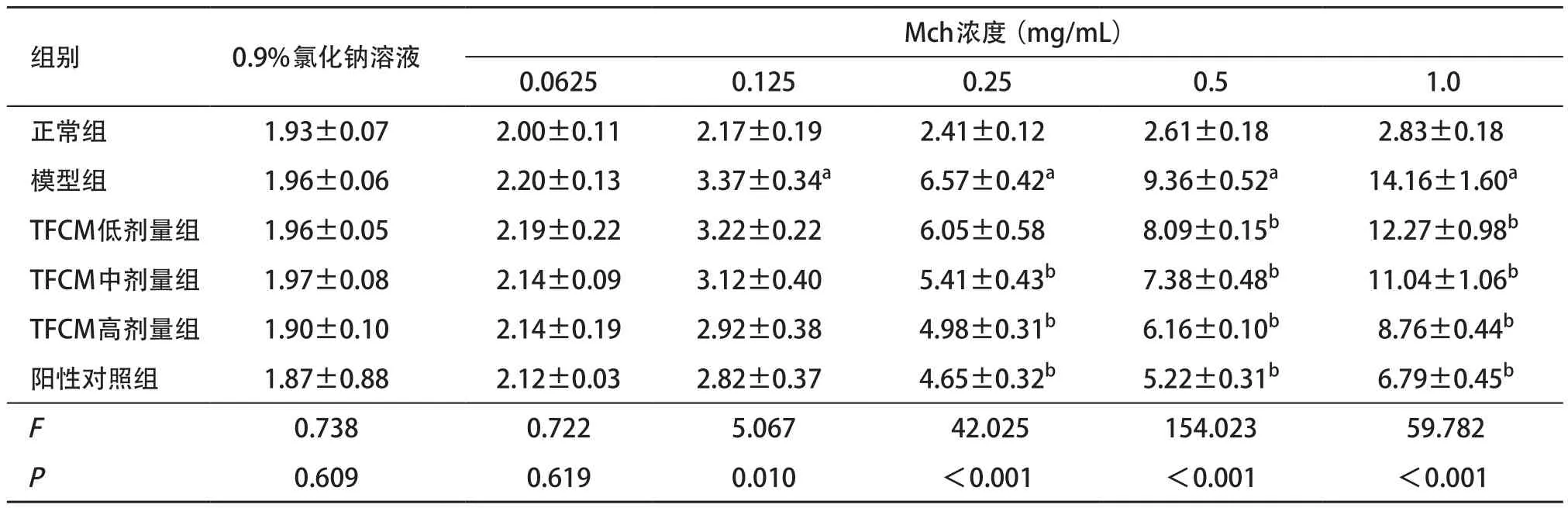
表1 各组小鼠不同剂量Mch激发时的肺阻力比较[n=3, ,cmH2O/(mL·s)]
与正常组比:aP<0.05;与模型组比:bP<0.05
组别 0.9%氯化钠溶液 0.0625 0.125 0.25 0.5 1.0正常组 1.93±0.07 2.00±0.11 2.17±0.19 2.41±0.12 2.61±0.18 2.83±0.18模型组 1.96±0.06 2.20±0.13 3.37±0.34a6.57±0.42a9.36±0.52a14.16±1.60aTFCM低剂量组 1.96±0.05 2.19±0.22 3.22±0.22 6.05±0.58 8.09±0.15b12.27±0.98bTFCM中剂量组 1.97±0.08 2.14±0.09 3.12±0.40 5.41±0.43b7.38±0.48b11.04±1.06bTFCM高剂量组 1.90±0.10 2.14±0.19 2.92±0.38 4.98±0.31b6.16±0.10b 8.76±0.44b阳性对照组 1.87±0.88 2.12±0.03 2.82±0.37 4.65±0.32b5.22±0.31b 6.79±0.45bF0.738 0.722 5.067 42.025 154.023 59.782P0.609 0.619 0.010 <0.001 <0.001 <0.001
2.2 各组小鼠BALF中细胞总数及细胞分类计数 模型组小鼠BALF中细胞总数、中性粒细胞、嗜酸性粒细胞、巨噬细胞数量均显著高于正常组(P<0.05),TFCM中、高剂量组以及阳性对照组细胞总数、中性粒细胞、嗜酸性粒细胞、巨噬细胞均显著低于模型组(P<0.05),TFCM低剂量组中性粒细胞、嗜酸性粒细胞低于模型组(P<0.05)。各剂量组淋巴细胞数量与模型组比差异无统计学意义(P>0.05),见表3。
2.3 各组小鼠BALF中IL-4、IL-5、IL-13、Eotaxin水平比较 模型组BALF中IL-4、IL-5、IL-13、Eotaxin 水平均显著高于正常组(P<0.05),TFCM各剂量组和阳性对照组BALF中IL-4水平低于模型组,在中、高剂量组中更为显著(P<0.05);TFCM高剂量组和阳性对照组IL-5水平显著低于模型组(P<0.05);TFCM 各剂量组和阳性对照组IL-13、Eotaxin水平均显著低于模型组(P<0.05),且呈剂量依赖性,见表4。
2.4 各组小鼠血清IgE水平及BALF中MUC5AC、MUC5B表达水平比较 模型组小鼠血清IgE水平和BALF中MUC5AC、MUC5B表达水平显著高于正常组(P< 0.05);TFCM中、高剂量组和阳性对照组血清IgE水平显著低于模型组(P<0.05);TFCM各剂量组和阳性对照组MUC5AC、MUC5B表达水平均显著低于模型组(P<0.05),且呈剂量依赖性,见表5。
表2 各组小鼠不同剂量Mch激发时的肺顺应性比较(n=3, ,mL/cmH2O)
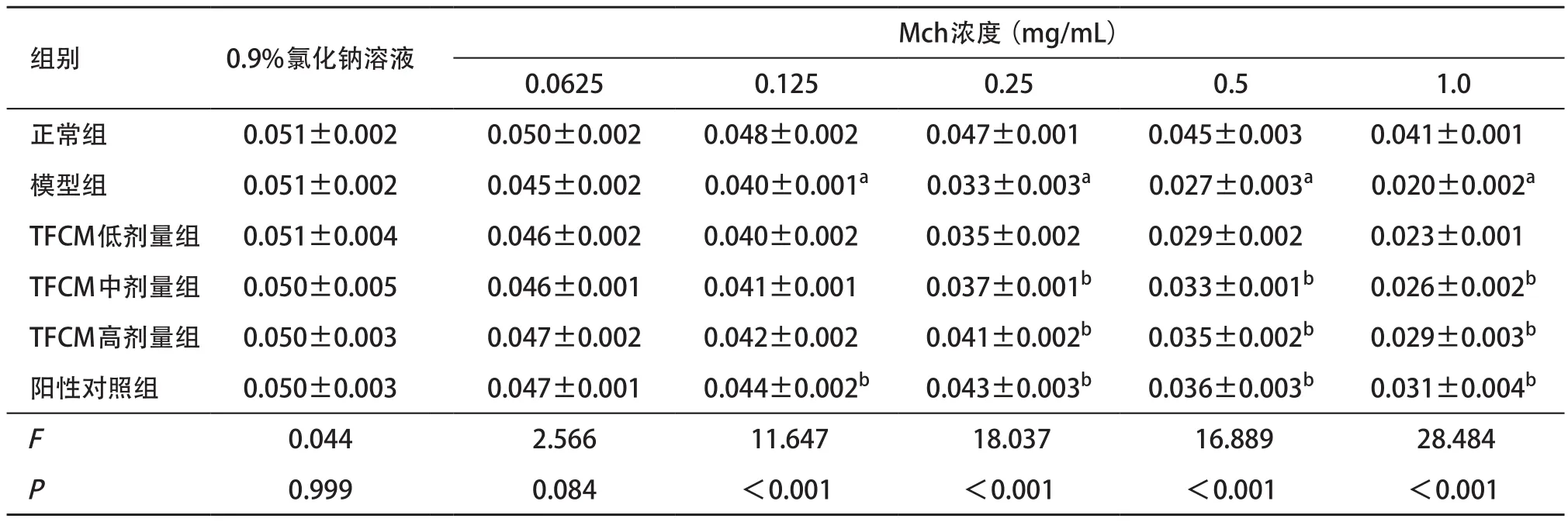
表2 各组小鼠不同剂量Mch激发时的肺顺应性比较(n=3, ,mL/cmH2O)
与正常组比:aP<0.05;与模型组比:bP<0.05
组别 0.9%氯化钠溶液 Mch浓度(mg/mL)0.0625 0.125 0.25 0.5 1.0正常组 0.051±0.002 0.050±0.002 0.048±0.002 0.047±0.001 0.045±0.003 0.041±0.001模型组 0.051±0.002 0.045±0.002 0.040±0.001a0.033±0.003a0.027±0.003a0.020±0.002aTFCM低剂量组 0.051±0.004 0.046±0.002 0.040±0.002 0.035±0.002 0.029±0.002 0.023±0.001 TFCM中剂量组 0.050±0.005 0.046±0.001 0.041±0.001 0.037±0.001b0.033±0.001b0.026±0.002bTFCM高剂量组 0.050±0.003 0.047±0.002 0.042±0.002 0.041±0.002b0.035±0.002b0.029±0.003b阳性对照组 0.050±0.003 0.047±0.001 0.044±0.002b0.043±0.003b0.036±0.003b0.031±0.004bF0.044 2.566 11.647 18.037 16.889 28.484P0.999 0.084 <0.001 <0.001 <0.001 <0.001
表3 各组小鼠BALF中总细胞及白细胞分类计数(n=7, ,105/mL)

表3 各组小鼠BALF中总细胞及白细胞分类计数(n=7, ,105/mL)
与正常组比:aP<0.05;与模型组比:bP<0.05
组别 细胞总数 淋巴细胞 中性粒细胞 嗜酸性粒细胞 巨噬细胞正常组 4.32±0.39 0.62±0.04 0.26±0.22 0.43±0.03 1.80±0.19模型组 29.19±3.05a3.34±0.45 2.10±0.34a5.81±0.32a9.36±0.87aTFCM低剂量组 26.24±2.34 2.09±0.27 1.43±0.08b5.24±0.30b8.94±0.22 TFCM中剂量组 21.63±2.54b1.86±0.12 1.17±0.26b4.75±0.40b7.95±0.41bTFCM高剂量组 15.57±2.42b1.29±0.12 0.72±0.12b3.51±0.25b6.77±0.42b阳性对照组 14.91±1.78b1.11±0.03 0.58±0.21b3.22±0.38b6.14±0.38bF48.075 23.482 27.081 120.752 103.557P<0.001 <0.001 <0.001 <0.001 <0.001
表4 各组小鼠BALF中IL-4、IL-5、IL-13、Eotaxin水平比较(n=7, ,pg/mL)

表4 各组小鼠BALF中IL-4、IL-5、IL-13、Eotaxin水平比较(n=7, ,pg/mL)
与正常组比:aP<0.05;与模型组比:bP<0.05
组别 IL-4 IL-5 IL-13 Eotaxin正常组 56.24±11.36 32.40± 7.61 19.29±3.85 750.61±156.51模型组 83.14±10.28a113.32±19.29a66.26±6.67a2 092.17±157.29aTFCM低剂量组 76.58± 4.26b105.16±15.58 57.27±6.87b1 878.16± 59.05bTFCM中剂量组 72.61± 5.70b 88.25±10.81 51.50±4.06b1 663.61±113.33bTFCM高剂量组 66.81± 5.22b 76.81± 8.83b40.65±5.66b1 149.66±137.16b阳性对照组 58.70± 4.58b 53.06± 6.38b36.98±4.28b1 203.73±107.23bF11.752 38.004 57.644 96.208P<0.001 <0.001 <0.001 <0.001
2.5 HE染色 HE染色观察发现,正常组小鼠肺组织气道周围无炎性细胞浸润,其余部位亦无异状;模型组气道周围有大量炎性细胞浸润,且可见支气管管壁增厚,肺泡间隔增宽;各TFCM剂量组气道周围炎性细胞浸润较模型组减少,其他气道炎症症状减轻,高剂量组尤为明显,更接近正常组,见图1。
2.6 AB-PAS染色 与正常组比,模型组小鼠黏液分泌显著增多,支气管壁上皮细胞增多且伴随杯状细胞增生;TFCM各剂量组与模型组相比小鼠肺组织黏液分泌和杯状细胞增生减少,且高剂量组尤为明显,见图2。
3 讨论

表5 各组小鼠血清中IgE浓度以及BALF中MUC5AC、MUC5B表达水平(n=7,
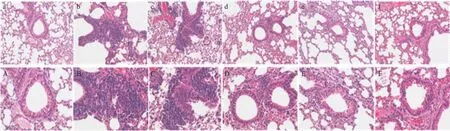
图1 各组小鼠肺组织HE染色结果(a-f:×200;A-F:×400)

图2 各组小鼠肺组织AB-PAS染色结果(a-f:×200;A-F:×400)
桑白皮具有降血脂、抗氧化、抗炎症、抗菌和抗病毒等特性,在传统医学中广泛用于糖尿病和高血脂的治疗。有研究表明桑白皮提取物口服治疗可以降低非酒精性脂肪肝合并2型糖尿病大鼠的血脂水平并逆转胰岛素的耐受性[13]。目前已有研究探讨桑白皮提取物对小鼠哮喘气道炎症的作用,发现桑白皮提取物可以通过促进哮喘模型小鼠CD4+、CD25+T细胞的产生以及抑制Th2细胞炎性因子分泌来发挥平喘作用[14]。本研究发现桑白皮中提取的总黄酮可以明显缓解哮喘小鼠的气道炎症症状。在TFCM给药后,小鼠气道高反应性症状减轻,另外肺组织炎性细胞浸润、黏液分泌、杯状细胞增生较模型组减少,气道炎症反应症状明显缓解。同时还观察到IL-4、IL-5、IL-13、Eotaxin、IgE水平下降,细胞总数、中性粒细胞、嗜酸粒细胞、巨噬细胞数量减少,说明TFCM可以抑制炎性因子、嗜酸性粒细胞趋化因子的产生及炎性细胞的浸润,从而起到缓解哮喘的作用。此外,哮喘发生的一个重要病理生理特征就是气道黏液高分泌。在炎症和其他因素刺激下,气道上皮杯状细胞会产生过度的黏液,而黏蛋白MUC5AC、MUC5B是气道黏液中的重要黏蛋白,其表达水平的高低可以反映杯状细胞的增生程度[15-16]。 本研究通过对哮喘小鼠肺组织AB-PAS染色观察到哮喘小鼠气道黏液分泌明显增加,杯状细胞增生,而在TFCM给药后,小鼠气道黏液分泌减少。同时对小鼠BALF中黏蛋白MUC5AC、MUC5B的表达水平测定发现,和正常组相比,哮喘模型组小鼠BALF中黏蛋白表达水平显著增加,而在TFCM给药后这2种蛋白表达水平显著下降。
综上所述,TFCM可以通过降低过敏性哮喘小鼠气道高反应,减少中性粒细胞、嗜酸性粒细胞、巨噬细胞浸润,下调IL-4、IL-5、IL-13、Eotaxin水平以及IgE表达水平来缓解气道炎症。

