长链脂肪乳剂预处理对大鼠心肌缺血再灌注损伤的保护作用
董娇娇,夏芳芳,金周晟,张裕坚,刘乐
(温州医科大学附属第一医院 麻醉科,浙江 温州 325015)
体外循环心脏直视手术及经皮冠状动脉介入治疗不可避免地造成了心肌缺血再灌注(ischemia/reperfusion,I/R)损伤[1]。Intralipid是以大豆油为基础的长链脂肪乳剂,是世界上第一个安全应用于人体的脂肪乳剂。Intralipid后处理对心肌I/R损伤的保护机制主要涉及再灌注损伤补救激酶通路、脂肪酸氧化增强心肌收缩力等[2-3]。本研究通过构建在体大鼠心肌I/R模型,监测大鼠血流动力学、心肌梗死面积和乳酸脱氢酶(lactate dehydrogenase,LDH)释放量,探讨Intralipid缺血前短期预处理的保护作用。
1 材料和方法
1.1 材料
1.1.1 实验动物与分组:成年雄性SD大鼠,体质量180~200 g,购自上海斯莱克实验动物有限责任公司,动物许可证号:SCXK(沪)2012-0002。实验前禁食12 h,自由饮水。采用随机数字表法分为3组(每组7只):假手术组(Sham组)、模型组(Model组)、长链脂肪乳剂组(LE组)。Sham组不予以任何药物处理,建模时只穿线不结扎冠状动脉左前降支(left anterior descending,LAD);Model组于造模前予以0.9%氯化钠溶液2 mg·kg-1·d-1尾静脉注射5 d;LE组于造模前予以Intralipid 2 mg·kg-1·d-1尾静脉注射5 d,2组末次给药后24 h建立大鼠左前降支结扎I/R模型。
1.1.2 试剂与仪器:Intralipid(批号:801H081,无锡华瑞制药有限公司),LDH测试盒(A020-2型,南京建成生物工程研究所),穿刺针(14 G, Introcan-W,马来西亚B.Braun公司),动物呼吸机(HX-300型,成都泰盟科技有限公司),生物信号采集系统(Medlab-U/4C051,南京美易科技有限公司),Mer-silk慕丝缝线(上海强生医疗器材有限公司),光吸收全波长酶标仪(瑞士Tecan Infinite公司)。
1.2 方法
1.2.1 建立大鼠心肌I/R损伤模型:末次给药后24 h, 将SD大鼠行水合氯醛(350 mg/kg)腹腔基础麻醉加七氟烷(1%~2%)吸入维持麻醉。待动物麻醉后,切开气管置入14 G穿刺针外套管,连接小动物呼吸机。呼吸参数设定:潮气量=6 mL·kg-1,呼吸频率=68次/min, 呼吸比3:2,FiO2100%。控制体温在38~39 ℃。开放左股静脉补充生理需要量(5 mL·kg-1·h-1),左股动脉切开置管,连接生物信号采集系统,测定平均动脉压(mean arterial pressure,MAP)、心率(HR)、心率与收缩压的乘积(rate-pressure product,RPP)。操作结束后平衡15 min,将大鼠左侧胸壁逐层离断,结扎并移除第3、4肋骨,调整呼吸机参数:
1.3 统计学处理方法 采用SPSS19.0统计软件进行数据分析。计量资料用表示,多组间比较用单因素方差分析,组间两两比较用LSD-t法。不同时间点间比较用重复测量方差分析,两两比较用Bonferroni法。P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠基础状态比较 3组大鼠的体质量及血流动力学基础值比较,差异无统计学意义(P>0.05),见表1。
2.2 3组大鼠梗死面积及LDH比较 再灌注120 min末Model组和LE组AAR/LV均显著低于Sham组,差异有统计学意义(P<0.05);Model组与LE组AAR/LV比较差异无统计学意义(P>0.05);Model组和LE组的IR/AAR和IR/LV均显著高于Sham组,差异有统潮气量=7.5 mL·kg-1,呼吸频率=68次/min,呼吸比3:2,FiO2100%。打开心包直视下将6-0 Mersilk慕丝缝线结扎LAD。结扎成功标志:心电图ST段抬高、R波增宽加深及LAD供血区心肌颜色变为紫白色。结扎成功后,用橡胶薄膜贴附在胸壁开口处,消除开放性气胸。结扎缺血30 min后,松开结扎线再灌注120 min。
1.2.2 观察血流动力学指标:记录3组平衡末(基础值),缺血期0、5、10、15、20、25、30 min,再灌注期0、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120 min时的HR、MAP、RPP。
1.2.3 伊文思蓝(EB)-2,3,5一氯化三苯基四氮唑(TTC)染色法确定心肌梗死面积:再灌注期末,结扎丝线,经左股动脉取血后,注射2.5 mL 2% EB染料。待结扎区外心肌染为蓝色后,沿心底部剪下心脏,冲洗后放入-20 ℃冰箱冷冻25~30 min。取出后将结扎线以下部位切2 mm薄片,共5片。放入含有1%的TTC冻存管中超声波振动10 min,取出冲洗并放入4%甲醛中固定6~8 h后拍照保存,梗死面积用Image-Pro Plus 6.0图像分析软件分析并计算危险区心肌占左室面积百分比(AAR/LV)、梗死面积占危险区心肌百分比(IR/AAR)、梗死面积占左室面积百分比(IR/LV)。
1.2.4 检测血清LDH:再灌注期末经股动脉取血 3 mL,3 500×g,4 ℃离心15 min,取上清液于 -80 ℃冰箱保存,采用光吸收全波长酶标仪测定血清LDH含量。计学意义(P<0.05);与Model组比,LE组IR/AAR和IR/LV显著减少,差异有统计学意义(P<0.05);Model组和LE组血浆LDH浓度均显著高于Sham组,差异有统计学意义(P<0.05);与Model组比较,LE组血浆LDH浓度明显降低,差异有统计学意义(P<0.05),见表2。
表1 3组大鼠的体质量和血流动力学基础值(每组n=7, )

表1 3组大鼠的体质量和血流动力学基础值(每组n=7, )
组别 体质量(g) HR(beat·min-1) MAP(mmHg) RPP(mmHg·beat·min-1)Sham组 278±16 380±30 90± 9 44 537±4 441 Model组 276±14 413±36 84±16 43 339±9 966 LE组 268±17 404±49 78±13 41 903±3 469F0.777 1.360 1.500 0.279P0.475 0.282 0.250 0.760
2.3 3组大鼠缺血期及再灌注期不同时间点HR比较 Model组和LE组大鼠缺血期及再灌注期HR均呈先升高后降低,3组间缺血期及再灌注期HR比较差异均无统计学意义(P>0.05),见图1。
表2 3组再灌注120 min末AAR/LV、IR/AAR、IR/LV及血浆LDH的比较(每组n=7, )
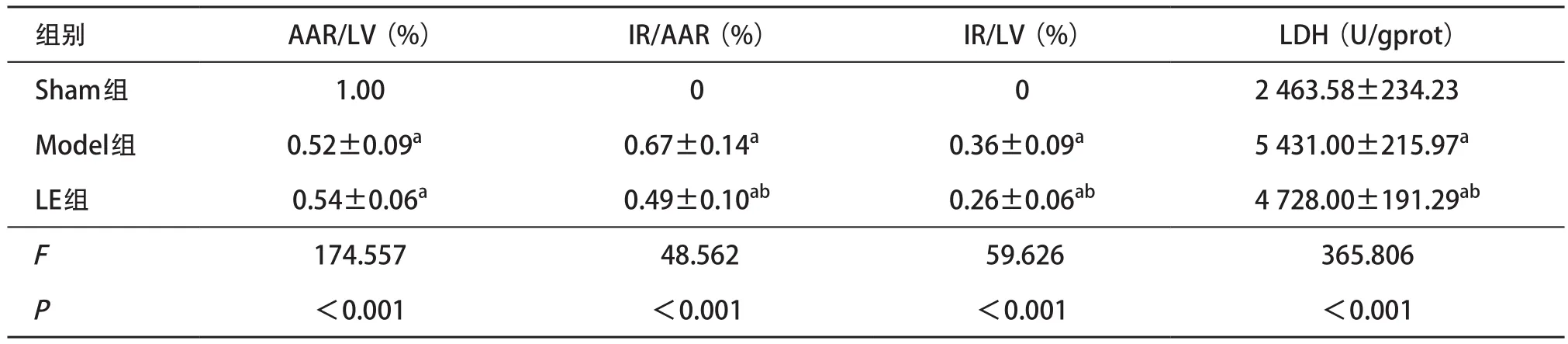
表2 3组再灌注120 min末AAR/LV、IR/AAR、IR/LV及血浆LDH的比较(每组n=7, )
与Sham组比:aP<0.05;与Model组比:bP<0.05
组别 AAR/LV(%) IR/AAR(%) IR/LV(%) LDH(U/gprot)Sham组 1.00 0 0 2 463.58±234.23 Model组 0.52±0.09a0.67±0.14a0.36±0.09a5 431.00±215.97aLE组 0.54±0.06a0.49±0.10ab0.26±0.06ab4 728.00±191.29abF174.557 48.562 59.626 365.806P<0.001 <0.001 <0.001 <0.001

图1 3组缺血期(A)及再灌注期(B)不同时间点HR图
2.4 3组大鼠缺血期及再灌注期不同时间点MAP比较 Model组在缺血期(5、10、15、20、25、 30 min)MAP显著低于Sham组,差异有统计学意义 (P<0.05),见图2A;Model组在再灌注期(除80、95、100、115 min外)MAP显著低于Sham组,差异有统计学意义(P<0.05),见图2B;与Sham组比,LE组缺血期及再灌注期MAP差异无统计学意义(P>0.05),见图2。
2.5 3组大鼠缺血期及再灌注期不同时间点RPP比较 Model组在缺血期(10、15、20、25、30 min)RPP显著低于Sham组,差异有统计学意义(P< 0.05),见图3A;Model组在再灌期(10、20、30、35、40、45、50、55、60、65、105、120 min)RPP显著低于Sham组,差异有统计学意义(P<0.05),见图3B;与Sham组比,LE组缺血期及再灌注期RPP差异无统计学意义(P>0.05),见图3。
3 讨论
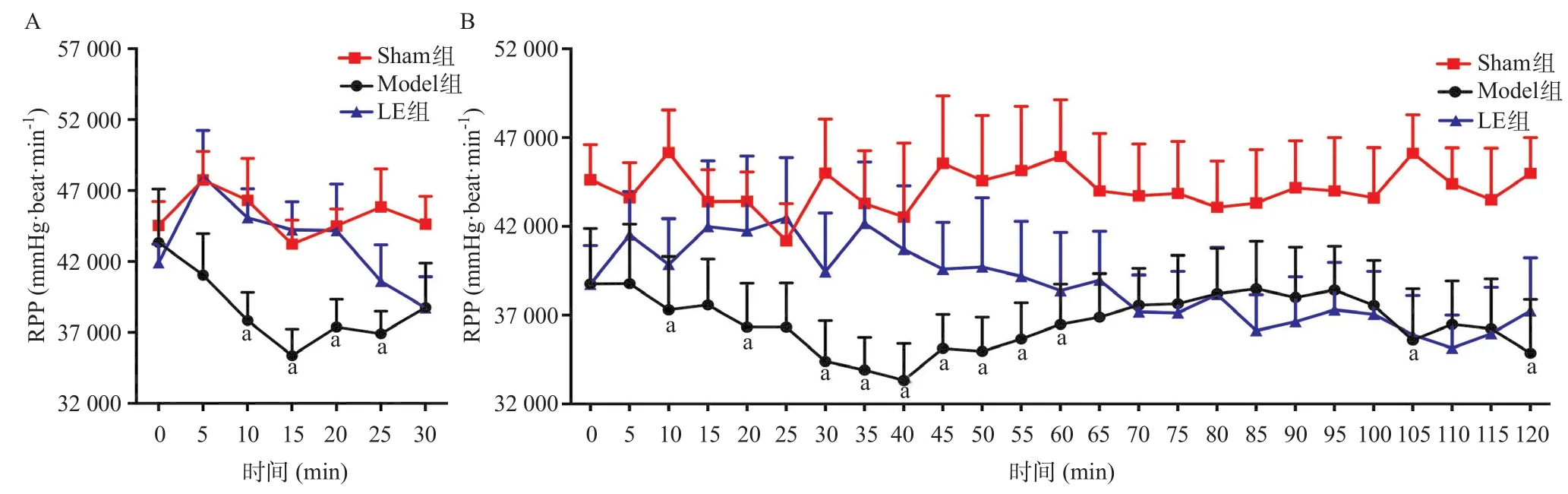
图3 3组缺血期(A)及再灌注期(B)不同时间点RPP图
大鼠LAD结扎30 min再灌注120 min模型目前被广泛应用于心肌I/R的相关研究[4],EB-TTC染色后计算得到的心肌梗死面积相关指标是判断心肌I/R损伤最常见的指标[5]。本课题组在之前的研究中采用Intralipid和布比卡因共同孵育心肌细胞24 h,发现Intralipid能够逆转布比卡因引起的心肌细胞膜流动性的降低[6]。20%的Intralipid中含有200 g·L-1甘油三酯,其中52%为ω-6亚油酸,8%为ω-3亚麻酸。有研究证实ω-6和ω-3多不饱和脂肪酸通过改变细胞膜的完整性和流动性从而激活重要的生物介质,进而调节细胞凋亡、炎症介质、免疫应答等途径的细胞信号传导[7]。细胞膜相结构的稳定对于再灌注损伤的保护起到重要作用。因此,认为Intralipid预处理通过改变膜磷脂成分维持细胞膜相结构稳定性,从而减小心肌I/R损伤后梗死面积,减少LDH的释放。
PAULSON等[8]通过灌注L-propionylcarnitine促进离体大鼠心肌细胞的脂肪酸氧化过程,提高心肌ATP浓度,结果显著促进了大鼠心肌I/R损伤后心肌收缩力的恢复。同时,有研究认为脂肪乳剂逆转布比卡因心脏毒性在于其正性肌力作用[9]。本研究中大鼠LAD结扎致使大鼠左心室结扎部位以下的心肌收缩力减弱,导致MAP急剧下降。然而LE组大鼠缺血期MAP下降不明显,在不考虑外周循环阻力和循环血流量发生变化的情况下,可以将LE组MAP的稳定归因于心肌收缩力变化小,从而表明LE组心肌对缺血缺氧的耐受力高于Model组,最终使得LE组缺血期RPP能够恢复至Sham组水平。缺血使得细胞内ATP减少,离子通道功能障碍,最终导致细胞钙超载并裂解死亡。LE组在缺血前Intralipid预处理 5 d,长链脂肪酸在体内经过氧化生成ATP,心肌ATP储备高于Model组,对缺血期ATP的耗竭起到重要的缓冲作用,从而减轻心肌损伤。另外,有研究认为低浓度的脂肪酸能够氧化生成ATP提供能量,而高浓度的脂肪酸则会加重细胞内钙超载从而引起细胞死亡[10],MONTI等[11]采用10、20、40 mg·mL-1甘油三酯进行离体大鼠心脏灌注,结果发现再灌注期心脏收缩和舒张功能随着甘油三酯灌注浓度的增加而变差,而本研究采用20% Intralipid 2 mg·kg-1·d-1预处理,考虑大鼠血液量占体质量约7%,计算得到Intralipid给药后大鼠体内甘油三酯最高血液浓度不超过5.71 mg·mL-1,显著低于MONTI等[11]采用的剂量。
缺血再灌注损伤和自由基攻击紧密相关,有研究表明长链脂肪乳剂的包裹机制有利于减少再灌注产生的脂溶性有害物质从而减轻远隔脏器的再灌注损伤[7]。再灌注期自由基大量产生,造成机体内环境紊乱,无氧代谢增加,血管麻痹,从而导致循环障碍。本研究结果示Model组再灌注初期0至 40 min MAP及RPP呈持续降低状态,而LE组再灌注期MAP和RPP水平均跟Sham组相仿,这和长链脂肪乳剂包裹再灌注期脂溶性有害物质密切相关。
本研究结果表明20% Intralipid 2 mg·kg-1·d-1预处理5 d能够显著减小大鼠心肌I/R损伤后心肌梗死面积,减少LDH释放,同时促进血流动力学恢复,并推论其保护机制可能包括以下三点:改变膜磷脂成分维持细胞膜稳定性、脂肪酸氧化提供能量以及脂肪乳剂包裹脂溶性有害物质。

