Linc01635对川崎病血管内皮细胞凋亡的影响
陈瑞瑶,荣星,吴婷婷,贾尝,吴蓉洲,褚茂平,张春祥
(温州医科大学附属第二医院育英儿童医院,浙江 温州 325027,1.儿童心脏中心;2.儿科研究所)
川崎病(Kawasaki disease,KD)是一种以全身性血管炎为主要病变的急性自限性疾病,病因不明,冠状动脉瘤是最严重的并发症[1-2]。既往研究表明内皮细胞损伤是KD发生发展的重要病理机制,但具体机制仍然不清楚[3-5]。长链非编码RNAs(lncRNAs)是一类长度大于200 nt的RNA,具有强大的生物学功能[6-9]。目前尚未见关于KD血浆对血管内皮细胞中lncRNAs表达的影响和lncRNAs在KD诱导的血管内皮损伤中的潜在作用的报道。Linc01635(ENST00000455966.1,chr1:22023994-22024968)是基因间lncRNA,长度为615 bp。Linc01635在内皮细胞中的生物学功能目前尚不清楚。我们的初步实验发现,与对照组相比,KD患者血浆培养的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)中linc01635表达明显降低。HUVECs中的linc01635在KD血浆培养下表达量降低可能与细胞损伤有关,本研究探讨linc01635在KD诱导的内皮细胞凋亡中的作用。
1 材料和方法
1.1 细胞株和主要试剂 HUVECs购自江阴齐氏生物科技有限公司;TRIzol试剂和Lipofectamine 3000购于美国Invitrogen公司;胎牛血清和高糖DMEM培养基购于美国Gibco公司;引物、siRNA和FISH试剂盒购于广州锐博公司;Annexin V PE流式试剂盒购于美国Becton Dickinson公司;PrimeScriptTMRT Master Mix购于日本TaKaRa公司;SYBR Green和96孔板购于美国BIORAD公司;慢病毒购于上海汉恒生物科技公司;4%多聚甲醛、无水乙醇和异丙醇购于上海化学试剂总厂。
1.2 方法
1.2.1 血浆标本采集:根据美国儿童心脏协会制定的诊断标准确诊KD急性期的患者[1],收集2018年11月至2019年1月温州医科大学附属第二医院育英儿童医院10例急性期KD患者的血浆,以及年龄和性别相匹配的10例健康儿童血浆。本研究经温州医科大学附属第二医院育英儿童医院伦理委员会批准,所有入组者家属知情同意并签署同意书。
1.2.2 细胞培养和血浆刺激:有研究报道,HUVECs 可用于KD的血管内皮研究[4,10],所以本研究将 HUVECs作为体外模型。用含10%胎牛血清的高糖DMEM培养液,在37 ℃,5% CO2恒温细胞培养箱中培养。用含10% KD患者血浆或10%健康儿童血浆的DMEM培养液刺激HUVECs,分别为KD组和HC组,24 h后弃去培养液收集细胞。
1.2.3 qRT-PCR:按照TRIzol试剂说明书提取细胞总RNA。使用PrimeScriptTMRT Master Mix将RNA反转录成cDNA,使用CFX96TM Real-Time系统进行qRT-PCR分析。GAPDH作为内参,通过比较循环数,计算mRNA和lncRNA的相对表达情况。引物序列(5’-3’):GAPDH:FAACTCTGGTAAAGTGGATATTG(F),RGGTGGAATCATATTGGAACA(R);linc01635:GCTGGCA TATCCGAATGG(F),GCAGTGGCAATGTTGACA(R)。
1.2.4 荧光原位杂交(FISH):RNA FISH使用结合Cy3的linc01635探针、人U6 FISH探针和人18S FISH探针,根据RiboTM荧光原位杂交试剂盒进行操作。采用共聚焦显微镜(日本尼康公司)获取图像。
1.2.5 Linc01635敲减或过表达:使用Lipofectamine 3000试剂将100 nmol/L linc01635 siRNA(5’-GGGCTG AGCTACCGGATTA-3’)或阴性对照siRNA转染到HUVECs。转染24 h后,采用qRT-PCR检测敲减效率。用带有linc01635全长序列的慢病毒感染HUVECs(MOI 30), 48 h后,在荧光显微镜下观察细胞感染效率,采用qRT-PCR检测过表达效率。
1.2.6 细胞凋亡检测:HUVECs经慢病毒过表达linc01635(LV-linc01635)、慢病毒过表达阴性对照(LV-NC)、siRNA敲减linc01635(si-linc01635)或siRNA敲减阴性对照(si-NC)处理后,用100 μmol/L TBHP诱导凋亡,24 h后消化收集细胞,用Annexin V PE和7-AAD避光孵育,使用流式细胞仪检测细胞凋亡。
1.3 统计学处理方法 采用SPSS21.0软件进行分析。计量资料以表示,2组比较采用独立样本t检验,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 Linc01635在HUVECs中的亚细胞定位 利用生物信息学网站(www.csbio.sjtu.edu.cn/bioinf/ lncLocator)分析,预测linc01635主要分布于细胞核(61.4%)和细胞质(33.0%)[11]。采用RNA FISH技术检测,发现linc01635在HUVECs中具有核质双重分布,见图1。
2.2 Linc01635在KD细胞模型中表达下降 与HC组比,KD组血浆培养的HUVECs中linc01635相对表达量下降,差异有统计学意义(P<0.01),见图2。
2.3 Linc01635对HUVECs凋亡的影响 LV-linc01635组linc01635表达量比LV-NC组高,silinc01635组linc01635表达量比si-NC组低,差异有统计学意义(P<0.05),见图3。流式细胞术分析显示,在TBHP诱导凋亡下,linc01635过表达抑制了HUVECs的凋亡,而linc01635敲减使HUVECs凋亡增加,差异有统计学意义(P<0.01),见图4。
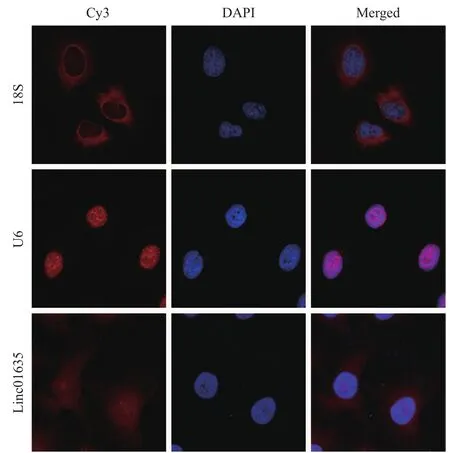
图1 Linc01635的RNA荧光原位杂交
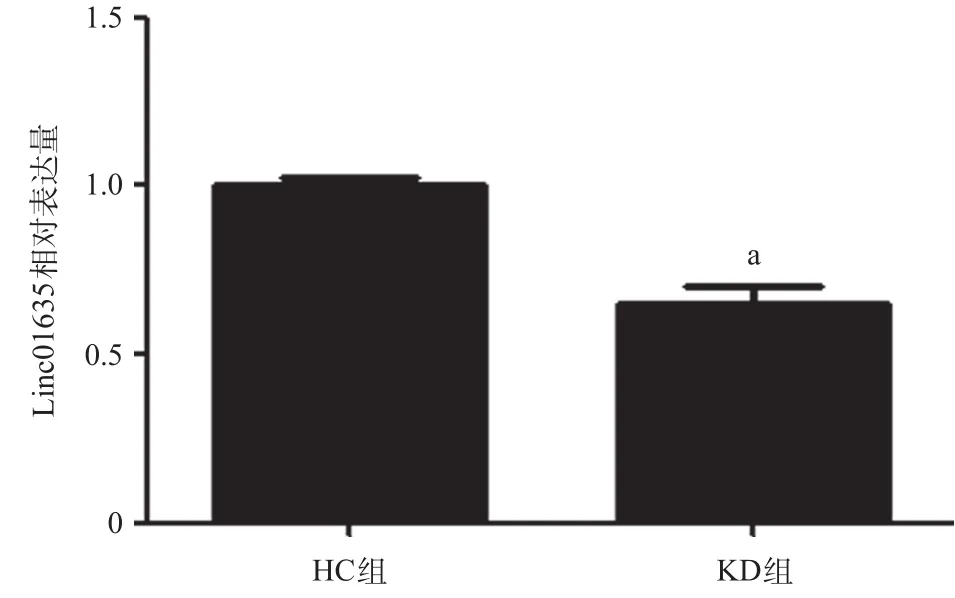
图2 2组血浆培养的HUVECs中linc01635的相对表达量比较
2.4 过表达linc01635抑制KD血浆诱导的HUVECs凋亡 本研究表明,KD血浆可以降低HUVECs中linc01635的表达,而linc01635能影响细胞凋亡。因此,我们推测linc01635的减少可能是KD诱导血管内皮细胞凋亡的一种新分子机制。为了验证这种推测,我们分别用10%的KD血浆和10%的健康对照血浆培养HUVECs。结果表明,KD血浆能促进HUVECs凋亡,而过表达linc01635能抑制KD血浆诱导的凋亡,差异有统计学意义(P<0.01),见图5。
3 讨论
KD已成为儿童获得性心脏病最常见的病因之一,而冠状动脉瘤等KD诱导的血管损伤已成为成人缺血性心脏病的重要危险因素[12]。血管内皮损伤是KD冠状动脉瘤的早期病理过程之一,但是KD血管损伤的病理机制尚不清楚[13-14]。
LncRNAs是一类非编码RNAs,在生理和病理过程中具有重要的生物学功能,包括心血管疾病[15-17]。 有研究表明,血液中的miRNAs在KD血管损伤中发挥重要的作用[4,18]。之前的几项研究发现,与健康儿童相比,KD患者血液中的lncRNA异常表达[19-20]。因此,血液中的lncRNA可能与KD有关。然而,KD血浆对血管内皮细胞中lncRNAs表达的影响及lncRNAs在KD诱导的血管内皮细胞损伤中的作用尚不清楚。
本研究发现经KD血浆培养的血管内皮细胞中,linc01635表达量明显降低。目前尚不清楚血管内皮细胞中linc01635表达量的降低是由linc01635转录水平降低引起的,还是向细胞外释放linc01635增多引起的,也可能是两者共同作用的结果,这需要后续的实验进行研究。关于linc01635在血管内皮细胞中的生物学功能,目前还未见报道。在本研究中,通过过表达和敲减linc01635,发现linc01635对血管内皮细胞具有调控凋亡的作用。为了验证linc01635在KD诱导的血管内皮细胞凋亡中的作用,我们分析了KD患者的血浆。研究发现,KD血浆可以诱导血管内皮细胞凋亡,而过表达linc01635可以抑制KD血浆诱导的血管内皮细胞凋亡。
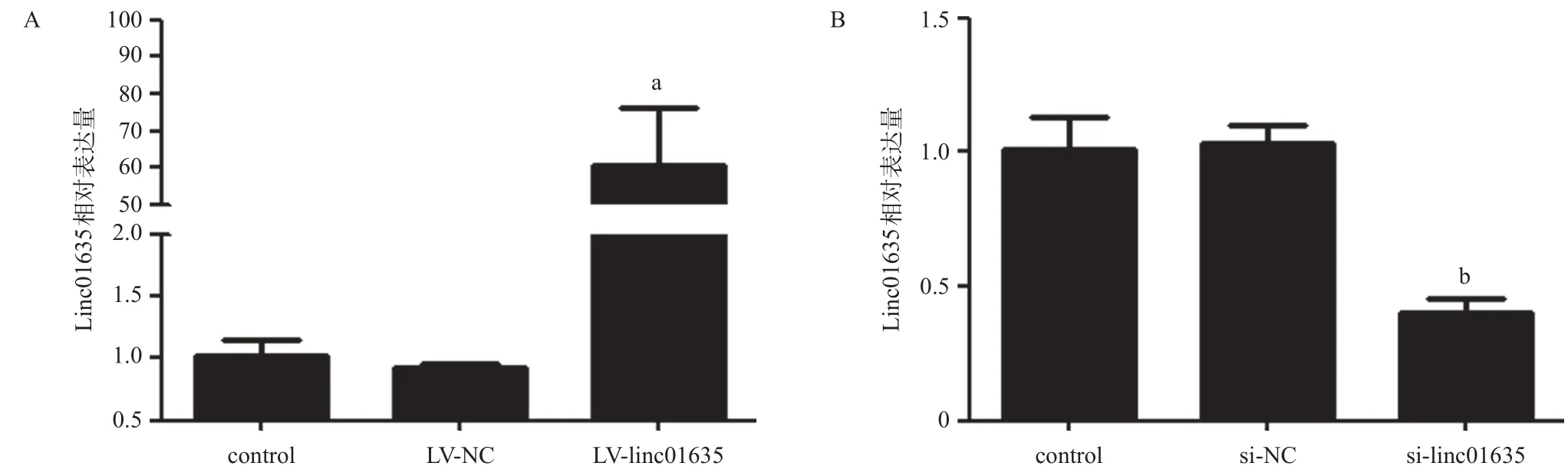
图3 HUVECs中慢病毒感染和siRNA敲减后linc01635的相对表达量
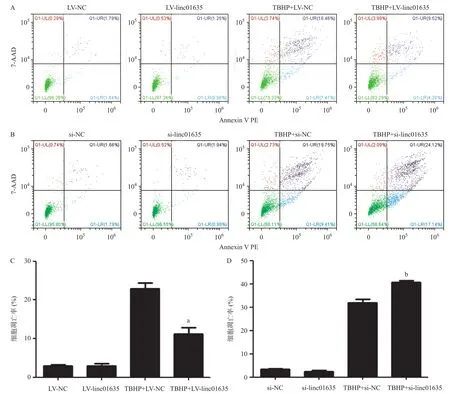
图4 流式细胞术检测linc01635对HUVECs凋亡的影响
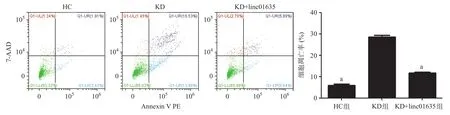
图5 流式细胞术检测linc01635对KD诱导的HUVECs凋亡的作用
综上所述,本研究发现KD血浆处理会导致血管内皮细胞中linc01635表达量下降,而linc01635表达量的减少会促进血管内皮细胞凋亡。Linc01635可能是治疗KD血管损伤的新靶点。

