RSK2通过调控人皮肤成纤维细胞的增殖与迁移促进皮肤创面修复
汪佳男,朱忠欣,丛维涛
(温州医科大学 药学院,浙江 温州 325035)
皮肤对机体发挥着重要的屏障作用,一方面皮肤可以使机体内的组织器官免受诸如物理性、机械性损伤或病原微生物等侵害,另一方面调节机体内水、电解质等物质的动态平衡,保持内环境稳定。作为人体第一道防线,皮肤易受损伤(如烧伤、慢性疾病等),从而失去屏障效应,诱发感染,严重时可致残致死[1-3]。因此,加快皮肤的创面修复,无论是在伤口难愈的疾病还是在术后修复中均具有十分重要的临床意义[4]。
RSK2,即p90核糖体蛋白s6激酶,在多种细胞中均有表达。RSK2能够应答多种生长因子、神经递质和环境压力等[5]。RSK2调控的下游底物包括:ATF1、ATF4(CREB2)等转录因子调控细胞转录[6];Caspase-8、IκB等信号分子抑制细胞凋亡、调节细胞活性[7];组蛋白3、组蛋白2AX等表观遗传因子调控细胞的增殖与分化[8-9]。RSK2目前在肿瘤领域中研究比较广泛,肿瘤诱导药物如佛波醇-12-十四烷酰-13-乙酸酯(TPA)可激活RSK2,进而诱发肿瘤病变[10]。LUDWIK等[11]发现,RSK2的核内聚集能够促进乳腺癌的肿瘤生成。尽管RSK2能够调控细胞的增殖与迁移,但其在皮肤创面修复中的研究却未见报道。基于上述研究背景,本研究探讨RSK2对小鼠皮肤创面修复的影响。
1 材料和方法
1.1 材料
1.1.1 实验动物:SPF级C57BL/6雄性小鼠购于浙江维通利华实验动物技术有限公司,饲养于温州医科大学实验动物中心,动物生产许可证号:SCXK(浙)2019-0001。小鼠体质量约25 g,约8周龄,标准动物饲料喂养,清洁饮水,自由取食。
1.1.2 主要试剂与耗材:一抗RSK2、Vimentin、Fibronectin、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)购于美国CST公司;Cyclin D1、血小板-内皮细胞黏附分子 (plateletendothelial cell adhesion molecule,CD31)购于美国Abcam公司;GAPDH购于合肥Biosharp公司。组织裂解液、BCA试剂盒购于上海碧云天生物技术有限公司;CCK-8试剂盒购于日本同仁化学研究所;ECL曝光液购于美国Millipore公司。
1.1.3 主要仪器:二氧化碳培养箱(美国Thermo公司)、-80 ℃超低温冰箱(德国Eppendorf公司)、低温高速离心机(美国Thermo公司)、高通量组织研磨仪(上海万柏公司)、细胞超声破碎仪(宁波新芝公司)、微量移液器(德国Eppendorf公司)、化学发光成像仪(美国GE公司)、激光共聚焦显微镜(德国Leica公司)、正置显微镜(日本Nikon公司)、倒置显微镜(日本Nikon公司)。
1.2 方法
1.2.1 人原代真皮成纤维细胞(human dermal fibroblast,HDF)的提取:选取温州医科大学附属第二医院育英儿童医院健康男性儿童的包皮组织,从中提取原代真皮成纤维细胞[12-13]。本研究征得患者及其家属的知情同意并签署知情同意书,并经医院伦理委员会批准。
1.2.2 细胞迁移实验:将HDF接种于48孔板,培养24 h。用枪头划直线,创伤+Bix 02565组加入Bix 02565共同孵育2 h,创伤对照组给予等体积0.9%氯化钠溶液,分别于0、12、24 h后用倒置显微镜拍摄各组细胞的迁移状况,以12 h或24 h划痕后面积变化作为细胞迁移速率。
1.2.3 CCK-8法检测细胞增殖活性:将HDF接种至96孔培养板内,密度控制在每孔2×103个细胞。待细胞贴壁,用枪头对创伤组别划痕,加入Bix 02565,培养2 h。每孔加入CCK-8试剂10 μL,培养箱中继续孵育2~3 h,酶标仪下测定450 nm波长处吸光度。每组均设空白对照组,各组测得的吸光度减去空白组的吸光度作为最终吸光度值。
1.2.4 Western blot实验:向经划痕造模的HDF中加入RSK2抑制剂Bix 02565(5 μmol/L)孵育2 h。HDF经裂解超声破碎后,于4 ℃、15 000 r/min离心15 min,取上清液检测蛋白浓度。将等量裂解蛋白经聚丙烯酰胺凝胶电泳分离,利用转膜仪将凝胶内蛋白转移至PVDF膜上。置于5%脱脂奶粉中室温封闭2 h,一抗4 ℃孵育过夜,二抗室温孵育2 h,用化学发光成像仪曝光。
1.2.5 实验动物模型的建立和分组:将24只雄性小鼠随机分为创伤对照组和创伤+Bix 02565组(Bix 02565:1 mg/kg)。小鼠用5%水合氯醛0.8 mL/100 g 剂量腹腔注射麻醉,脱去背部毛发后消毒,两侧使用内径为8 mm硅胶环固定,沿内径剪去全层皮肤。创伤+Bix 02565组在创伤造模基础上皮下注射RSK2抑制剂Bix 02565(1 mg/kg),每2天注射1次。创伤对照组于同一时间皮下注射等量0.9%氯化钠溶液。
1.2.6 创面修复速率检测:术后第0、第3、第7、第14天,每天同一时间记录创面修复状况,计算创面修复率。
1.2.7 皮肤组织HE染色:取下小鼠创面全层皮肤组织,经固定、石蜡包埋、脱蜡与水化后,切片(5 μm) 置于苏木精溶液1 min,流水冲洗1 min;置于伊红染液30 s,流水冲洗1 min;脱水、二透明、封片,正置显微镜拍摄。
1.2.8 皮肤组织Masson染色:皮肤切片用Bouin液37 ℃固定2 h,流水冲洗至无黄色;天青石蓝30 s, 稍水洗;苏木素染色2~5 min,稍水洗;酸性乙醇分化液数秒,流水冲洗3 min;丽春红品红染色液染色5~10 min,稍水洗;磷钼酸溶液洗10~15 min。 倾去液体,直接入苯胺蓝3~5 min。0.2%弱醋酸工作液2 min。脱水、透明、封片。
1.2.9 免疫荧光染色:皮肤切片置于含0.3% Triton X-100的PBS中室温通透20 min,PBS洗涤3次,每次5 min。含5% BSA的PBS封闭60 min。1% BSA的PBS配置一抗,室温孵育4 h。PBS漂洗3次,每次5 min。 1% BSA的PBS配置二抗,室温避光孵育1 h。PBS漂洗3次,每次5 min。DAPI染细胞核10 min,PBS漂洗2次,每次5 min。滴加抗荧光淬灭剂,封片,激光共聚焦显微镜下观察。
1.3 统计学处理方法 采用Graphpad Prism 5软件进行统计学分析,每组实验至少平行重复4次,计量资料以表示,2组间比较采用独立样本t检验,多组间采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 皮肤创伤对RSK2蛋白表达无影响 小鼠创伤造模后的第0(D0)、第3(D3)、第7(D7)天,利用Western blot实验检测创面及周围全层皮肤组织RSK2的蛋白表达。结果显示,创伤后第3和第7天创面皮肤组织中RSK2的蛋白表达与第0天相比差异无统计学意义(P>0.05),见图1A-B。免疫荧光染色并统计分析RSK2的荧光强度,与Western blot结果一致,创伤后第3和第7天创面皮肤组织中RSK2的荧光强度与第0天相比差异无统计学意义(P>0.05),见图1C-D。
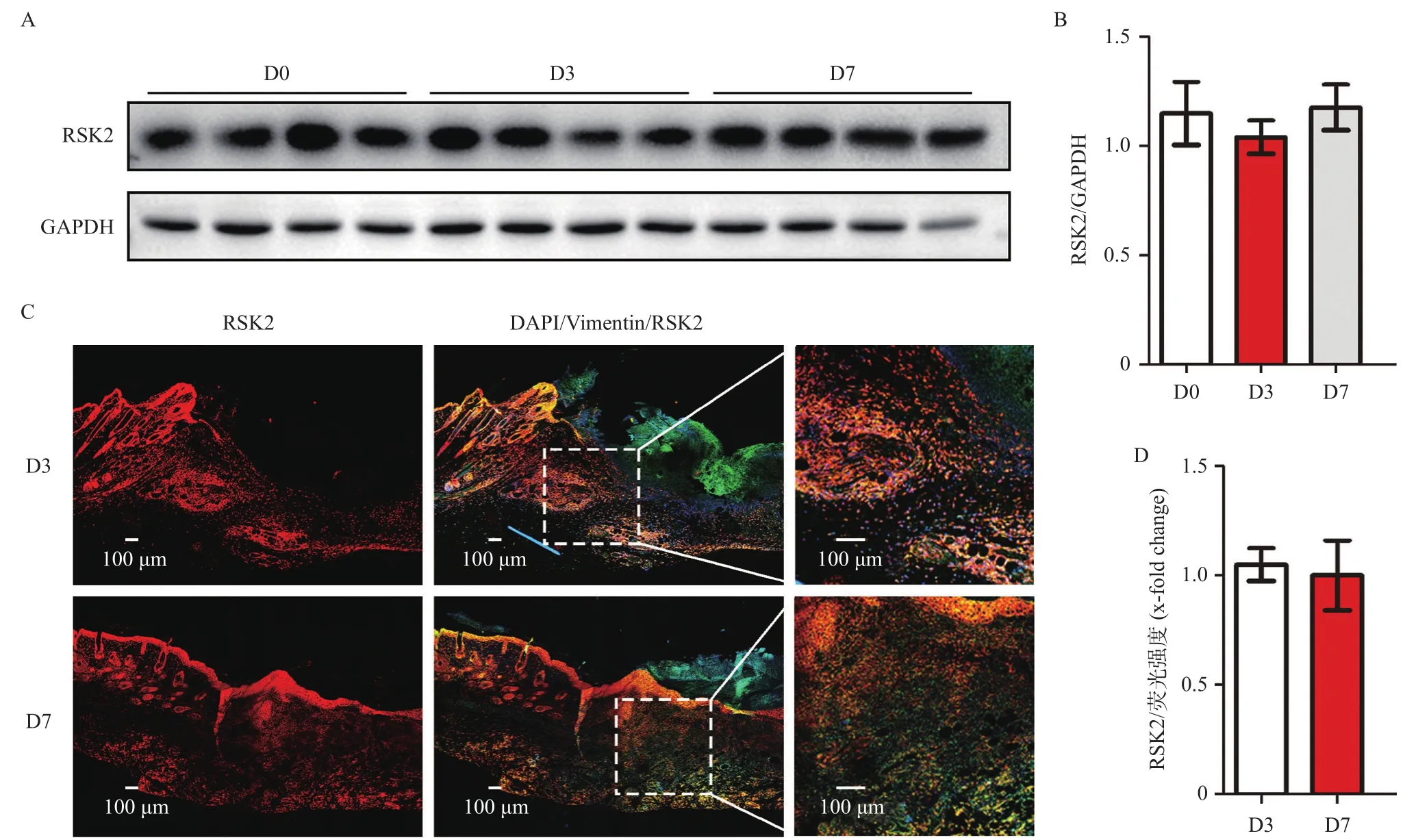
图1 创面皮肤组织中RSK2的蛋白表达与免疫荧光强度变化
2.2 Bix 02565抑制划痕诱导的HDF增殖与迁移 RSK2的抑制剂Bix 02565用于细胞划痕迁移实验,创伤+Bix 02565组的HDF在划痕后12 h及24 h,其中央创伤面积占比显著大于创伤对照组(P<0.05), 即Bix 02565抑制了HDF的迁移,见图2A。同时,CCK-8法检测HDF的增殖活性实验中,HDF经划痕刺激后的增殖活性显著强于创伤对照组,在Bix 02565 给药后增殖水平显著回落(P<0.01),而抑制剂本身并不影响细胞活性,见图2B。
将HDF总蛋白样品用于Western blot实验,结果表明,HDF在划痕刺激后Cyclin D1(G1/S-特异性周期蛋白-D1,指征增殖水平)及Fibronectin(纤维粘连蛋白,指征迁移水平)的蛋白水平均出现上调,而加入RSK2抑制剂Bix 02565可显著抑制细胞划痕诱导的Cyclin D1和Fibronectin的表达上调(P<0.05),图2C-D。
2.3 Bix 02565减缓小鼠皮肤创面修复速率 在小鼠皮肤创伤第0、第3、第7、第14天后,分别拍摄皮肤创面修复状况,2组均有不同程度的愈合,而给予Bix 02565后第3、第7天创伤面积所占百分比均显著大于创伤对照组(P<0.05),见图3。同时,将第3、第7天创面处全层皮肤组织进行HE染色和Masson染色。HE染色结果显示,创伤+Bix 02565组伤口大小在第3、第7天均大于创伤对照组,见图4A。Masson染色结果证实,创伤+Bix 02565组创面下方肉芽组织的胶原纤维(蓝色)含量远低于创伤对照组,而胶原纤维是由肌成纤维细胞分泌,提示成纤维细胞的增殖及分化不足,见图4B。
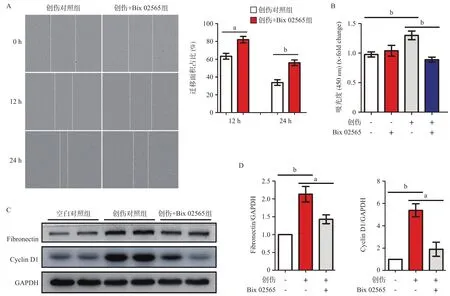
图2 Bix 02565抑制细胞划痕诱导的HDF增殖与迁移
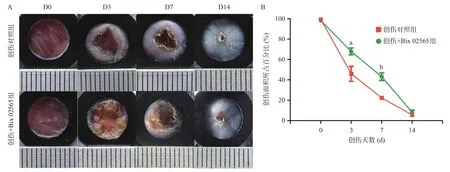
图3 Bix 02565减缓小鼠皮肤创面修复速率
2.4 Bix 02565抑制小鼠皮肤成纤维细胞的增殖与血管新生 小鼠创伤造模的第3、第7天对皮肤组织进行免疫荧光染色,分别检测创面新生肉芽组织中PCNA与CD31。结果显示2组PCNA荧光强度均随创伤天数增加逐渐增强,而创伤+Bix 02565组荧光强度显著弱于创伤对照组,且第7天差距最为显著(P<0.05),见图5A-B。检测创伤后第7天创面肉芽组织内的新生血管数量,结果显示创伤+Bix 02565组的新生血管内径显著小于创伤对照组,且新生血管数量也少于创伤对照组,见图5C。
3 讨论
皮肤是机体最大的器官,在机体中扮演重要的角色。而皮肤是最容易受到外界损伤的器官,创面修复是一个精确复杂、分时相的动态过程,涉及细胞增殖、迁移、胞外基质降解、血管新生和上皮组织重塑等多种细胞的网络调控[14-15]。各时期的过渡转化主要取决于所参与细胞的类型及新生细胞的成熟与分化,涉及的细胞包括成纤维细胞、角质细胞、内皮细胞和巨噬细胞等[16]。这些细胞通过增 殖、迁移、分化,与生长因子等信号通路共同作用重建皮肤[3]。其中,细胞增殖与迁移能够激发新的细胞外基质生成并且促进创面修复[17]。在这一过程中,尤其是成纤维细胞的增殖与迁移对肉芽组织形成和促进创面修复尤为关键[18],REINKE等[19]研究表明,成纤维细胞主要参与增殖期与组织重塑期。在增殖期,成纤维细胞大量增殖、迁移并形成肉芽组织,主要起到抵抗感染、添补创面等作用。同时,伤口周边的角质细胞经诱导迁移至创伤处,形成新生表皮组织。到组织重塑阶段,由成纤维细胞分化而来的肌成纤维细胞、内皮细胞及巨噬细 胞发生凋亡,最终真皮组织由细胞外基质蛋白所填补[20]。在保证机体自身修复质量的同时,使皮肤尽快恢复屏障功能一直是皮肤领域研究的热点所在。在之前的大量研究中,诸多激酶如Akt、STAT3、GSK-3α/β等都发挥着不可或缺的作用[21-23]。
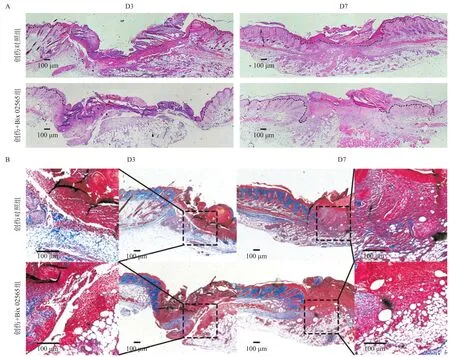
图4 小鼠创伤造模后第3、第7天创面皮肤切片组织HE染色和Masson染色结果
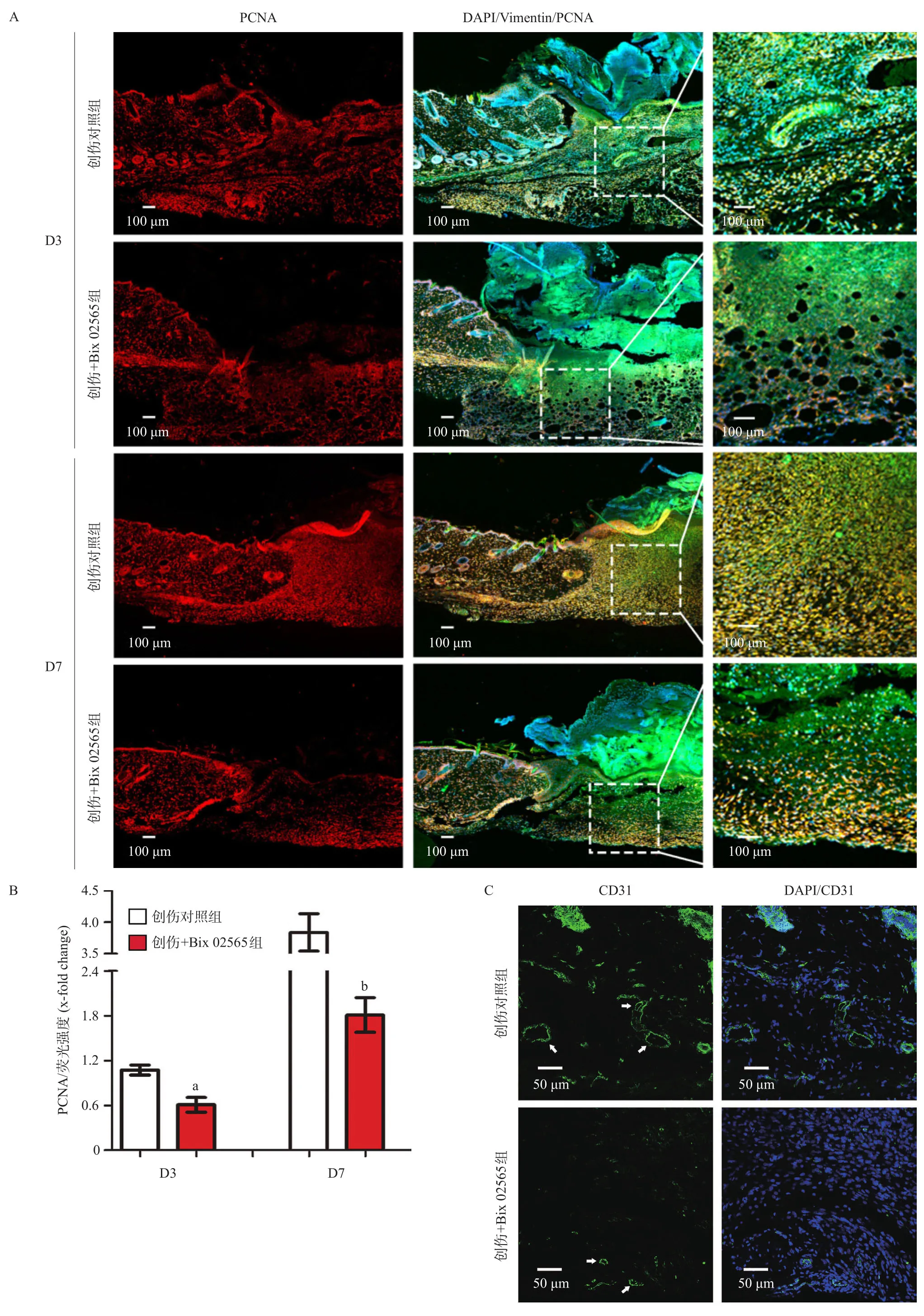
图5 Bix 02565抑制小鼠皮肤成纤维细胞的增殖与血管新生
RSK2作为20世纪末期发现的蛋白激酶[24],人们对于其功能的了解往往限于疾病的发生与发展中,而忽视其在维持机体平衡中的作用。本研究着重将RSK2与成纤维细胞和创面修复联系在一起。在研究过程中,我们发现皮肤创伤与RSK2的总蛋白表达并无直接联系。然而,进一步实验发现RSK2活性抑制剂Bix 02565可抑制成纤维细胞的迁移。为了进一步核实RSK2在皮肤创面修复中的作用,我们通过CCK-8试剂盒检测发现Bix 02565显著抑制了成纤维细胞的增殖水平,而其对正常细胞本身并无毒性作用。在Western blot实验中确证了增殖及迁移相关蛋白的表达亦被Bix 02565抑制。体内实验,我们建立C57BL/6小鼠皮肤创伤模型,探究RSK2在皮肤创面修复中的作用。结果发现Bix 02565显著减缓了皮肤的创面修复速率,抑制创面处肉芽组织胶原纤维的生成。同时,通过免疫荧光染色发现Bix 02565抑制了增殖相关蛋白的表达以及血管新生。基于上述实验结果,我们可以推断,尽管创伤并不影响RSK2本身的表达,但可能存在以下几种可能性:①创伤条件下成纤维细胞中RSK2的氨基酸位点发生修饰,在碳、氮末端激酶结构域(CTKD、NTKD)与中央铰链区(LD)均有可能出现丝氨酸、苏氨酸的磷酸化修饰,从而调节下游信号级联。②创伤影响了RSK2与下游蛋白的结合能力从而调节下游信号。③创伤改变了RSK2的亚细胞定位,例如入细胞核内调节信号。在创伤条件下,RSK2细胞内的具体机制与信号通路仍需要在下一步实验中进行探索。
RSK2是p90核糖体蛋白s6激酶,其功能的调控往往与细胞的增殖、迁移与分化有关,而这也奠定了其在整个机体调控中所扮演的角色。本研究着重发现皮肤创面修复与RSK2的关系,阐明了RSK2对于皮肤成纤维细胞功能的调控作用,然而,创伤如何通过RSK2调节成纤维细胞的活化以及去活化,以及RSK2如何调控皮肤成纤维细胞仍属未知。已有研究报道RSK2能够应答生长因子,例如在类风湿性关节炎中,bFGF诱导的FGFR3-RSK2信号激活可能通过促进成纤维样滑膜细胞的增殖与迁移和破骨细胞的生成从而起到关键作用[25]。YOO等[26]和HAMAOKA等[27]发现EGF能够通过RSK2激活ELK3(ELK家族)或EphA2 (Eph受体酪氨酸激酶成员)从而调节肿瘤细胞的增殖与转化。而已有文献报道bFGF与EGF均能够促进皮肤的创面修复[28-29],RSK2在创面修复中的作用是否与上述的信号存在相似的途径尚不明确,仍需要进一步探索。而我们有理由相信,随着科学技术不断的发展,理论研究的不断前进以及医疗水平的不断提高,创面修复这一课题将会越来越完善,饱受创伤困扰的患者也将得到更好的医治。

