大叶石蝴蝶植株再生体系的建立
盛耀莹,郑晟靖,庭禹洁,金 英,唐军荣
(1.红河哈尼族彝族自治州林业工作站,云南 蒙自 661100;2.红河州林业和草原调查规划队,云南 蒙自 661100;3.西南林业大学西南地区生物多样性保育国家林业和草原局重点实验室,云南 昆明 650224)
大叶石蝴蝶(PetrocosmeagrandifoliaW.T.Wang)是苦苣苔科(Gesneriaceae)石蝴蝶属(Petrocosmea)的多年生草本植物,分布于云南省镇康县[1]。石蝴蝶属植物叶形优美,植株花多且艳丽,近年来随着人为活动的影响,大多数本属植物均处于亟待保护状态[2]。大叶石蝴蝶作为该属植物中的一员,其叶片纸质,层叠分布,贴近土壤,并呈莲座状,其花色迷人且花期长,具有较高的观赏价值。大叶石蝴蝶分布区域窄,数量少,且在自然条件下繁殖速度慢。如何保护和利用好这一野生资源,最好的办法之一就是掌握其繁殖方法,扩大其种群数量。
植物组织培养作为植物的一种繁殖方法,具有繁殖速度快,所需材料少,能够保持母本的优良性状等诸多优点,已广泛应用于珍稀、优良材料扩繁[3]。采用植物组织培养技术对大叶石蝴蝶进行快繁,解决其种苗繁育慢的问题,为其野生资源数量的扩大提供技术支撑,同时有助于其开发利用,加速其产业化发展。目前关于大叶石蝴蝶的繁殖研究则未见相关报道。而在石蝴蝶属植物的组织培养研究方面仅见秦岭石蝴蝶、中华石蝴蝶的研究报道[4-5]。基于此,以大叶石蝴蝶的叶片为外植体,开展其植株高效再生体系的建立研究,最终建立大叶石蝴蝶的离体快繁体系,为大叶石蝴蝶资源保护、产业发展提供技术支撑。
1 材料与方法
1.1 材料
以大叶石蝴蝶的叶片为外植体,采自云南省镇康县。
1.2 方法
1.2.1无菌体系的建立
取大叶石蝴蝶的叶片,用洗洁精溶液清洗叶片表面的污垢,并在流水下冲洗干净,用75%的酒精进行表面消毒,然后转移至超净工作台内的无菌瓶中。倒入0.1%的升汞溶液振荡消毒,12 min后用无菌水冲洗3次,最后置于无菌纸上备用。切除外植体原有伤口,将叶片切成2 cm左右的方块,接种在MS+0.5 mg/L 6-BA+0.1 mg/L NAA+30 g/L蔗糖+5.0 g/L琼脂的分化培养基中,每瓶接种1个,共接种30瓶。培养室温度为25 ± 2℃,光照强度为2000 Lx,光照12 h/d(下同)。
1.2.2无菌苗叶片分化培养基的筛选
以上述启动培养基中获得的不定芽叶片为材料,进行植株再生体系的构建,所用基本培养基为MS,并附加不同浓度的激素。其中 6-BA(0.5 mg/L、1.0 mg/L、1.5 mg/L、2.0 mg/L)、NAA(0.1 mg/L、0.5 mg/L)进行两两组合,共8个处理,每个处理3次重复,每个重复接种20个叶片,50 d后对叶片分化情况进行统计。
1.2.3叶片切割方式及朝向对组培苗叶片分化的影响
以再生的大叶石蝴蝶试管苗叶片为材料,选取宽度大于1 cm 的叶片,对其进行横切(伤口垂直于叶片主脉)、纵切(伤口平行于叶片主脉)、斜切(伤口倾斜于叶片主脉)等3种方式制造伤口,比较不同切口方式对叶片分化的影响。此外,在叶片横切方式下比较叶片近轴面或远轴面朝下对叶片分化的影响。每个处理各接种5瓶,每瓶接种5个叶片。
1.2.4叶片大小对组培苗叶片分化的影响
以再生的大叶石蝴蝶试管苗的叶片为材料,分别选取宽度为0.5 cm左右以及宽度大于1 cm的叶片进行接种;各接种5瓶,每瓶接种5片叶片,观察叶片大小对大叶石蝴蝶叶片分化的影响。
1.2.5不定芽生根
以1/2MS为基本培养基,并附加不同浓度的NAA或IBA,选取高度在1 cm以上的单芽进行生根,培养基中均添加0.2 g/L 的活性炭(AC)。每种生长素分别设置4个浓度梯度(0.3 mg/L、0.6 mg/L、0.9 mg/L、1.2 mg/L),共8个处理。每个处理接种8瓶,每瓶接种6株,放入培养室中培养50 d,观察其生根率。
1.2.6生根苗的炼苗移栽
将生根的大叶石蝴蝶生根瓶苗从培养室转至室内自然光下培养10 d左右,取出生根苗,洗净附着在组培苗根部的培养基,移栽至准备好的基质上(腐殖土∶珍珠岩=5∶1),温度25℃左右,湿度80%左右。
1.2.7数据处理
采用IBM SPSS Statistics 22进行数据单因素方差分析(ANOVA),采用Duncan检验进行差异显著性分析。
2 结果与分析
2.1 启动培养
将叶片接种培养15 d后,未发生污染,但部分叶片由于消毒后受伤害开始失绿;继续培养30 d后,大部分叶片变成褐色并死亡,但其余存活叶片则在伤口处形成白绿色芽点;连续培养4个月后,不定芽逐渐发育长大,部分叶片舒展(图1)。获得不定芽的叶片作为离体快繁的再生材料,继续用于后续植株再生,从而实现材料的无限循环扩繁。
2.2 不同激素配比对大叶石蝴蝶组培苗叶片分化的影响
获得的无菌苗,其叶片与野生植株的叶片在生理结构上存在较大差别,因此,无菌苗叶片再生对分化的培养基与启动培养时的培养基会存在一定的差别。因此,为了优化无菌苗叶片再生体系,需要进一步优化6-BA与NAA的配比组合。将叶片接种在不同分化培养基中,培养21 d后,叶片伤口处出现白绿色芽点,即无菌苗叶片直接分化出不定芽。随着培养时间的延长,分化更加明显,培养至50 d时,可见大量的绿色不定芽产生(图2)。不同处理组合对叶片的分化结果见表1。


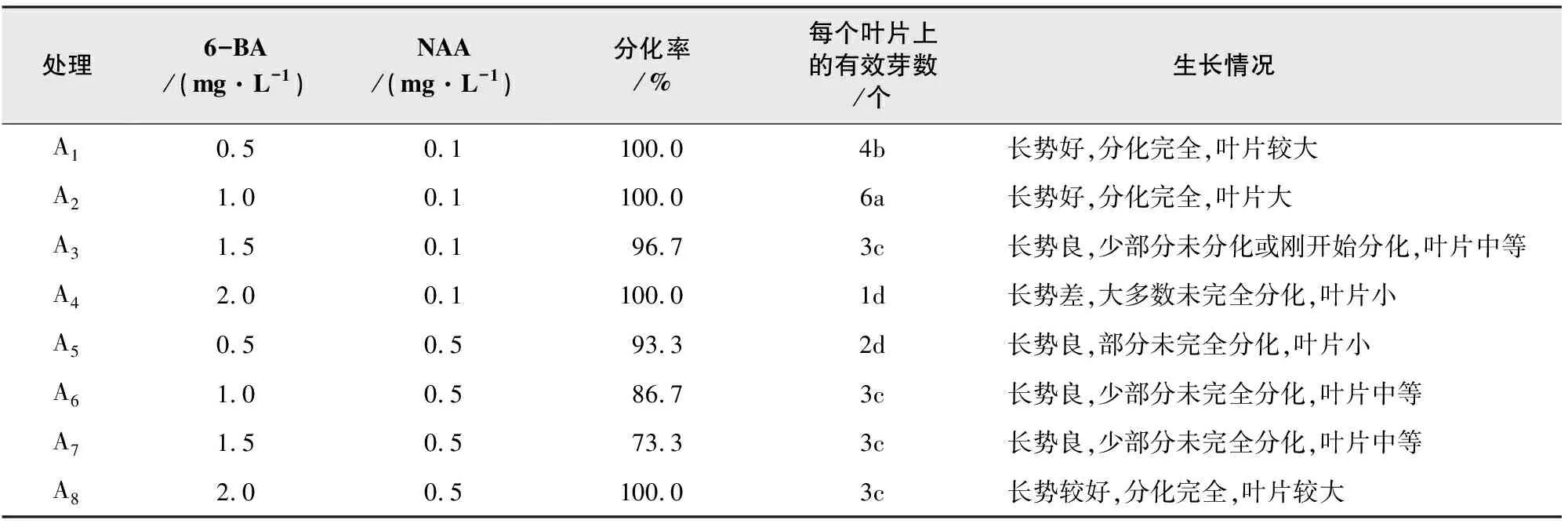
表1 不同激素配比对大叶石蝴蝶叶片分化的影响
注:表中同列不同小写字母表示差异显著(P<0.05)。
由表1可知,经过分化培养,A1、A2、A4、A8叶片的分化率可达到100%,但A4的长势差,分化的植株不具备生根能力。此外,对每个叶片的有效不定芽数进行分析比较,其中处理A2的数量显著高于其它处理,为6个,同时,不定芽叶片舒展,适合用于后续不定芽叶片再生的循环材料。综上所述,最适合无菌苗叶片分化的培养基配方为:MS+1.0 mg/L 6-BA+0.1 mg/L NAA+30 g/L蔗糖+5.0 g/L琼脂。
2.3 叶片切口方式对大叶石蝴蝶叶片分化的影响
横切、纵切、斜切的分化率分别为84%、80%、72%,可见横切的分化率更高,可形成大量芽丛(图3);斜切的分化率最低,芽丛稀疏。横切伤口垂直于主脉,每条伤口都经过主脉;纵切平行于主脉,部分伤口直接位于主脉;斜切时,部分伤口会经过主脉,但大部分伤口较短,未伤及主脉。综上所述,叶片横切更有利于叶片伤口处形成不定芽。
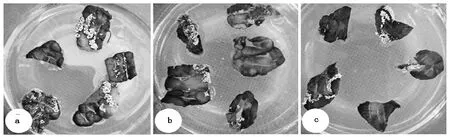
a:横切;b:纵切;c:斜切
2.4 叶片朝向对大叶石蝴蝶叶片分化的影响
叶片远轴面朝下和近轴面朝下分化效果如图4所示。
由图4可以看出,叶片远轴面朝下,其分化效果明显要优于近轴面朝下。远轴面朝下的接种方式在培养21 d时出现绿色团状物,40 d时形成大量芽丛,其分化率达88%;近轴面朝下的接种方式形成的芽丛极少,其分化率为60%。由此可见,远轴面朝下更有利于叶片伤口处形成不定芽。
2.5 叶片大小对大叶石蝴蝶叶片分化的影响
接种40 d后,宽度大于1 cm的幼嫩叶片分化效果优于宽度为0.5 cm左右的叶片(图5)。较大叶片的分化率为88%,较小叶片的分化率为80%。说明叶片大小即叶片的发育程度会影响不定芽的分化效果。这可能是由于小的叶片来自顶部第一片或第二片,过于幼嫩,在培养过程中叶片易失绿,导致不能分化,而较大的叶片则呈半木质化,对激素的适应能力更强,更适于叶片的不定芽分化。综上所述,宽度大于1 cm的叶片更利于植株再生。
2.6 不同生长素对大叶石蝴蝶组培苗生根的影响
将叶片分化得到的增殖苗,切取丛生芽上的单芽,选取高约1 cm的单芽作为生根苗接入生根培养基。20 d后根系开始生长,再经过30 d生根诱导后,可形成发达的根系(图6)。

a:远轴面朝下;b:近轴面朝下
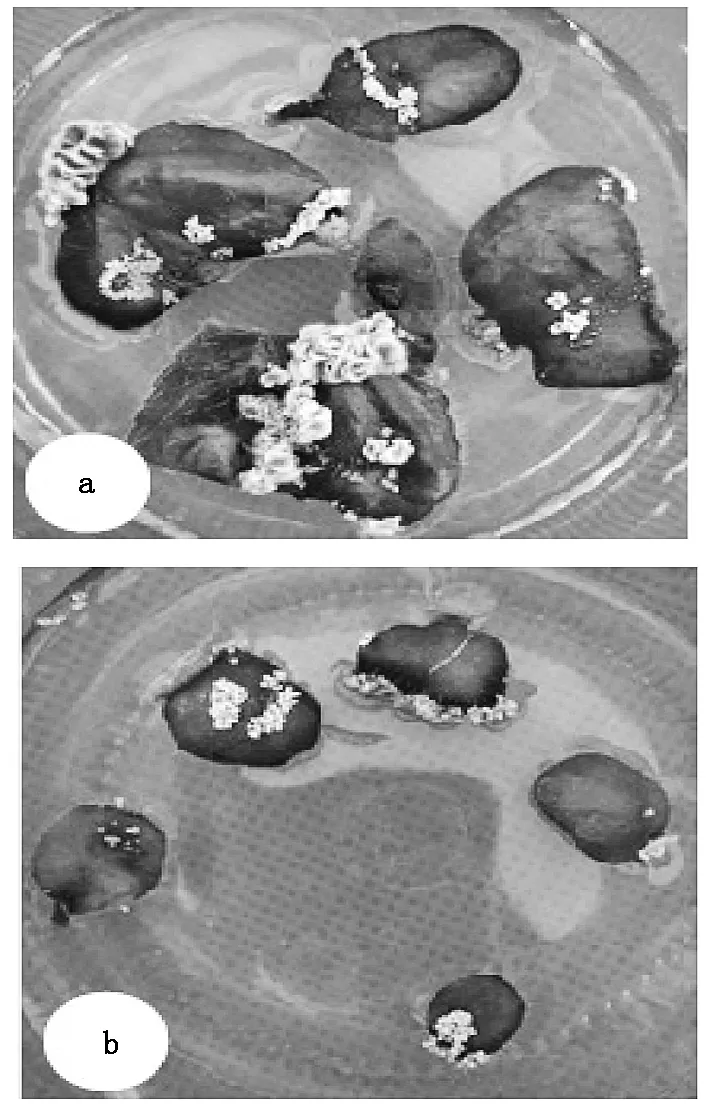
a:宽度大于1 cm的叶片;b:宽度在0.5 cm左右的叶片

图6 大叶石蝴蝶生根苗
由表2可知,8个处理的生根率均达到100%,但在添加了同浓度的NAA或IBA的培养基中,其形成的根系形态也会存在差别。观察其根系形态,在NAA的处理中,当NAA浓度为0.9 mg/L时根系生长状况最好,根系形态为主根粗壮,须根多且密,长度相近;在IBA的处理中,当IBA浓度为0.9 mg/L时根系生长状况最好,根系须根数量较少,根长较长,长度差异较大。综合根系粗度、根系数量综合分析认为 1/2 MS+0.9 mg/L NAA+15 g/L白砂糖+6.0 g/L琼脂+ 0.2 g/L AC为最优的生根配方。
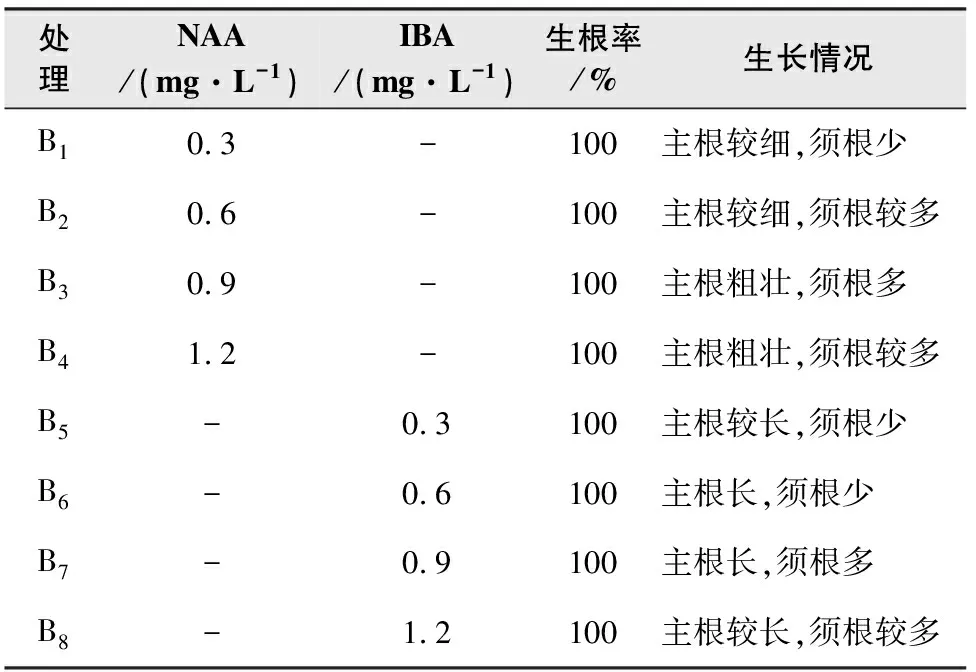
表2 不同激素浓度对植株生根率的影响
2.7 大叶石蝴蝶试管苗的移栽炼苗
移栽使用的土壤为腐植土,共移栽30株,移栽基质为腐殖土∶珍珠岩=5∶1。移栽完成后进行保湿处理,1个月后组培苗即可成活(图7)。在顶芽处可形成新的叶片,再经过一段时间的细心管护,待根系完全与土壤结合后则可完全适应外界环境。

图7 大叶石蝴蝶炼苗移栽(50 d)
3 结论与讨论
外植体消毒是植物组织培养中的首要环节,直接影响无菌体系能否成功建立[6]。在外植体的消毒过程中可用的消毒剂种类较多,但以升汞的消毒效果最佳[7]。外植体消毒过程中,在材料较多的情况下常会开展不同消毒剂种类、消毒时间、消毒剂组合的筛选试验,以期筛选出最佳的消毒方法[8-10]。但是在外植体数量有限的情况下,则只能通过少量的材料去建立无菌体系。为确保消毒效果,则多会选用升汞进行消毒。本试验过程中,由于收集到的野生大叶石蝴蝶数量较少,因而未能开展外植体的消毒方法比较。此外,在外植体选择中,顶芽或茎段是最为理想的材料,但大叶石蝴蝶的顶芽或茎段不明显,故以叶片为外植体作为启动材料。而在仅添加了0.5 mg/L 6-BA、0.1 mg/L NAA 的MS培养基中则能分化出不定芽,表明大叶石蝴蝶的叶片再生能力较强。
在成功获得无菌材料后,只有让获得的材料呈几何指数增长,才能真正地实现植物的离体快繁。而离体快繁的途径常涉及侧芽增殖途径、不定芽增殖途径、体细胞胚增殖途径等[11]。其中在不定芽增殖中,不定芽可经外植体直接形成不定芽,也可经过分化形成愈伤组织后再分化出不定芽。而叶片在伤口处直接形成不定芽,其效率要优于通过愈伤组织间接再生不定芽的方式[12]。大叶石蝴蝶在叶片伤口处未见明显的愈伤组织,而是直接形成了芽点,属于不定芽直接发生型。离体叶片的这种直接形成不定芽的方式,一般认为属于多起源,认为其分生组织起源于切口附近与维管束相邻的上表皮细胞、维管组织薄壁细胞及周围薄壁细胞,通过细胞分裂和分化最终形成分生细胞团,从而直接形成芽[13],而在此过程中,激素充当着重要角色,合理的激素配比是确保叶片分化的关键[14-15]。大叶石蝴蝶同大多数苦苣苔科植物一样,NAA和6-BA对其分化起决定性作用,添加6-BA的同时配合NAA使用,并使其达到合适的比例,才能达到较为理想的分化效果。
此外,在试验过程中发现,叶片过于幼嫩以及切口方式和叶片朝向均会对大叶石蝴蝶组培苗的叶片再生产生影响。过于幼嫩的无菌苗叶片在培养过程中易褐化、死亡,而相对成熟的叶片适应性强,且处于代谢旺盛时期,再生率较高[16]。而叶片接种前垂直于主脉横切更有利于伤口处形成不定芽或愈伤,这与灰枣树、杨树叶片再生研究结果较为一致[17-18]。而叶片的放置式,以远轴面接触培养基更利于愈伤组织诱导和不定芽分化。这与红掌、梨、蓝浆果等植物的叶片再生研究结果一致[19-21]。
在组培生根阶段,添加一定浓度的生长素有助于试管苗的生根[22]。不同种类及浓度的生长素对试管苗的生根效果会存在一定的差异[23-24]。在大叶石蝴蝶的生根过程中,NAA能够促进须根的生长,IBA能促进主根的伸长。NAA与IBA相比,更能显著促进根系的增粗生长[25]。在卷荚相思的组培苗生根过程中,IBA的生根效果要显著优于NAA或ABT1,且单株生根苗的根系数量最多[26]。而在龙脑樟的组培苗生根时,IBA与IAA组合生根效果要显著优于单一激素的生根效果[27]。因此,在生根过程中要根据生根率及根系形态来选用合适的激素类型及配比。总的来讲,大叶石蝴蝶对于添加NAA或IBA均能达到理想的生根效果,特别是在NAA的诱导下形成的发达根系有利于移栽炼苗。因此,在移栽过程中采用常见的腐质土,注意控制好温湿度,即可获得大叶石蝴蝶移栽成活。
综上所述,叶片消毒后接种在MS+0.5 mg/L 6-BA+0.1 mg/L NAA+30 g/L蔗糖+5.0 g/L琼脂的培养基上可获得无菌苗;无菌苗叶片横切后以远轴面朝下接种在MS+1.0 mg/L 6-BA+0.1 mg/L NAA+30 g/L蔗糖+5.0 g/L琼脂的培养基中即可再分化;生根则选用1/2MS+0.9 mg/L NAA+15 g/L白砂糖+6.0 g/L琼脂+ 0.2 g/L AC培养基;移栽选用基质为腐殖土∶珍珠岩=5∶1。大叶石蝴蝶的植株再生体系的建立为今后大叶石蝴蝶的繁育和产业化开发提供了重要的技术支撑。

