子宫内膜息肉的MRI诊断及鉴别诊断
田宗武,邓飞艳,曹雯,肖婷婷,郭金娟,唐露,辛雅岚
长沙医学院医学影像学院放射诊断教研室,湖南 长沙 410219
子宫内膜息肉(endometrial polyps,EP)是由子宫内膜腺体及含厚壁血管的纤维化子宫内膜间质构成的突出于子宫内膜表面的良性结节,是常见的子宫内膜病变之一,可引起异常子宫出血与不孕,可恶变[1]。由于EP与子宫内膜癌、子宫黏膜下肌瘤、子宫内膜增生在临床及影像学鉴别上有一定困难,本文报告51例经手术病理证实的EP患者,评价MRI对子宫内膜息肉的诊断及鉴别诊断价值。
1 资料与方法
1.1 一般资料 收集长沙医学院附属第一医院2015年6月至2019年11月经手术病理证实的51例子宫内膜息肉的术前影像及临床资料,年龄30~76岁,中位年龄49岁。51例中,有临床症状30例(58.82%),表现为月经周期异常、经期延长或阴道出血;21例(41.18%)无症状,为体检发现。
1.2 MR仪器及检查方法 采用西门子Avanto 1.5T MR超导扫描仪。患者仰卧位,先行MRI平扫。扫描参数:矢状面T2WI抑脂序列,TR 3 800 ms,TE 80 ms;横轴面T2WI抑脂序列,TR 7800 ms,TE 80 ms;冠状面T2WI抑脂序列,TR 3800 ms,TE 92 ms;横轴面T1WI抑脂序列,TR 4.89 ms,TE 2.38 ms;矩阵256×256;层厚3.0~5.0 mm,层距1.2~1.5 mm;激励次数4。增强扫描为横轴面、矢状面、冠状面T1WI抑脂序列,对比剂采用钆喷替酸葡甲胺(Gd-DTPA),剂量0.2 mmol/kg,注射流率2.5 mL/s,扫描参数同平扫。DWI采用横轴面扫描:TR 3 100 ms,TE 80 ms,b值取50 s/mm2、400 s/mm2和800 s/mm2,层厚3 mm,层距1.2 mm,矩阵320×256,视野238 mm×280 mm。
1.3 ADC值的测量 由3名主治医师分别进行数据测量及分析。在肿瘤最大层面的ADC图像上进行测量,测量4次取平均值。
2 结果
51例子宫内膜息肉在T1WI上均呈等低信号(图1A);T2WI上子宫内膜息肉见低信号纤维核(图1B)35例(68.63%),肿块内未见纤维核16例(31.37%);51例中,肿块内囊变区21例(41.18%),出血4例(7.84%),在T1WI上呈高信号,提示亚急性出血;51例EP在T2WI上结合带均完整。增强后肿块内纤维核呈条索状明显强化,囊变区呈边缘清楚的未强化区(图1C)35例(68.63%);16例未见纤维核的增强后呈不均匀的中等强化。DWI和ADC上子宫内膜息肉均呈略高信号或等信号(图1D、E)。ADC值范围为(1.15~2.10)×10-3mm2/s。
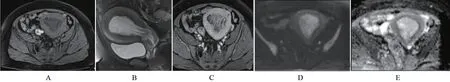
图1 同一患者,女,40岁。MRI示子宫腔内一大小约7.06 cm×5.05 cm×7.03 cm肿瘤,手术病理证实为子宫内膜息肉
3 讨论
子宫内膜息肉为子宫内膜基底层局限性增生,带蒂突向宫腔,由分布不规则的内膜腺体和间质组成,一般包括:间质成分(少量致密的纤维结缔组织)、厚壁血管以及子宫内膜腺体[1]。EP的发病机制可能与遗传、炎症刺激、雌/孕激素受体分布不均衡等多种因素有关。治疗后容易复发,3.5%发生恶变。EP常见于35岁以上妇女,高峰年龄为50岁。目前中国妇女EP发病率不断提高,为24%~25%[1],临床表现为月经周期异常、经期延长或阴道出血、不孕。本组51例患者,年龄为30~76岁,中位年龄49岁,58.82%的病例伴有上述症状,41.18%的病例无症状,为体检发现。
经阴道超声是目前最常用的评价子宫内膜的方法。确诊仍需子宫内膜活检或诊刮术,然而,对于阴道和宫颈狭窄的患者,操作起来就有一定困难[2]。MRI具有良好的分辨率以及多方位成像的特点,在鉴别子宫内膜良恶性病变方面有较高价值。文献报道EP典型的MRI表现为T2WI上子宫腔内低信号纤维核或高信号囊肿[3-7]。病理上纤维核心区细胞排列紧密,使T2WI信号减低;病变中囊肿为子宫腺体扩张、液体集聚,使T2WI呈高信号;出血是由于厚壁血管破裂所致[6]。本组68.63%的病例在T2WI上出现低信号纤维核心影,41.18%的病例肿块内出现不强化的囊变区,7.84%的病例有出血,在T1WI上呈高信号,提示亚急性出血,与文献[4-9]报道基本一致。本组51例患者子宫内膜结合带均完整,这与恶性肿块侵犯结合带、正常T2WI结合带低信号影中断或消失不同。
HASE等[2]报道EP于常规T1WI增强扫描呈明显或中等强化,动态对比增强扫描提示,多数息肉早期呈完全或部分强化并持续明显强化或渐进性强化模式。增强后肿块内纤维核呈条索状明显强化,囊变区呈边缘清楚的未强化区;出现纤维核、纤维核呈条索状明显强化及结合带完整,基本可以确定EP的诊断;本组68.63%的病例增强后肿块内纤维核呈条索状明显强化;31.37%的病例在T2WI上未显示低信号纤维核,增强后肿块呈不均匀中等度强化,如果结合带完整及无扩散受限,可以基本确定为子宫内膜的良性病变。DWI不仅能对病变进行定性诊断,还可通过表观扩散系数(apparent diffusion coefficient,ADC)对病变进行定量分析。研究发现,EP相对于子宫内膜在DWI多呈等信号或低信号,而子宫内膜癌及子宫内膜均呈高信号[2,8]。但本组病例DWI多呈略高信号或等信号,与文献[2,8]报道有差别,笔者认为:由于内膜癌、内膜息肉在DWI上均呈高信号或稍高信号,肉眼难以区分几种子宫内膜病变在DWI上的信号强度,但通过ADC值的高低可以解决这一问题;与子宫内膜癌相比,EP的细胞密度小、细胞外间隙大、细胞核浆比低;从而导致EP的ADC值明显高于子宫内膜癌。本组EP的ADC值范围为(1.15~2.10)×10-3mm2/s,比恶性肿块ADC值高,ADC值大于1.385×10-3mm2/s,有助于诊断良性EP。人体内水分子的运动主要有两方面:其一,水分子的扩散运动;其二,毛细血管网中血流的微循环灌注。体素内不相干运动(IVIM)成像可用于量化DWI图像中的两种运动成分。IVIM显示子宫内膜癌(EC)患者的慢速表观扩散系数(ADC-slow)值、灌注分数(f)值显著低于EP,EC的快速表观扩散系数(ADC-fast)值显著高于EP,说明EC扩散明显受限和肿瘤的高血流灌注[10]磁敏感加权成像(SWI)通过引入相位信息来获得组织敏感性的对比度。SWI图像可更好地显示静脉血管、微出血、钙化及铁沉积。目前主要应用于脑外伤、血管畸形、铁沉积及肿瘤周围血供的影像分析。但SWI在女性盆腔检查中的应用较少,需要不断积累研究经验。
子宫内膜息肉需要与子宫内膜癌、子宫黏膜下肌瘤及子宫内膜增生进行鉴别。①子宫内膜癌:IVIM显示EC患者的ADC-slow值、f值显著低于EP,EC的ADC-fast值显著高于EP,说明EC扩散明显受限和肿瘤的高血流灌注[10];②子宫黏膜下肌瘤:T1WI肿瘤与正常子宫肌层相比呈等信号,T2WI多呈均匀低信号,边缘清晰,继发变性者其信号不均匀,子宫内膜受压移位,扩散不受限;③子宫内膜增生:弥漫均匀增厚的子宫内膜信号与正常内膜信号一致,结合带完整,扩散不受限。
本研究具有一定的局限性:①未将子宫内膜几种常见疾病(子宫内膜癌、子宫内膜增生)放在一起进行对比研究;②未对本组病例进行扩散新技术-IVIM的研究,IVIM可以从扩散和灌注两个方面来评价肿瘤的良恶性;③未对EP内微出血进行磁敏感加权方面的研究。
总之,T2WI上肿块内低信号纤维核呈明显条索状强化、肿块弥散不受限是子宫内膜息肉的典型和特征性MRI表现。

