血清DcR3水平与早产儿呼吸窘迫综合征的关系
黄争,赵辉
1.上海德达医院儿科,上海 201702;2.上海交通大学医学院附属第九人民医院黄浦分院儿科,上海 200031
呼吸窘迫综合征(respiratory distress syndrome,RDS)是早产儿高致死率、高致残率的主要因素[1]。由于肺发育不成熟,进一步促使肺泡表面活性物质(pulmonary surfactant,PS)缺乏,最终导致早产儿RDS的发生[2]。肿瘤诱骗受体3(decoy receptor 3,DcR3)是一种新发现的免疫抑制作用分子,与自身免疫性疾病、肿瘤、弥漫性肺间质疾病等相关[3-5]。王秀丽等[6]研究发现特发性肺间质纤维化患者血清中DcR3水平高于健康体检者,明确DcR3基因参与肺间质纤维化的发生发展过程。然而,目前国内外有关DcR3水平与RDS的关系却鲜有报道。因此,本研究拟通过分析早产儿血清DcR3水平与RDS的关系,以期为RDS的诊断、病情的评估提供参考。
1 资料与方法
1.1 一般资料 选取2016年1月至2018年1月上海德达医院儿科住院的RDS早产儿88例作为研究对象,按照病情严重程度将观察组患儿分为轻度组46例(入院24 h内首次胸片结果为Ⅰ级、Ⅱ级)和重度组42例(入院24 h内首次胸片结果为Ⅲ级、Ⅳ级)。另选取同期在本院产科出生的正常早产儿56例作为对照组。RDS诊断标准参考第4版《实用新生儿学》[7]。患儿入选标准:(1)28周<胎龄<37周;(2)住院时日龄<24 h;(3)病例资料完整。排除标准:(1)伴有先天性畸形患儿;(2)甲状腺功能减退患儿;(3)先天性代谢紊乱患儿。所有受试者均得到监护人同意并签署知情同意书,并通过本院医学伦理委员会的批准。
1.2 资料收集 由专业人员收集所有受试者的临床资料,包括性别、胎龄、体质量、出生方式、早产儿窒息情况(体内严重缺氧、呼吸系统发生障碍导致呼吸困难或停止呼吸)、入院24 h内首张胸片、孕妇妊娠期糖尿病、产前激素使用情况等。
1.3 DCR3检测方法 所有早产新生儿出生后12~24 h内采集静脉血2 mL,置于促凝管中,常温静置40 min后离心10 min(3 000 r/min),取血清1 mL分装于EP管中,放入-80℃冰冻保存待用;采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测血清DCR3水平,试剂盒购自上海酶联生物科技有限公司,操作严格按照试剂盒说明书进行。
1.4 统计学方法 应用SPSS19.0软件对数据进行统计学分析,正态分布计量资料以均数±标准差(x-±s)表示,多组间比较采用方差分析,进一步比较采用LSD-t检验;计数资料以百分率(%)表示,组间比较采用χ2检验;采用多因素Logistic回归模型分析早产儿RDS发生的影响因素;采用ROC曲线分析血清DcR3水平对RDS的诊断价值,以P<0.05为差异有统计学意义。
2 结果
2.1 三组早产儿的一般资料比较 对照组与轻度组、重度组早产儿的胎龄、性别、体质量、出生方式、孕妇妊娠期患糖尿病情况和产前激素使用情况比较,差异均无统计学意义(P>0.05);轻度组、重度组早产儿窒息发生率明显高于对照组,差异有统计学意义(P<0.05),见表1。
2.2 三组早产儿的血清DcR3水平比较 轻度组和重度组早产儿的血清DcR3水平明显高于对照组,而重度RDS组明显高于轻度组,差异均有统计学意义(P<0.05),见表2。
2.3 早产儿RDS发生的影响因素 以早产儿是否发生RDS为因变量,以新生儿窒息、血清DcR3水平为自变量,以Logistic回归分析结果显示,新生儿窒息、血清DcR3高表达是早产儿发生RDS的独立危险因素(P<0.05),见表3。
2.4 血清DcR3水平对RDS的诊断价值 ROC曲线分析显示,血清中DcR3水平诊断早产儿发生RDS的曲线下面积(Area Under Curve,AUC)为0.893(95%CI:0.832~0.896),截断值为111.471 pg/mL,灵敏度和特异度分别为82.3%、85.6%,见图1。
表1 三组早产儿一般资料比较[(±s),例(%)]
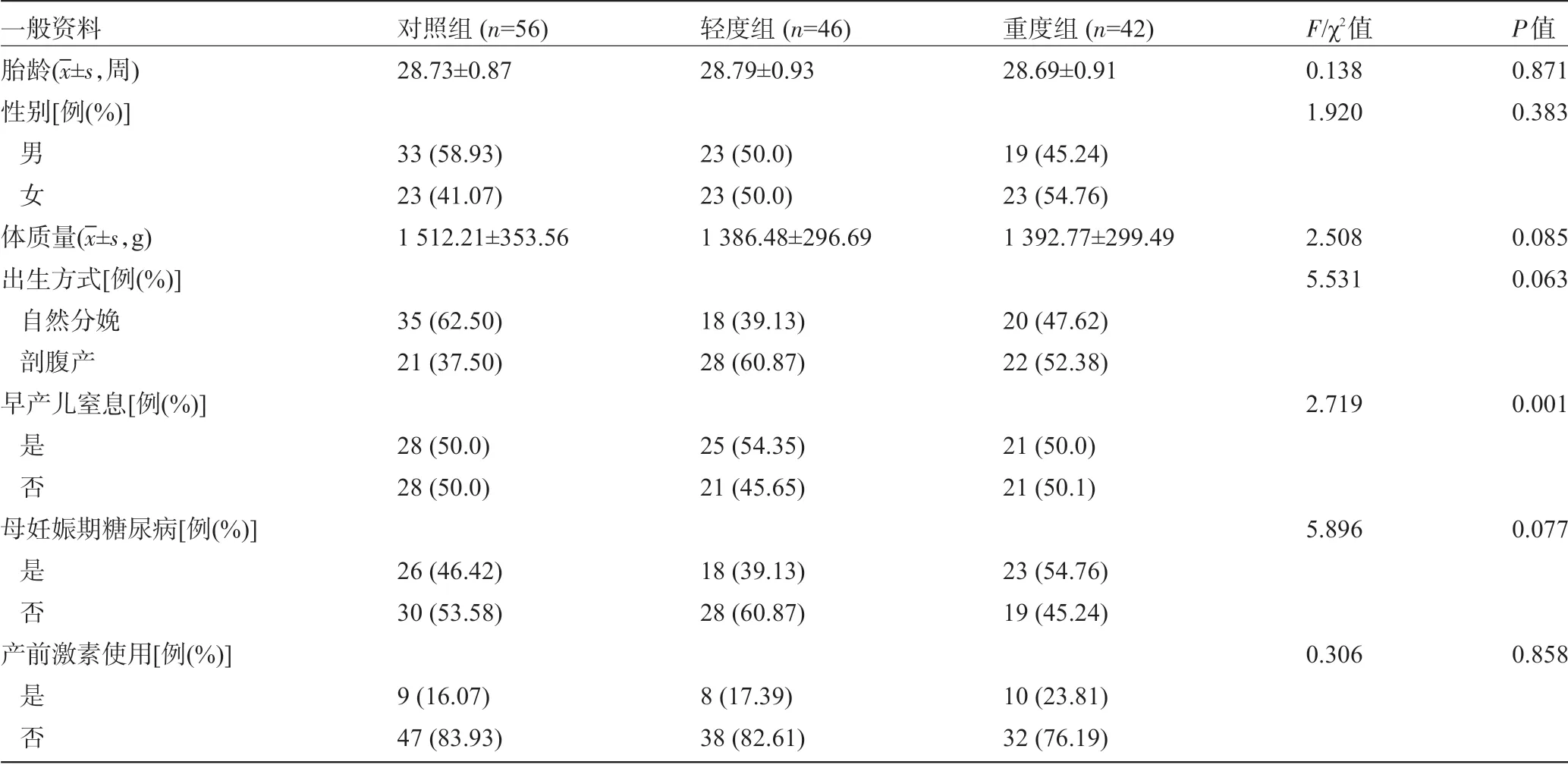
表1 三组早产儿一般资料比较[(±s),例(%)]
一般资料胎龄(x-±s,周)性别[例(%)]男女体质量(x-±s,g)出生方式[例(%)]自然分娩剖腹产早产儿窒息[例(%)]是否母妊娠期糖尿病[例(%)]是否产前激素使用[例(%)]是否对照组(n=56)28.73±0.87 33(58.93)23(41.07)1 512.21±353.56 35(62.50)21(37.50)28(50.0)28(50.0)26(46.42)30(53.58)9(16.07)47(83.93)轻度组(n=46)28.79±0.93 23(50.0)23(50.0)1 386.48±296.69 18(39.13)28(60.87)25(54.35)21(45.65)18(39.13)28(60.87)8(17.39)38(82.61)重度组(n=42)28.69±0.91 19(45.24)23(54.76)1 392.77±299.49 20(47.62)22(52.38)21(50.0)21(50.1)23(54.76)19(45.24)10(23.81)32(76.19)F/χ2值0.138 1.920 2.508 5.531 2.719 5.896 0.306 P值0.871 0.383 0.085 0.063 0.001 0.077 0.858
表2 三组早产儿的血清DcR3水平比较(±s)
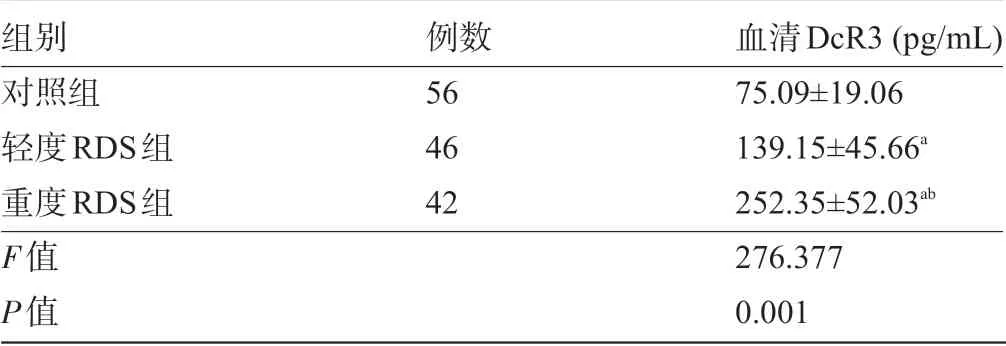
表2 三组早产儿的血清DcR3水平比较(±s)
注:与对照组比较,a P<0.05;与轻度组比较,b P<0.05。
组别对照组轻度RDS组重度RDS组F值P值例数56 46 42血清DcR3(pg/mL)75.09±19.06 139.15±45.66a 252.35±52.03ab 276.377 0.001
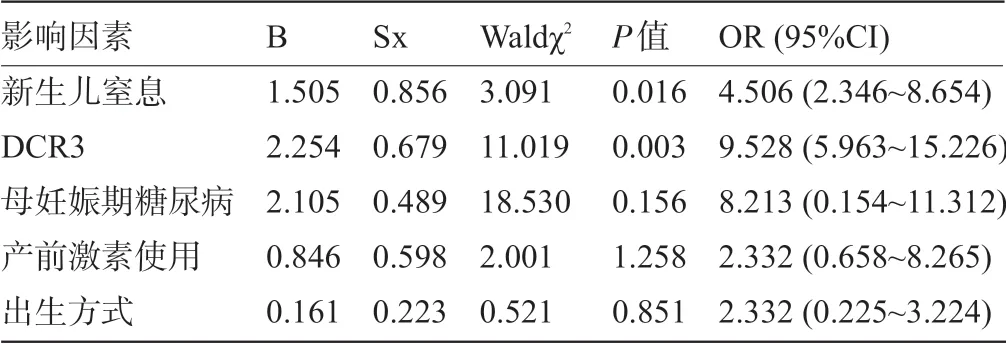
表3 早产儿RDS发生的多因素Logistic回归分析
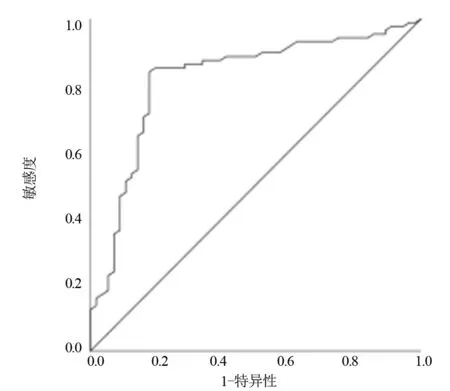
图1 血清DcR3水平对RDS诊断价值ROC曲线
3 讨论
RDS是一种呼吸系统疾病。窒息、缺氧、酸中毒会一定程度损伤肺泡上皮细胞,抑制肺表面活性物质的合成及活性,导致RDS发生[8-9]。既往研究显示,胎龄越小,出生体质量越轻,肺部发育越不成熟,免疫功能就越低,RDS发病率就越高[10]。本研究一般资料对比分析结果显示,轻度、重度RDS组新生儿窒息发生率高于对照组,与张鸿等[11]、曹芳芹等[12]研究结果一致。RDS是一种炎症性肺损伤[13],是ICU常见的危重症,当患儿出现严重状态时,治疗就较为被动,治疗有效率也较低。因此,寻求能够早期诊断RDS的生物学标记物对临床医生来说意义重大。
DcR3是缺乏跨膜结构,是一种分泌型蛋白[14]。有研究表明,DcR3是一种免疫调节因子,具有抗炎作用及免疫调节作用,与炎症进展密切相关[15]。在自身免疫性疾病中,DcR3能控制某些自身免疫性疾病的炎症反应,促进某些自身免疫性疾病的进展[16]。CHEN等[17]将DcR3注射进实验性小鼠自身免疫性脑脊髓炎的鞘膜内,发现DcR3可明显缓解自身免疫性小鼠的脑脊髓炎症状。谢姿等[18]研究发现血清DcR3水平越高,RDS患者病情越重。白文梅等[20]研究发现,与健康体检者正常肺组织比较,非小细胞肺癌患者组织中DcR3阳性表达率显著升高,提示DcR3与非小细胞肺癌的发生发展有关。本研究结果显示,与对照组比较,重度RDS组、轻度RDS组早产儿血清DcR3水平均显著升高,且重度RDS组早产儿血清DcR3水平显著高于轻度RDS组。与谢姿等[18]研究结果一致,提示血清DcR3异常表达可能与早产儿RDS发生发展、病情严重程度相关,实时监测血清DcR3水平变化有助于评估早产儿RDS病情进展情况。刘敏等[19]研究发现,与健康对照组比较,慢阻肺合并呼吸衰竭组患者血清中DcR3水平显著升高,且与病情严重程度密切相关,为患者不良预后的独立危险因素。本研究进一步多因素Logistic回归分析结果显示,新生儿窒息、血清DcR3高表达是早产儿发生RDS的独立危险因素,与刘敏等[19]研究结果一致,提示可能因为窒息、缺氧一定程度上损伤肺泡上皮细胞,抑制肺表面活性物质的合成及活性,以致发生RDS,血清DcR3可能参与RDS发生过程。刘晶等[20]研究发现,特发性肺间质纤维化组患者血清DcR3表达水平显著高于健康体检者,对特发性肺间质纤维化的诊断和判断进展及预后具有参考价值。接着本研究采用ROC曲线分析血清DcR3水平对RDS的诊断价值,结果显示在血清DcR3水平截断值为111.471 pg/mL时,诊断RDS的AUC值为0.893,灵敏度和特异度分别为82.3%、85.6%,提示检测患儿血清中RDS水平可能有助于RDS的诊断,且具有较好诊断价值。
综上所述,除窒息外,早产儿血清DcR3水平可能是RDS发生的另一独立危险因素,可反映患儿病情严重程度,可能作为评估病情的生物学指标,有望为临床早期诊断早产儿RDS提供参考。但本研究样本量少,且并未对血清DcR3在RDS疾病发生中具体作用机制进行研究,后期应加大样本量对相关机制作进一步研究。

