人源性与猪源性冠状病毒的再认识与防控策略
胡伟 文丽 邓小红 许建章

摘 要:本文对人源性和猪源性的冠状病毒进行综述,让养猪人足不出户了解冠状病毒以及它对我们的影响和危害,从而避免或减少冠状病毒对我们造成的损失。
关键词:人源性冠状病毒;猪源性冠状病毒;分泌型IgA;猪传染性胃肠炎病毒;猪流行性腹泻病毒
中图分类号:S851.33 文献标志码:C 文章编号:1001-0769(2020)06-0041-06
2019新型冠状病毒牵动着世界上每个人的心,这个看不见的敌人带来了一场没有硝烟的战争,给全世界带来了灾难性的打击。此后无人不知冠状病毒,从未上过学的老父亲也因这次疫情知道钟南山的大名。冠状病毒首次发现距今已有70多年的历史,此类病毒可感染人、猪、其他哺乳动物和鸟类,引起呼吸道和肠道疾病。冠状病毒变异快,传播迅速,已知和新出现的冠状病毒对人类和养猪业造成了巨大的威胁和经济损失。作为养猪人,不仅需要了解人源性冠状病毒,更要了解猪源性冠状病毒,防患于未然,把猪养得更好,赚更多钱。
1 人源性冠状病毒
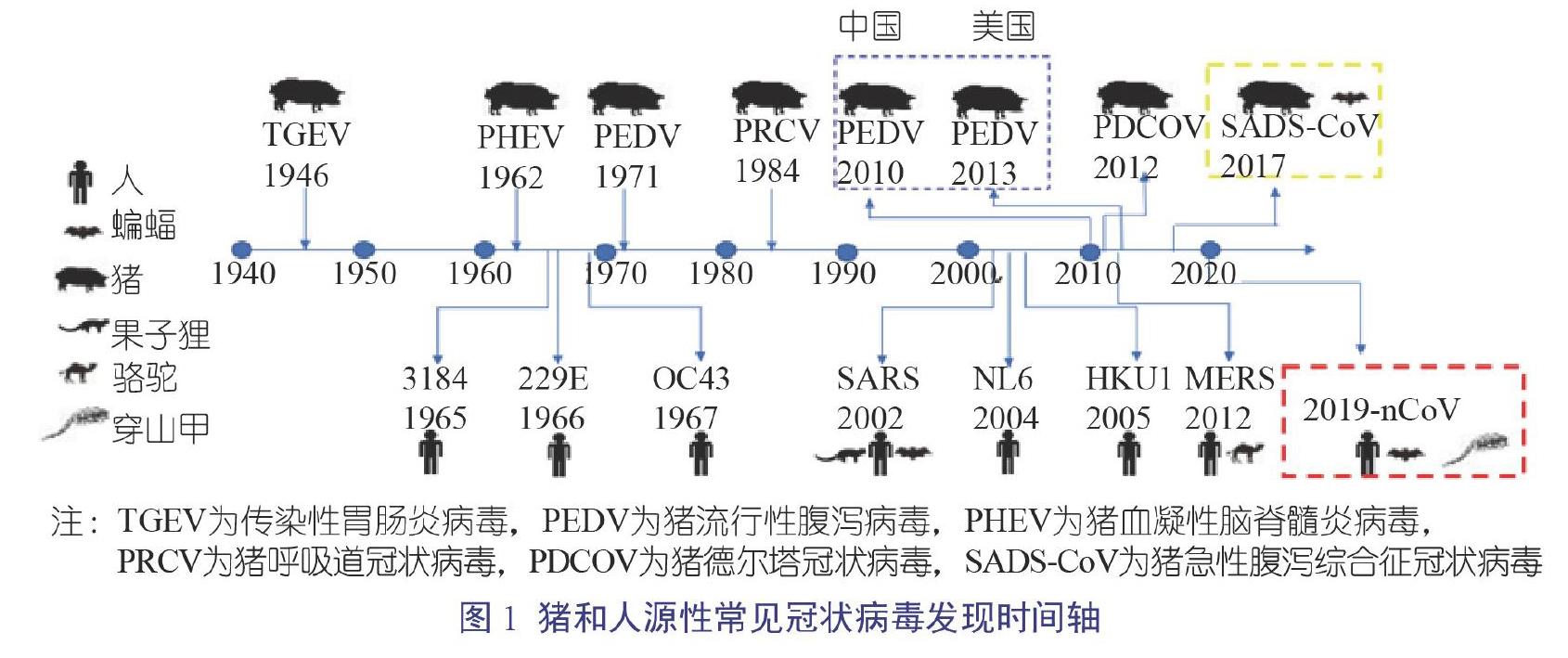
最早的人源性冠状病毒于1965年从具有感冒症状的病人鼻腔分泌物中分离获得,命名为人冠状病毒B814。目前,常见的感染人的冠状病毒有7种,分别为人冠状病毒229E(229E)、人冠状病毒OC43(OC43)、严重急性呼吸综合征冠状病毒(SARS-CoV)、人冠状病毒NL63(NL63)、人冠状病毒HKU1(HKU1)、中东呼吸综合征冠状病毒(MERS-CoV)和新型冠状病毒(2019-nCoV)。其中,最为人们熟悉的当属2002年底开始流行的SARS-CoV以及2019年底开始流行的2019-nCoV;另外,2012年始于沙特阿拉伯的MERS-CoV也是人源性冠状病毒著名成员(图1)[1-3]。
现有的试验证据表明,229E、OC43、NL63和HKU1 4个冠状病毒主要在人群中流行,可引起免疫抑制人群温和的呼吸道症状,目前没有发现其他动物作为病毒的储存宿主。而SARS、MERS和2019-nCoV则存在其他自然宿主,有研究表明SARS病毒以果子狸作为中间宿主,将病毒从蝙蝠带给人类,导致9%的感染者死亡;MERS则以骆驼作为病毒来源,传染给人类,感染者的死亡率高达36%,是目前对人类最具威胁性的冠状病毒。针对最新的2019-nCoV,华南农业大学Xiao等[4]以及香港大学Lam等[5]的研究表明,穿山甲很可能作为中间宿主将病毒从蝙蝠传染给人来。幸运的是,目前为止没有研究发现猪可以作为人源性冠状病毒的宿主,因此猪对人类是安全的。
2 猪源性冠状病毒
猪源性冠状病毒虽然不会感染人类,但是同样会造成巨大的经济损失,如2010年以来在中国养猪业流行的猪流行性腹泻病毒(Porcine Epidemic Diarrhea Virus,PEDV)导致了100万头仔猪死亡,美国自2013年起也因PEDV损失10%的仔猪[3]。截至目前,从猪上共鉴别了6类常见冠状病毒,分别为传染性胃肠炎病毒(Transmissible Gastroenteritis Virus,TGEV)、PEDV、猪呼吸道冠状病毒(Porcine Despiratory Corouavirus,PRCV)、猪血凝性脑脊髓炎病毒(Porcine Hemagglutinating Encephalomyelitis Virus,PHEV)、猪德尔塔冠状病毒(Porcine Delta Coronavirus,PDCOV)和猪急性腹泻综合征冠状病毒(Swine Acute Diarrhoea Syndrome Coronavirus,SADS-COV)。作为养猪人,自然要对猪源性冠状病毒有所了解,保护好当下的金猪。
2.1 PEDV、TGEV和PRCV
大部分养猪人对PEDV和TGEV不陌生,這两种病毒感染猪的肠道后均可引起腹泻、呕吐和死亡等症状,且会造成1周龄以下的发病仔猪极高的死亡率,尤其是PEDV。2010年12月以来PEDV新的变异毒株给全国猪场带来了巨大的损失,发病仔猪死亡率达80%~100%,目前国内很多猪场仍然遭受该病毒的侵袭。TGEV于1946年在美国被鉴定出来,为猪上最早发现的冠状病毒。目前该病毒在美国和欧洲的猪群中流行率较小,其中很大的原因归咎于这两个地区的猪群普遍感染PRCV。
PRCV作为TGEV在S基因片段大量碱基缺失后变异的病毒,主要感染猪的呼吸道,大多引起10~15周龄以上的猪呼吸道症状。研究发现大部分猪场为阳性状态,但通常猪群处于亚临床症状,在其他病毒和细菌存在的情况下,该病的临床症状才明显。如猪繁殖与呼吸综合征病毒(Porcine Reproductive and Respiratory Syndrome Virus,PRRSV)和PRCV共感染可导致该病表现出明显的临床症状,两者会共同加剧感染猪肺部病变。那么,为何TGEV在PRCV流行的欧洲地区会平静下来?原因在于PRCV感染猪群后可诱导猪产生对抗TGEV的中和抗体,起到部分保护效果,而且这种保护力可以通过初乳或常乳保护新生仔猪,降低TGEV导致的仔猪死淘率(怀孕阶段二次感染后母猪的乳汁可提供87.5%~100%保护率)[6]。
在国内,缘何TGEV仍然在猪场中普遍流行(山东规模化猪场流调显示,TGEV感染率达18.52%),导致猪场损失惨重?
笔者分析认为:
⑴ PEDV的广泛流行以及PEDV和TGEV的混合感染加剧了猪场的损失;
⑵ 国内猪繁殖与呼吸障碍综合征(Porcine Reproductive and Respiratory Syndrome,PRRS)等免疫抑制性疾病导致猪群免疫力下降,母猪的母源抗体不能很好地保护仔猪(众所周知,对PEDV和TGEV的防控,乳汁中的IgA发挥着关键的作用;引起母猪群免疫抑制的PRRS等疾病或者其他损害母猪黏膜免疫的因素可导致母源抗体水平降低)。
2.2 PDCoV、PHEV和SADS-COV
2012年,中国香港首次报道在猪上分离到PDCoV,感染猪的临床症状类似于PEDV感染,表现为仔猪和母猪出现水样腹泻以及仔猪死亡(图2),但感染仔猪的死亡率(30%~40%)低于PEDV引起的死亡率低,随后内地也从腹泻猪的临床样品中检测到PDCoV,并也出现仔猪死亡。2014年末,肖少波研究团队从湖北、河南、安徽和广东等地的猪场腹泻病例中分离到多个PDCoV分离株;中国农业科学院哈尔滨兽医研究所冯力研究团队对2014年1月至2015年11月收集的77家猪场的232份临床腹泻样品进行了RT-PCR检测,结果显示10.34%(24/232)的样品呈PDCoV阳性,且某些腹泻病例仅仅分离到PDCoV。
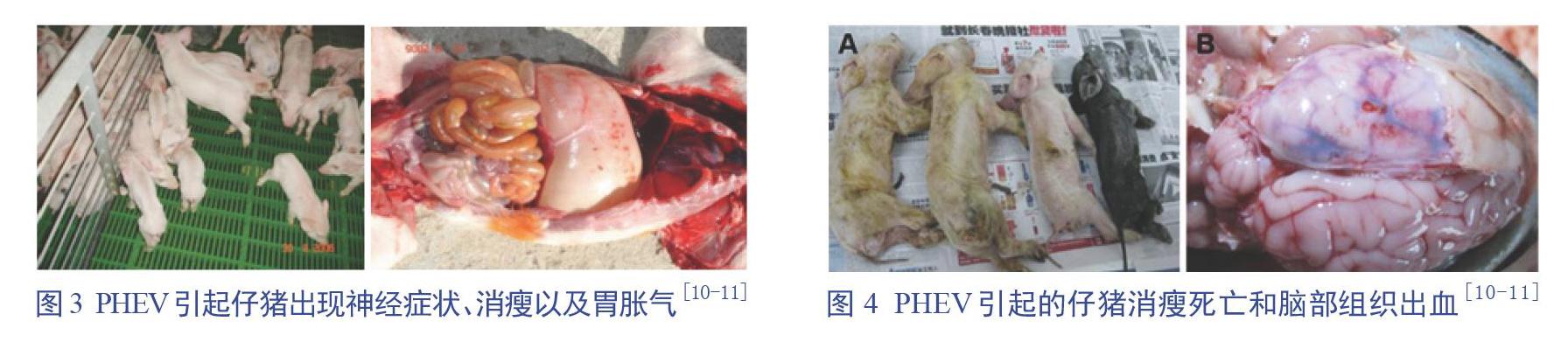
1957年,加拿大第一个报道了猪感染PHEV后引发的临床疾病,该病的主要症状包括4周龄以下的仔猪出现呕吐、消瘦、脑脊髓炎以及死亡(图3和图4)[10-11]。目前,该病普遍存在于世界各地的猪群中,主要引起4周龄以下仔猪的死亡。PHEV是唯一一个会引起仔猪出现神经症状的冠状病毒。在中国,猪群最早的发病时间是1985年,发病地是北京,近年来多个猪场报道了该病的发生;根据2014年吉林市某猪场的报道,发病猪主要出现呕吐和神经症状,部分病猪伴随着尖叫和拉稀,病猪最终均死亡[8-9]。流行病学调查显示,虽然PHEV流行广泛,但是发病案例较少,主要得益于母源抗体的保护。通常发病猪场都与后备母猪的大量引进有关,因此应引起猪场的重视。
SADS-COV为最近才发现的猪源性冠状病毒,时间为2016年,发病地为广东省清远市的4家猪场,导致24 693头仔猪死亡。该病毒引起的临床症状和PEDV的基本一致,导致5日龄以下的仔猪出现急性拉稀和脱水,死亡率高达90%;然而,母猪等大龄猪感染后仅仅出现温和型腹泻,并且2 d内即可康复。研究发现,SADS-COV与HKU-2相关冠状病毒的核酸序列相似性高达98.48%,有关数据表明该病毒可能来自于马蹄蝠[12]。SADS-COV的发现提示我们养猪人:其他物种如蝙蝠的冠状病毒对猪场的猪群具有一定的威胁。
3 人源性和猪源性冠状病毒之间的关系
如上文所述,目前的研究表明猪源性冠状病毒不会感染人,而人源性冠状病毒也不会在猪体内复制。如2004年有研究人员尝试用SARS冠状病毒感染6周龄仔猪,虽然宣告失败,但是实验动物血清SARS病毒转阳。另外,实验用仔猪属于PRCV抗体阳性动物,因此可能会存在干扰[13]。无论如何,猪源性冠状病毒对人类是安全的,目前生物安全级别非常高的猪场绝对是安全的地方。但是,我们要警惕猪作为载体将野生动物身上的病毒传染给人类!
4 猪源性冠状病毒的防控
无论是人类还是动物,对传染病的防控都需要遵循控制传染源、切断传播途径和保护易感动物/人的策略,因此生物安全应摆放在猪源性冠状病毒病防控的首要位置。对猪场来说,一如既往地加强生物安全不仅是为了防控非洲猪瘟,也是为了防控猪的其他疾病,如猪源性冠状病毒。
在养猪生产中,猪场保护易感动物的第一个方法是生物安全。当然,猪群感染冠状病毒后,保护易感动物以减少损失同样非常重要。在6类常见的猪源性冠状病毒中,无论是PEDV和TEGV,还是PRCV、PDCOV、PHEV以及SADS-COV,它们均会对幼龄仔猪产生较大的危害,但成年猪感染后仅引起轻微的症状;因此,在疫情发生时,保护幼龄仔猪是猪场首要任务。由于幼龄仔猪的免疫系统未发育成熟,无法采用刺激新生仔猪使其产生免疫力的方法,因此养猪生产中保护幼龄仔猪的常见方法有:⑴刺激或补充新生仔猪干扰素,如给仔猪注射新城疫Ⅰ系疫苗产生的干扰素能够减少PEDV引起的损失;⑵通过母源抗体保护仔猪。在这两种方法中,效果最好的當属第 2种,也最受大家青睐。
要利用母源抗体保护仔猪,首先要刺激母猪产生免疫力,然后通过初乳和常乳将保护力传递给仔猪。这种免疫保护具有一定的交叉性,如上文提到的欧洲地区的猪群广泛感染后PRCV产生了对抗TEGV的保护力,因此这些地区的TEGV得到了很好控制。
如何刺激母猪产生针对冠状病毒的保护力?通常有两种做法:返饲和接种疫苗。目前尚无疫苗可以预防PDCOV、PHEV和SADS-COV的感染,但已有多个商品疫苗可预防PEDV和TEGV的感染,然而疫苗的免疫效果一直存在争议。另外,2010年PEDV变异毒株的广泛流行导致疫苗的免疫预防效果大打折扣。虽然返饲法在美国和泰国广泛使用,但是国内的使用效果存在较大的差异。笔者以PEDV为例阐述冠状病毒疫苗和返饲法,希望对大家有所启示。
⑴ 母猪的胎盘组织结构决定了仔猪出生时体内没有母源免疫球蛋白。在自身主动免疫发挥作用前,仔猪通过初乳和常乳中的抗体进行被动获得性保护。此外,给新生仔猪接种PEDV疫苗进行免疫存在两个问题:①母源抗体可干扰疫苗的免疫反应;②仔猪需要到达3周龄才能产生坚实的免疫力。
⑵ PED的防控依靠母源免疫力,主要依靠母猪乳汁中的IgA。初乳中含量最高的抗体为IgG,初乳转换成常乳后,乳汁中的IgG含量急剧下降,此时含量最高的抗体为IgA,为主要免疫保护蛋白。仔猪从母猪初乳获得IgG,可防止系统性感染;常乳中的分泌型IgA(sIgA)可产生局部被动免疫保护力,保护仔猪肠道。
⑶ IgG主要通过肌肉注射由中枢免疫系统产生。但是,对新生仔猪起主要保护作用的抗体是sIgA,主要由肠道黏膜免疫产生。研究表明,80%的IgA抗体分泌细胞(ASC)定植于肠道相关淋巴结中(肠道黏膜免疫面积非常大,铺开犹如一个足球场。因此,sIgA主要由肠道黏膜免疫产生,小部分由中枢免疫产生)。母乳被动免疫保护哺乳仔猪主要依靠IgA浆母细胞传递到乳腺,并且sIgA在常乳中蓄积,这种传递被称为“肠道-乳腺-sIgA轴”[14]。
⑷ IgA主要由肠道黏膜免疫产生,需要消化道受到活病毒的刺激。多项研究表明,乳汁中PEDV中和抗体的产生需要活病毒刺激猪的消化道,因此返饲比肌肉注射疫苗能更好地刺激母猪乳汁中sIgA的产生。
⑸ 灭活苗或亚单位(S蛋白)苗肠道外疫苗免疫阴性母猪,不能很好地诱导黏膜免疫的产生,但可促进IgG的产生(主要在血清和初乳中)。常乳中的IgG水平会迅速下降,给仔猪提供的乳源性免疫保护力非常有限。但是,在某些情况下也有例外,如血清中IgG的水平非常高,被大量传递到初乳中,并且在常乳中保持较高的水平,在新生仔猪出生后第1周可以提供持续片段性的保护力。
⑹ 返饲活病毒可以很好地诱导母猪产生sIgA,而非肠道免疫,如肌肉注射灭活苗或亚单位苗不能很好诱导阴性母猪产生sIgA或免疫保护力,但作为自然感染后加强免疫非常有效。因为经消化道感染后肠道源的IgA记忆细胞不仅仅在小肠中存在,同时在系统性中枢免疫器官如脾脏中也存在,所以第2次接种灭活苗后作用于中枢免疫同样可以诱导sIgA的大量产生。
⑺ 临床中部分猪场返饲失败?常见原因如下:①返饲操作不当,如返飼材料的质量不合格,正确的做法是选取7日龄内出现典型症状的仔猪制作材料;返饲过程中出现高温或太阳光杀死了病毒;②猪场的伪狂犬病和猪瘟不稳定;③亚健康母猪问题,如PRRS和霉菌毒素等导致的亚健康母猪,这部分母猪在返饲后并未产生保护力,或产生的sIgA水平低,不能很好地保护仔猪,导致PED在猪场中零星发生。
5 结语
一场没有硝烟的战争让世人认识到冠状病毒的厉害,看不见的敌人给世界的经济带来了巨大的损失。作为养猪人,冠状病毒一点也不陌生,PEDV和TGEV这些大家熟知的冠状病毒给猪场同样带来了巨大的经济损失。此次的新型冠状病毒同样给养猪业带来了警示:PDCOV、PHEV和SADS-COV等已经出现的和未出现的冠状病毒时刻威胁着养猪业。PEDV等猪源性冠状病毒的防控与母猪肠道黏膜免疫反应密切相关,肠道接触活病毒才能激发母猪产生更多的sIgA,随后通过肠道-乳腺-sIgA轴使乳汁含有更多的保护性抗体。因此,改善母猪肠道黏膜免疫对防控PEDV等冠状病毒的感染非常重要。此外,猪场要避免PRRS和霉菌毒素等对母猪免疫力的破坏,防止PRRS引发猪场暴发PED。
参考文献:(14篇,略)

