配种前后补饲对鄂尔多斯细毛羊生产性能及血清学的影响
谷英,斯登丹巴*,孙海洲,满都拉,张崇志,桑丹,额尔德尼布拉格,德德玛,张春华,斯庆毕力格,董海娟
(1. 内蒙古鄂尔多斯市农牧业科学研究院,内蒙古 鄂尔多斯 017000;2. 内蒙古自治区农牧业科学院动物营养与饲料研究所,内蒙古 呼和浩特 010031;3. 内蒙古鄂尔多斯市乌审旗农牧业局家畜改良工作站,内蒙古 鄂尔多斯 017300)
鄂尔多斯细毛羊是鄂尔多斯市东南部毛乌素沙漠腹地及其周边地区的主要家畜养殖品种,为农牧民的主要收入来源,也是目前我国地市级存栏种群数量最多、生产性能优越的细毛羊品种。同时,鄂尔多斯细毛羊已通过国家地理标志产品认证,乌审旗已被划定为“鄂尔多斯细毛羊”区域保护范围。
鄂尔多斯细毛羊在放牧与少量补饲相结合的条件下,其繁殖率为110%左右、羔羊生长较慢、产肉性能不突出等问题普遍存在。同时,当前的饲养标准以及提高细毛羊母羊繁殖性能的试验研究,也均以单胎母羊胎儿生长与发育为主,甚少对细毛羊多胎性及多胎母羊妊娠期胎儿的生长与发育进行研究。鄂尔多斯细毛羊一般在每年的九月中旬至十月中旬配种,配种前为该地区放牧季节。由于养殖户对科学养殖技术的缺乏。因此,在夏秋放牧季节对细毛羊不进行补饲。多年来,在草场营养均衡优质的情况下,产羔率仅为110%左右,而草场营养状况较差的养殖户细毛羊产羔率仍为90%左右,严重影响养殖效益,同时未发挥细毛羊繁殖潜力。本团队前期对细毛羊进行配种前补饲,发现可显著提高细毛羊的产羔率,但对其饲喂量和机理未进行深入研究。本项目通过多次试验,确定补饲量后,对细毛羊配种前后加强营养,研究其对产羔母羊血清学及生产性能的影响,从而提高细毛羊的繁殖性能。
1 材料与方法
1.1 试验动物及试验期
选择90只体况良好,体重为(50.99±5.12)kg基础母羊,随机分为3组,A组为配种前补饲40 d,配种后补饲15 d;B组为配种前补饲40 d,配种后不补饲;C组为配种前后均不补饲。开始补饲前需预饲5 d,配种前后补饲量均为每只每日补充0.5 kg精补料,并且全部放牧。
1.2 日粮
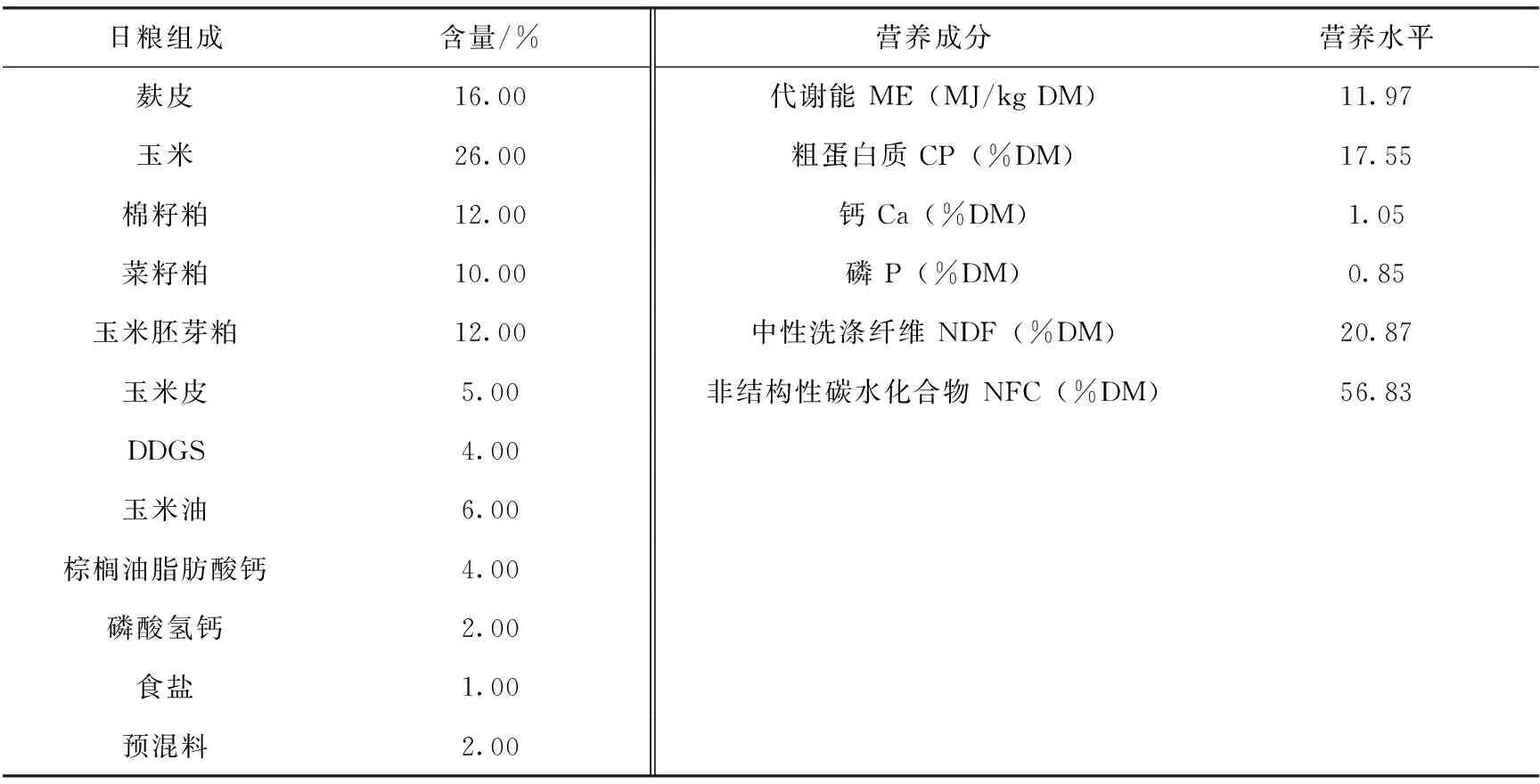
精补料为团队成员依据草场情况、基础母羊体重,参照细毛羊饲养标准[1]等配合,日粮组成及营养水平见表1。
表1 日粮组成及营养水平
日粮组成含量/%营养成分营养水平麸皮 16.00代谢能 ME(MJ/kg DM)11.97玉米 26.00粗蛋白质 CP(%DM)17.55棉籽粕 12.00钙 Ca(%DM)1.05菜籽粕10.00磷 P(%DM)0.85玉米胚芽粕12.00中性洗涤纤维 NDF(%DM)20.87玉米皮 5.00非结构性碳水化合物 NFC(%DM)56.83DDGS4.00玉米油6.00棕榈油脂肪酸钙4.00磷酸氢钙2.00食盐 1.00预混料2.00
注:每千克预混料成分:Fe(FeSO4·7H2O)170 g;Cu(CuSO4·5H2O)70 g;Mn(MnSO4·5H2O)290 g;Zn(ZnSO4·7H2O)240 g;Co(CoCl2·6H2O)510 mg;KI 200 mg;NaSeO3130mg;VA1 620 000 IU;VD3 324 000 IU;VE 540 IU;VK3 150 mg;VB12 0.9 mg;VB5 450 mg;泛酸钙 750 mg;叶酸 15 mg
1.3 饲养管理
补饲试验羊每天上午8:00和下午17:00分2次饲喂精补料,其余时间放牧自由采食,自由饮水。消毒、卫生防疫和日常管理按照规模化养殖场常规饲养方法进行。
1.4 测定指标及方法
1.4.1 体重的测定
正式饲喂前和配种时对所有试验羊均空腹称重,并计算试验母羊的日增重。
1.4.2 血液指标测定
于配种前40、3、20、10及0 d和配种后4、9 d分别采集血液,测定血清学指标,其中游离脂肪酸(NEFA)、葡萄糖、甘油三酯(TG) 、钙、1,25-二羟基维生素D3(1,25-(OH)2D3)、Ⅰ型胶原交联羧基端肽 (CTX)、甲状旁腺素(PTH)使用HITACH17080全自动生化仪测定,雌二醇(E2)、促卵泡激素(FSH)、促黄体生成素(LH)、孕酮、胰岛素、胰岛素生长因子-1(IGF-1) 使用DFM-96 r-放射免疫计数仪测定,试剂盒由北京北方生物技术研究所提供,试验严格按照试剂盒的说明步骤进行操作。
1.4.3 产羔率及羔羊初生重测定
母羊产羔后记录产羔数,并在毛干后,第一次吃乳前立即称羔羊初生重,佩戴耳标,记录公母。
1.4.4 基础母羊产毛性能测定
于次年5月底测定基础母羊的毛长、产毛量。
1.5 数据分析
所有数据采用SAS9.0一般线性模型统计分析 ,Duncan法进行多重比较。
2 结果与分析
2.1 配种前后补饲对细毛羊配种前体重和日增重的影响
由表2可知,三组试验羊配种前40 d初体重、配种时体重及日增重均差异不显著(P>0.05),但A、B补饲组比未补饲组(C组)配种时体重稍高一点,且日增重较高。
2.2 配种前后补饲对细毛羊血清学指标的影响
由表3可知,E2在配种前20 d和10 d的含量相近,差异不显著(P>0.05),配种后3组试验羊E2含量差异性显著(P<0.05),且C组>B组>A组。FSH含量在配种前C组稍高于A、B两组,但差异不显著(P>0.05);配种后5 d和9 d,C组显著高于其他两组(P<0.05)。LH在试验初期C组高于A、B组,随着A、B两组试验羊营养供给的提高,从配种前20d开始高于C组,但配种当天LH水平显著下降,随后增高,而C组从配种前20 d开始持续上升,且在配种后保持高水平,显著高于AB两组(P<0.05),A、B两组间差异不显著(P>0.05)。孕酮含量三组间无显著差异(P>0.05),但整体趋势为从配种前30 d开始到配种前10 d不断上升,配种时下降,随后上升。胰岛素配种前三组间无明显差异(P>0.05),整体随着配种期的接近呈上升趋势;配种后4 d和9 d时,C组显著低于AB两组(P<0.05),A、B两组间无明显差异(P>0.05)。IGF-1三组间差异不显著(P>0.05)。
表2 细毛羊配种前体重和日增重

组别配种前40 d体重/kg配种时体重/kg日增重/(g·d-1)A50.81a±6.0756.60a±6.330.15a±0.09B52.14a±4.9656.61a±4.770.11a±0.06C50.01a±6.1152.38a±5.620.06a±0.05
注:同一列不同字母代表差异性显著(P<0.05),相同字母或无字母代表差异性不显著(P>0.05)。下同
表3 基础母羊血清学指标

指标组别配种前40 d配种前30 d配种前20 d配种前10 d配种后0 d配种后4 d配种后9 d雌二醇A2.90±0.54a2.45±1.41a2.55±0.992.91±0.1.011.34±0.99b2.21±0.65b2.19±0.73bB2.81±0.85a2.81±0.72a2.98±0.963.05±0.892.90±0.93b2.79±0.82b2.82±0.76bC0.97±0.33b1.51±0.72b2.32±1.352.39±1.285.54±1.80a4.54±1.60a3.82±0.82aFSHA1.20±0.561.29±1.001.23±0.711.20±0.651.57±0.15b1.19±0.66b1.71±0.48B1.19±0.311.56±0.571.01±0.911.04±0.472.14±0.52a1.69±0.51b1.47±0.55C1.00±0.591.93±0.401.89±0.591.92±0.401.18±0.50c3.84±0.97a2.11±0.40LHA8.33±1.129.42±2,128.0 ±1.789.92±0.827.95±1.26b8.14±0.43b10.05±1.71B8.21±2.019.08±1.598.14±1.879.84±0.907.61±1.41b8.60±1.77b10.42±1.50C8.54±2.1010.62±1.017.95±0.749.52±1.0210.46±1.48a11.72±1.84a11.29±1.27孕酮A0.20±0.080.17±0.060.27±0.05a0.29±0.060.19±0.020.25±0.090.34±0.03B0.18±0.060.17±0.070.23±0.04a0.28±0.050.20±0.040.24±0.040.35±0.05C0.15±0.040.17±0.040.19±0.04b0.29±0.030.15±0.050.20±0.050.38±0.06胰岛素A14.31±1.3217.71±2.9821.21±1.8921.03±2.4520.17±2.1519.04±1.96a21.33a±5.18B17.45±2.1418.11±3.2519.41±2.8324.97±2.0720.72±4.8921.83±2.80a19.51±4.63C20.18±2.3817.81±3.6418.89±2.7819.45±2.6520.21±7.4713.48±2.45b11.97b±0.94IGF-1A365.42±108.21364.78±81.00339.61±85.29248.19±55.32172.55±37.24312.08±50.02337.10±21.94B446.34±89.67306.32±70.89321.55±70.41236.21±64.13224.13±25.75318.45±81.82347.63±78.48C312.08±62.33378.48±58.18321.13±75.99216.67±44.30218.30±61.83209.40±25.39293.87±74.59
由表4可知,NEFA在补饲前无明显差异(P>0.05),补饲后A、B两组均显著高于C组,而A、B两组间无明显差异(P>0.05);C组TG整体趋势低于A、B两组,个别时间点差性显著;1,25-(OH)2D3在试验开始前各组含量相近,试验期试验组A、B整体高于C组,但差异不显著(P>0.05);试验组A、B的PTH含量整体高于C组,但差异不显著(P>0.05);IGF-1、葡萄糖、钙、CTX在3组间无明显差异(P>0.05)。
表4 基础母羊血清学生化指标

指标组别配种前40 d配种前30 d配种前20 d配种前10 d配种后0 d配种后4 d配种后9 dNEFAA0.18±0.050.13±0.02a0.13±0.04a0.15±0.02a0.24±0.04a0.16±0.01a0.14±0.01aB0.18±0.060.14±0.03a0.11±0.03a0.14±0.03a0.21±0.04a0.14±0.02a0.14±0.04aC0.16±0.080.07±0.02b0.09±0.02b0.09±0.02b0.08±0.01b0.09±0.03b0.07±0.05b葡萄糖A1.28±0.243.22±0.212.23±0.532.81±0.182.19±0.252.61±0.373.01±0.38B1.04±0.313.46±0.371.71±0.472.99±0.232.19±0.302.92±0.263.20±0.13C2.71±0.222.90±0.213.19±0.412.65±0.242.91±1.962.06±0.363.62±0.18TGA0.08±0.020.13±0.050.11±0.05b0.24±0.160.12±0.01a0.20±0.03a0.28±0.14aB0.08±0.050.15±0.060.09±0.04b0.28±0.130.15±0.07a0.21±0.07a0.13±0.04bC0.08±0.010.11±0.010.28±0.06a0.21±0.110.07±0.06b0.14±0.04b0.24±0.08a钙A2.46±0.122.62±0.092.17±0.122.69±0.082.40±0.112.45±0.132.69±0.14B2.48±0.152.60±0.112.41±0.192.65±0.112.40±0.082.74±0.062.67±0.12C2.53±0.122.65±0.062.56±0.172.52±0.292.47±0.242.49±0.102.64±0.051,25-(OH)2D3A77.52±16.2177.18±3.3578.81±14.5581.10±17.6278.03±15.9073.69±13.1876.90±19.90B77.40±17.1173.18±5.8782.97±17.7185.10±18.1871.47±10.1376.77±10.9465.99±10.87C78.69±15.7668.10±10.1875.70±9.9771.44±15.3675.24±17.9967.30±11.4276.96±19.62CTXA36.12±5.6246.89±5.9836.45±2.9839.08±4.3234.64±8.9838.81±8.3137.22±8.49B31.94±4.8947.41±6.0139.49±3.1542.56±5.3037.70±10.1442.05±9.2741.12±5.44C43.88±4.3239.45±5.9642.23±6.6536.99±8.2348.57±4.3536.52±6.8835.48±2.99PTHA108.23±18.76140.11±11.21126.7819.21120.11±18.11134.48±25.12103.98±28.86136.75±19.12B121.05±23.12145.85±13.01127.74±15.42120.85±15.42112.75±15.93125.11±23.82130.00±18.47C94.39±10.10120.33±23.52111.48±26.49112.18±27.58103.94±24.63110.87±15.97109.81±19.80
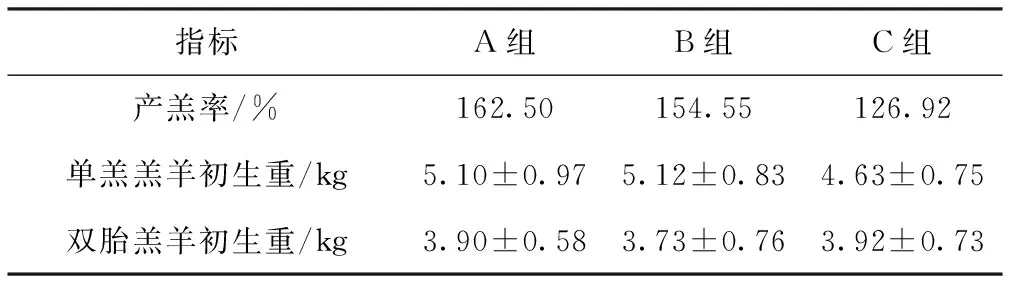
2.3 配种前后补饲对细毛羊产羔率及羔羊初生重的影响
由表5可知,基础母羊的产羔率依次为A组>B组>C组,产羔率A组与B组相比提高了7.95个百分点,与C组相比提高了35.58个百分点,B组与C组相比提高了27.63个百分点。单羔羔羊初生重A、B两组相近,稍高于C组,但差异不显著(P>0.05);双羔羔羊初生重3组无显著差异(P>0.05)。
2.4 配种前后补饲对细毛羊产基础母羊产毛性能的影响
由表6可知,基础母羊毛长和产毛量均为A组>B组>C组,但3组间差异不显著(P>0.05)。
表5 基础母羊产羔率及羔羊初生重
指标A组B组C组产羔率/%162.50154.55126.92单羔羔羊初生重/kg5.10±0.975.12±0.834.63±0.75双胎羔羊初生重/kg3.90±0.583.73±0.763.92±0.73
表6 基础母羊产毛量及毛长

指标A组B组C组毛长/cm10.00±0.719.80±1.359.75±0.76产毛量/kg6.00±0.655.86±0.865.74±0.33
3 讨论
3.1 配种前后补饲对鄂尔多斯细毛羊产羔性能的影响
多胎是养羊业多产、高产的基础。针对本地区细毛羊繁殖率低的现状,本试验在配种前通过饲喂高能量饲料,改善放牧羊的营养状况,可提高细毛羊排卵率,这与团队前期研究结果一致[2];同时有研究发现,以高能量的日粮补饲母羊少于一个情期不能提高母羊的排卵率[3]。因此,本试验结合基础母羊的膘情,选择补饲40 d,可有效提高母羊的体重,改善其营养状况,增加排卵率。本研究对配种后15天是否进行补饲进行了比较研究,研究发现补饲组可提高母羊的产羔率,说明配种后增强营养对受精卵的着床率有着较大的影响。通过配种前后共补饲55 d,试验组羊产羔率提高了35.58个百分点,达到了162.50%,具有显著的效果。
3.2 配种前后补饲对鄂尔多斯细毛羊血清学的影响
雌性母羊出生后卵巢上就形成了一个由大量原始卵泡和生长卵泡组成的卵泡库,在其以后的生殖过程中,卵泡的发育完全是一种动态过程。在每个发情周期中,都有1组卵泡同时生长发育,数量达 500-1000 个,但其中绝大多数(99.9%)在发育过程中闭锁退化,只有极少数的优势卵泡发育成熟至排卵[4]。卵泡的发育之所以呈现特殊的生理现象,一般认为与发情周期中的卵泡发育特点和生殖内分泌调节有关[5],而生殖内分泌与营养状况又有着密切的关系。本试验通过配种前后提高母羊营养,提高优势卵泡的形成率,同时促进黄体的形成,从而保证受精卵的着床率。
FSH是由垂体前叶分泌的一种糖蛋白[6],能促进小卵泡进入等级发育阶段,促黄体LH能通过促进类固醇激素合成和分泌来调节卵泡的发育和排出[7],二者是动物生殖和繁育过程中重要的生殖激素,且具有互相协同的作用[8]。同时研究发现,卵泡晚期孕酮水平与卵泡发育的数量相关[9],孕酮含量升高时卵巢储备功能有减退的变化[10],孕酮含量过高或过低均可导致卵泡过早黄素化或成熟障碍[11]。但也有报道指出血清孕酮水平升高对其妊娠结果无不良影响[12]。本试验研究发现,配种前及配种当天试验组和对照组孕酮含量无明显差异,配种前A、B两组LH均高于C组,促卵泡激素从配种前10 d开始上升,在配种当天A、B组均显著高于C组,结果与上述报道相近。
有学者指出,血清中雌二醇水平在受精之前对卵泡、卵母细胞成熟的调控发挥着重要作用[13],但在受精之后的作用仍然是一个有争议的问题。本试验发现,在配种前加强营养,试验羊血清中的雌二醇水平提高,高于对照组C组,配种后急剧下降,又低于对照组C组。根据产羔结果,A、B组产羔率均高于C组,这就说明雌二醇值越高,排卵数可能会越多。当然这只是推测,还需进一步试验论证。
3.3 配种前后补饲对鄂尔多斯细毛羊体重及羔羊初生重的影响
能繁母羊配种前后的体重不仅影响着产羔率的高低,并且对胎儿初生重及次年母羊的体重有着重要的影响。本试验配种前后补饲组母羊平均日增重比未补饲组提高90g,产羔后单胎羔羊初生重提高0.5kg左右,双胎羔羊无明显变化。扎木嘎[13]通过配种前20天补饲催情饲料,试验组母羊的营养摄入量得到了改善,试验组羊整体体况明显增加,本研究与上述报道结果一致。
3.4 配种前后补饲对鄂尔多斯细毛羊产毛性能的影响
在纺织业中羊毛的长度仅次于细度的重要性,而且长度决定着纱的质量,也就是从品质上来说,相同的细度,毛纤维越长,它的纺纱性就越好,产品品质就越好[14]。另外毛纤维长度还决定着正确纺纱工艺条件加工系统[15]。
付咏梅等[15]指出羊毛长度与营养水平有关,营养的不平衡或不足能使羊毛变短。本研究试验组基础母羊的毛长和产毛量均有所提高,但差异不显著,这与靳继鹏等[16]2018年对甘肃高山细毛羊研究的结果一致。这与补饲时间较短,对毛丛尚未起到作用相关。
4 结论
配种前后对鄂尔多斯细毛羊能繁母羊补充营养,可提高能繁母羊的体重,提高母羊的排卵率和受精卵的着床率,从而提高其产羔率;同时,可提高胎儿的初生重、母羊的产毛量和毛长。

