白藜芦醇苷介导SIRT1抑制未折叠蛋白反应-凋亡途径在肾缺血再灌注损伤中的作用*
谢志娟, 陈建英
1南华大学附属第一医院肾内科(湖南衡阳 421001); 2湖南省人民医院风湿免疫科(湖南长沙 410005)
失血性休克复苏后、肾移植术及肾部分切除术后不仅可引起肾脏缺血再灌注损伤,而且诱导氧化应激(ROS)反应,同时沉默信息调节因子(silent mating type information regulator, SIRT)、炎症及未折叠蛋白反应等信号通路促进肾上皮细胞过度凋亡[1-3]。我们前期研究证实[4],内质网未折叠蛋白反应-凋亡途径介导一系列生物学效应促进转化生长因子β1(transforming growth factor-β1, TGF-β1)诱导肺上皮细胞损伤。马懿等[5]发现,沉默信息调节因子1(recombinant sirtuin 1, SIRT1) 激动剂白藜芦醇苷上调SIRT1介导单核细胞趋化蛋白1(monocytes chemotactic protein-1, MCP-1)抑制氧化型低密度脂蛋白(oxidation low lipoprotein, ox-LDL)诱导巨噬细胞增殖、细胞氧化应激及炎性反应从而保护血管内皮细胞。而且我们前期研究发现白藜芦醇苷可通过介导TGF-β1/miR-21信号通路抑制足细胞增殖及NLRP3炎性小体活化的表达从而保护足细胞损伤,但是尚未探究白藜芦醇苷上调SIRT1是否介导未折叠蛋白反应-凋亡途径保护肾缺血再灌注损伤的具体分子机制[6]。本研究旨在探讨白藜芦醇苷介导SIRT1是否抑制未折叠蛋白反应-凋亡途径在肾缺血再灌注损伤中的作用。
1 材料与方法
1.1 主要仪器、实验动物、试剂及药品 雄性SD大鼠32只,体重380~420 g,由南华大学动物实验部提供。冷冻高速离心机及台式冷冻离心机(德国公司生产),超净工作台(苏信净化设备厂),白藜芦醇苷(纯度约99%)购自西安天一生物技术有限公司,DMEM培养液(Sigma-Aldrich,USA),胎牛血清(20%FBS,Gibco,USA),超氧化物歧化酶(SOD)及丙二醛(MDA)检测试剂盒、二辛可宁酸(BCA)法蛋白质定量试剂盒(Sigma,USA),白细胞介素-1β(IL-1β)及肿瘤坏死因子-α(TNF-α) ELISA试剂盒,SIRT1、X盒结合蛋白1 (X-box-binding protein 1, XBP1s)、转录激活子4(activating transcription factor 4, ATF4)及半胱天冬蛋白酶-3(caspase-3)等兔多克隆抗体(Santa Cruz,USA),2′,7′-二氯二氢荧光素二乙酸酯(DCFH-DA)(Sigma,USA),TUNEL检测试剂盒(Roche公司,美国)。
1.2 模型制备及处置 适应性喂养7 d后,营养状态良好,按照随机原则分为假手术组(A组)、肾缺血再灌注组(B组)、白藜芦醇苷组(C组)、SIRT1抑制剂EX-527组(D组),每组8只。实验前12 h禁食禁水。经腹腔注射1%氯胺酮(100 mg/kg)麻醉,备皮消毒后行正中剖腹手术。B组大鼠暴露肾脏,双侧肾蒂组织钝性分离并予以夹闭,肾脏由鲜红变为紫色提示阻断成功。缺血时间持续0.5 h后行再灌注,肾脏颜色又恢复到鲜红表明再灌注成功。C组术前45 min予以白藜芦醇苷10 mg/(kg·d)尾静脉注射。D组术前45 min予以SIRT1抑制剂(EX-527)5 mg/(kg·d)尾静脉注射。24 h后处死大鼠并收集肾脏标本及血清。本研究通过南华大学附属第一医院伦理委员会批准,动物处置方法依据动物伦理学标准。
1.3 方法
1.3.1 生化检查方法 采用硫代巴比妥酸法检测血清MDA及WST-1法检测SOD;采用DCFH-DA负载法检测肾细胞活性氧(reactive oxygen species, ROS)水平;采用ELISA法检测IL-1β及TNF-α水平;采用全自动生化分析仪(日本日立公司)检测血清肌酐(Cr)和血清尿素氮(BUN)浓度。以上严格按试剂盒说明书操作。
1.3.2 凋亡检查方法 采用TUNEL试剂盒检测细胞凋亡情况,以上严格按试剂盒说明书操作。
1.3.3 Western blot检测肾组织SIRT1、XBP1s、ATF4及caspase-3蛋白的表达 充分裂解肾组织提取蛋白并采用BCA法测蛋白浓度,提取等量蛋白质进行电泳(SDS-PAGE),采用硝酸纤维素(PVDF)电转膜;5%脱脂牛奶封闭1 h后,分别加入SIRT1、XBP1s、ATF4及caspase-3一抗4℃孵育过夜,α-Tubulin作为内参;次日用磷酸盐缓冲液洗膜,加入二抗室温孵育1 h。然后用显色(化学发光法),采集图像(UVP型凝胶图像分析系统),分析条带积分吸光度(Image J 软件),以A组为参照计算蛋白的表达量。
1.4 统计学方法 采用SPSS 23.0统计软件建立数据文件,计量正态分布数据用均数±标准差表示,采用单因素方差分析,组间多重比较采用SNK-q检验,多组与对照组比较采用Dunnett-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠氧化应激指标、肾功能及细胞凋亡指数的比较 与A组比较,B组血清Cr、BUN、MDA、ROS含量和细胞凋亡指数明显升高,SOD含量明显降低,差异有统计学意义(P<0.05)。与B组比较,C组血清Cr、BUN、MDA、ROS含量和细胞凋亡指数明显降低,SOD含量明显升高,差异有统计学意义(P<0.05),而D组通过下调SIRT1后各项指标变化与C组比较呈相反的趋势(P<0.05)。见表1。
表1各组中MDA、SOD、ROS、Cr、BUN及细胞凋亡指数水平的比较

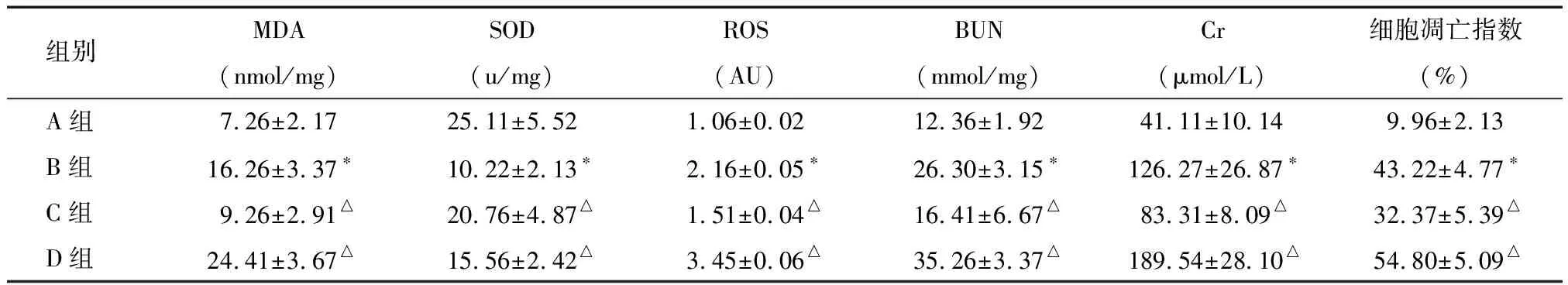
组别MDASODROSBUNCr细胞凋亡指数(nmol/mg)(u/mg)(AU)(mmol/mg)(μmol/L)(%)A组7.26±2.1725.11±5.521.06±0.02 12.36±1.9241.11±10.149.96±2.13B组16.26±3.37∗10.22±2.13∗2.16±0.05∗26.30±3.15∗126.27±26.87∗43.22±4.77∗C组9.26±2.91△20.76±4.87△1.51±0.04△16.41±6.67△83.31±8.09△32.37±5.39△D组24.41±3.67△15.56±2.42△3.45±0.06△35.26±3.37△189.54±28.10△54.80±5.09△
注:*与A组比较P<0.05; △与B组比较P<0.05
2.2 各组大鼠SIRT1、XBP1s、ATF4、caspase-3蛋白表达及炎症指标的比较 与A组比较,B组肾组织SIRT1、XBP1s、ATF4、caspase-3蛋白表达和IL-1β、TNF-α水平明显升高,差异有统计学意义(P<0.05)。与B组比较,C组肾组织SIRT1、XBP1s、ATF4、caspase-3蛋白表达和血清IL-1β、TNF-α水平明显降低,差异有统计学意义(P<0.05),而D组通过下调SIRT1后各项指标变化与C组比较呈相反的趋势(P<0.05)。见图1、表2。
表2各组中SIRT1、XBP1s、ATF4、caspase-3蛋白表达及血清IL-1β、TNF-α的比较


组别SIRT1(%)XBP1s(%)ATF4(%)caspase-3IL-1β(pg/mL)TNF-α(pg/mL)A组1.01±0.011.02±0.021.06±0.02 1.06±0.0151.11±12.23114.96±24.13B组2.26±0.33∗2.11±0.25∗2.61±0.27∗2.03±0.59∗83.77±10.24∗162.32±43.22∗C组1.66±0.31△1.71±0.41△1.44±0.34△1.41±0.37△51.79±14.05△116.21±17.25△D组3.13±0.40△2.72±0.28△3.32±0.31△2.42±0.63△90.23±11.01△188.93±44.14△
注:*与A组比较P<0.05; △与B组比较P<0.05
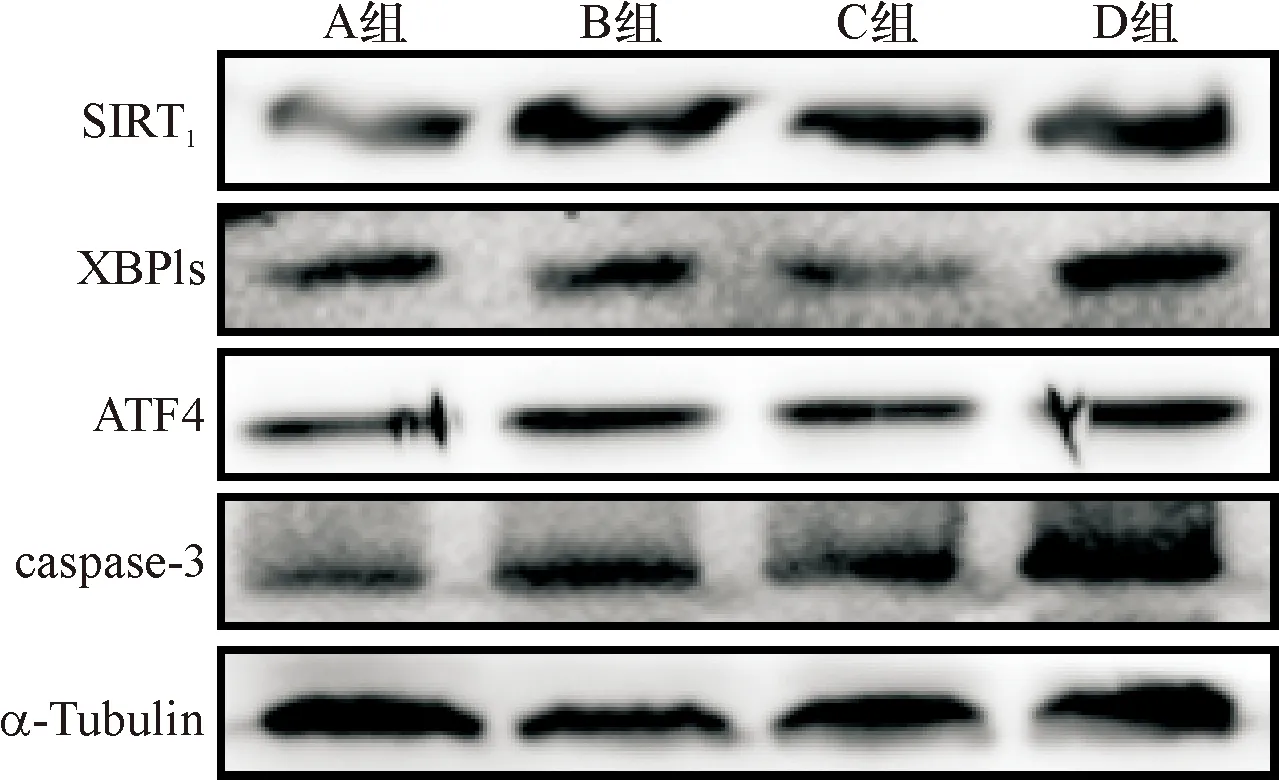
图1 Western blot检测SIRT1、XBP1s、ATF4及caspase-3蛋白表达
3 讨论
本课题组前期通过阻断肾血管0.5 h后再灌注的方法构建肾缺血再灌注损伤模型实验结果显示,肾组织病理学损伤明显加重及血清Cr、BUN等指标明显升高提示大鼠肾缺血再灌注损伤模型构建成功[7]。此次研究结果还发现,大鼠肾缺血再灌注后血清Cr、BUN及细胞凋亡指数明显升高提示与前期研究工作一致[6]。我们前期研究也发现[8-9],过氧化与抗氧化之间的调控失衡诱导氧自由基的爆发性释放和氧自由基自我清除能力显著下降,上述情况严重影响细胞膜的流动性和促进细胞过度脂质化,最后导致肠缺血再灌注后的细胞损伤。同时实验进一步证实炎症-凋亡途径在肠缺血灌注损伤中扮演重要的角色。鉴于上述实验基础我们通过大鼠肾缺血再灌注损伤也发现,血清MDA、ROS、IL-1β、TNF-α的含量和肾组织caspase-3蛋白表达明显升高,SOD含量明显降低,提示ROS/炎症/凋亡轴参与肾缺血再灌注损伤。与此同时,未折叠蛋白-凋亡信号途径是否参与缺血再灌注损伤另外的一个新机制?Liu等[10]研究显示,缺血再灌注损伤可介导氧化应激-未折叠蛋白反应途径诱发错误或未折叠蛋白质蓄积。而Tang等[11]研究显示持续或过度的未折叠蛋白反应的重要转录因子XBP1s及ATF4可介导caspase-3等信号途径诱发细胞焦亡或死亡,从而导致组织损伤。我们研究结果显示大鼠肾缺血再灌注损伤肾组织XBP1s及ATF4明显升高提示未折叠蛋白信号通路参与其分子病理机制。
Liu等[12]研究报道:上调SIRT1通过调控NLRP3炎症小体及NF-κB信号通路抑制机体内的炎症反应及氧化应激反应,从而保护LPS诱导的小鼠急性肺损伤。Kang等[13]研究也报道,SIRT1与未折叠蛋白反应途径相互作用调控B细胞氧化还原平衡与炎症的分子机制。SIRT1激动剂白藜芦醇苷是一种药效学多样化的多酚类化合物,具有调控内质网应激、凋亡、活性氧生成及炎性因子表达等生物效应[14-16]。并且本课题组前期研究表明,白藜芦醇通过阻碍细胞周期进展及促进细胞凋亡途径抑制人胚肺成纤维细胞细胞增殖[17]。因此,我们推测白藜芦醇苷可能通过调控SIRT1蛋白对大鼠肾缺血再灌注损伤的上述的机制产生影响。为了论证此假说,本研究依照文献经尾静脉注射SIRT1激动剂和抑制剂后发现,SIRT1激动剂即白藜芦醇苷10 mg/kg, 连续7 d干预后能有效抑制未折叠蛋白过度反应-凋亡途径及氧化应激-炎症反应途径等分子信号途径保护肾缺血再灌注损伤,然而SIRT1抑制剂即EX-527 5 mg/(kg·d), 连续7 d的预处理结果却与之相反。
综上所述,大鼠肾缺血再灌注损伤的病理生理机制与SIRT1介导的未折叠蛋白过度反应-凋亡及氧化应激-炎症反应信号通路激活有关,而SIRT1激动剂白藜芦醇苷通过抑制未折叠蛋白过度反应-凋亡及氧化应激-炎症反应途径发挥保护大鼠肾缺血再灌注损伤的作用。本研究仅通过体外研究模拟肾缺血再灌注损伤致病过程,我们下一步将进行体内实验进一步探究其机制及药物的靶向治疗提供一定的理论依据。

