植物精油及其成分对病原微生物抗菌机理的研究进展
萨仁高娃,胡文忠*,冯 可,修志龙,姜爱丽,老 莹,李元政,龙 娅,管玉格,姬亚茹,杨晓哲
(1.大连理工大学生物工程学院,辽宁 大连 116024;2.大连民族大学生命科学学院,辽宁 大连 116600;3.生物技术与资源利用教育部重点实验室,辽宁 大连 116600)
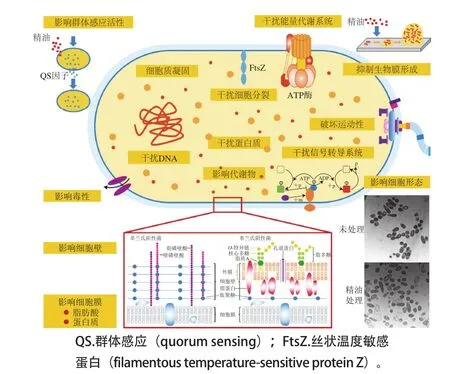
图1 精油及其成分对病原微生物的抗菌机理Fig. 1 Antimicrobial mechanisms of essential oils and their components against pathogenic bacteria
微生物对传统化学物质和药物的耐药性不断增强,促使科学家们开始寻找具有广谱抗菌活性的新型抗菌剂[1]。精油是由植物体中特化的分泌细胞合成后经采用现代萃取技术分离得到的挥发油[2]。植物细胞中的分泌物存在于植物的不同器官中,包括芽、花、叶、种子、嫩枝、茎、果实、根、木或树皮等,一般都是贮存在植物的分泌细胞、腺囊、腺道、腺毛或表皮细胞中[3]。具有广谱抗菌活性的植物提取物通常包括利用脂吸法或溶剂萃取法直接从植物体内提炼的净油、经过蒸馏法或超临界二氧化碳法萃取的精油、利用蒸馏法萃取精油时收集的产物纯露和这些挥发性混合物中分离得到的抗菌单体成分。净油、精油和纯露的抗菌效果源自它们含有的抗菌活性单体成分。在自然界中,植物在进化过程中产生具有挥发性的次生代谢物,主要作用是保护植物免受天敌(食草动物、昆虫和微生物)的危害,也会吸引一些昆虫来促进花粉和种子的传播[4]。精油是一种具有强烈感官特性挥发性化合物的复杂混合物,是许多植物产生的次生代谢物,也被称为挥发油[5]。精油为液态,易挥发,呈透明/有色状,可溶于脂类和有机溶剂,密度比水低。精油的主要成分是萜类化合物,特别是单萜(C10)和倍半萜烯(C15),其中也可能存在二萜烯(C20)。精油中也有许多其他的分子存在,包括醇、醛、酚、酮、脂肪烃、无环酯或内酯类、微量的含氮和含硫化合物等[3]。从各种芳香植物中提取的精油被认为是传统医学成果的重要组成部分。这些精油因抗氧化、抗菌等药用特性和强烈的香气而闻名,常用于食品保藏、止痛、镇定、消炎、解痉和局部麻醉[4]。精油可以抑制或延缓细菌、酵母和霉菌的生长[6-8],是一种可替代化学抗菌剂的天然抗菌剂[9]。根据目前的研究进展,精油及其成分对细菌细胞的作用机制主要包括:破坏细胞壁和细胞膜,干扰能量代谢系统,影响全细胞蛋白质、DNA和代谢组,改变细胞形态,影响细胞分裂,破坏运动性,抑制生物膜形成,影响QS活性,使细胞质凝固,干扰信号转导系统和影响毒力等(图1)。本文综述了植物精油及其成分对病原微生物的抗菌机理,旨在为精油及其成分的研究和应用提供依据。
1 精油及其成分的抗菌机理
精油的抗菌活性取决于其所含有的化学成分及具有抗菌活性的单一组分含量,这些抗菌分子可以自然存在于植物的活性成分中,也可以当植物体受到特定的生物或非生物刺激时,被特定的酶激活,作为对外源刺激响应的自身防御机制而合成[10]。精油的抗菌活性不是由一个特定的机制引起的,而是涉及整个细菌细胞的一连串反应[11]。精油中单一成分的抗菌机理可能受功能基团位置的影响,单一成分对不同病原菌的作用效果可能不同,抗菌成分含量不同可能导致抗菌效果不同。所以,确定精油的作用模式需要进行大量研究,明确精油及其抗菌单一组分的抗菌机理,同时在多个菌株和多种微生物中对其作用模式进行研究,才能进一步对其抗菌机理进行系统全面的解析。
1.1 对细胞壁的影响
细菌细胞壁有维持细菌固有外形、抑制机械和渗透损伤、协助细胞运动和生长、介导细胞间相互作用和防止大分子入侵等生理功能。细菌细胞壁是精油作用的首要靶点。革兰氏阳性菌和革兰氏阴性菌细胞壁结构的不同导致细胞对精油的耐受性不同,革兰氏阳性菌细胞壁的结构允许疏水分子轻易穿透细胞,通常革兰氏阳性菌比革兰氏阴性菌对精油更敏感[12]。革兰氏阳性菌的细胞壁是由多层网状结构的肽聚糖组成(大约占细胞干质量的90%~95%),并有脂磷壁酸和壁磷壁酸与之相连;革兰氏阴性菌的细胞壁含有单层肽聚糖(大约占细胞干质量的20%),不含磷壁酸,此外,在肽聚糖外覆盖着一层称为外膜的脂双层膜,由脂多糖、脂蛋白、膜孔蛋白和磷脂组成(图1)[13]。革兰氏阳性菌细胞壁的结构允许疏水分子轻易穿过,然而,革兰氏阴性菌细胞壁中外膜含有脂多糖,赋予细胞亲水表面,使革兰氏阴性菌对精油和其它具有抗菌活性的疏水性天然提取物具有更强的抵抗力[3]。但精油中的酚类化合物,如百里香酚和香芹酚,能干扰外膜,释放脂多糖[14]。精油的成分也能干扰细胞壁中的蛋白质。反式肉桂醛能降低外膜蛋白(outer membrane proteins,OMP)中OmpA、OmpC、OmpR和氨基酸转运蛋白的表达,破坏了细菌转运和扩散的活性[15]。碱性磷酸酶是存在于细胞壁和细胞膜之间的一种酶,正常情况下在胞外不能检测到其活性,但当细胞壁受到破坏导致透性增加时,碱性磷酸酶会渗漏到胞外[16]。刁文睿[17]的研究显示,随着公丁香精油处理浓度增加,金黄色葡萄球菌和大肠杆菌的碱性磷酸酶活力增加。Muthaiyan等[18]发现冷榨桔子精油能诱导耐药金黄色葡萄球菌细胞壁刺激因子相关基因(pbp、胞壁质囊和肽聚糖相关基因、自溶相关基因)的表达,进而抑制细胞壁合成,并促进细胞裂解。
1.2 对细胞膜的影响
细胞膜提供的渗透性屏障对于许多细胞功能来说是必不可少的,包括能量转换、物质运输、信息识别与传递、细胞免疫和代谢调控等,细胞膜也是控制膨压的必要条件[3]。疏水性是精油的典型特征,精油的疏水性使其进入细菌细胞膜而引起膜渗透性增加,破坏膜结构,使细胞内容物泄漏,最终导致细胞死亡,所以精油抗菌活性机制通常解释为精油对细胞膜结构和功能的毒性作用[19]。细胞膜通常是精油作用最关键的靶点,精油通过影响膜上脂肪酸和蛋白质而影响质膜正常的生理功能(图2)。

图2 精油及其成分对病原微生物细胞膜的影响Fig. 2 Effects of essential oils and their components on pathogenic bacteria
1.2.1 对细胞膜上脂肪酸的影响
精油及其成分的疏水性使它们能够扩散通过脂双层膜,影响细胞膜中不饱和脂肪酸的比例,并改变其结构[7]。当细菌细胞暴露在亚致死环境压力下,细胞膜组成会发生变化,保持膜完整性和功能以适应环境改变。膜脂改变依赖于物种和环境压力,包括饱和度、碳链长度、分支位置、顺反异构化和不饱和脂肪酸转化为环丙烷等变化。在精油亚致死浓度的处理条件下,细菌细胞膜中不饱和脂肪酸比例增加,导致细胞膜流动性增加,通过这种适应机制来维持细胞膜的结构和功能,增强细胞适应性[20]。Siroli等[21]研究了亚致死浓度的百里香精油、牛至精油、香芹酚、百里香酚、柠檬醛和trans-2-己烯醛对单增李斯特菌、大肠杆菌和肠炎沙门氏菌膜脂肪酸的影响,发现低浓度精油及其单体除了增加细胞膜中的不饱和脂肪酸含量,还增加反式异构体的含量以抵抗化学压力;两种革兰氏阴性菌在抗菌剂存在时,膜脂肪酸中环丙基脂肪酸含量改变;而抗菌剂处理后膜脂碳链长度增加被认为是用来抵消不饱和脂肪酸增加引起的膜流化效应,这些脂肪酸改变都是为了平衡膜流动性以适应环境压力。然而,在高浓度精油(高于最低抑菌浓度)处理后,细胞膜中不饱和脂肪酸比例降低,导致膜流动性的丧失和膜硬度的增加[22]。此外,精油还可能引起细菌细胞的氧化应激反应,加速膜脂过氧化,经百里香酚和肉桂醛处理的单增李斯特菌的丙二醛(膜脂过氧化最终产物)含量显著升高[23]。Siroli等[21]分析了精油及其成分处理后的食源性病原微生物的挥发性成分的变化,发现醛类、醇类、内酯类、短链和中链脂肪酸及其酯类含量增加,这些增加的挥发性成分是氧化不饱和脂肪酸产生的。
1.2.2 对细胞膜上蛋白质的影响
精油还会改变膜蛋白的渗透性和功能。富含酚类物质的精油可以嵌入到细菌的磷脂双层膜中,并与蛋白质结合,阻止蛋白质执行正常的功能[19]。假单胞菌通过去饱和酶的生物合成途径合成不饱和脂肪酸,di Pasqua等[20]发现多种精油单体处理后的荧光假单胞菌细胞膜中不饱和脂肪酸比例降低而饱和脂肪酸比例增加,推断抗菌化合物的存在可能影响去饱和酶的作用。但精油不会影响顺反异构酶,即使它通常在细胞适应环境压力时是活跃的[22,24]。吕飞等[25]研究显示,0.175 μL/mL肉桂精油处理腐败希瓦氏菌后,膜蛋白的18 kDa亚基含量增加而40 kDa亚基含量减少,0.350 μL/mL肉桂精油处理组膜蛋白的49、43 kDa亚基含量增加,且随着精油浓度增加,膜蛋白破坏程度增加。
精油及其成分通过影响膜脂和膜蛋白,改变膜的流动性和渗透性,影响膜电位,破坏电子传递系统,导致细胞内物质如离子、细胞质、ATP、核酸和蛋白质等泄漏,最终细胞解体死亡[26]。李娜[27]研究了紫苏精油对大肠杆菌的抗菌机理,发现在精油的作用下,菌体细胞膜破坏使Na+、K+离子泄漏,菌悬液相对电导率显著高于未处理的大肠杆菌,且精油处理使膜脂过氧化程度增加。何文兵[28]研究显示,黄檗果实精油可使沙门氏菌细胞膜通透性和完整性发生改变,使菌液相对电导率、蛋白质含量、还原糖含量、MDA含量升高,菌体ATP含量降低。de Sousa Guedes等[29]利用流式细胞术研究了两种薄荷精油对菠萝和芒果汁中大肠杆菌、单增李斯特菌和肠炎沙门氏菌的抗菌机理,结果表明精油通过多靶点的作用模式抗菌,包括破坏细胞膜,增加渗透性和电位去极化,以及抑制外排泵和呼吸活性。Yap等[30]发现肉桂皮精油能降低大肠杆菌细胞表面的负电荷,通过细胞膜酸化和蛋白质变性使细胞膜发生不可逆的损伤。Cherrat等[31]首次利用荧光各向异性法测定了英诺克李斯特菌和大肠杆菌的细胞膜流动性,发现月桂精油使膜表面硬化,但增强了膜核心的流动性。
1.3 对能量代谢的影响
在细胞呼吸作用中,细胞膜上电子传递链产生跨膜质子梯度,这是合成ATP所必需的,这个过程由具有ATP酶活性的多种酶催化,包括ATP依赖的转运蛋白和F1Fo-ATP酶复合物[32]。F1Fo-ATP酶是一种可逆的质子转运泵,它可以利用ATP水解产生的能量从细胞质中泵出质子,这种质子外流增强了质子梯度,并有助于调节细胞质pH值[15]。精油能通过破坏细胞膜使ATP流失[33],或通过干扰质子动力、改变ATP酶构象和抑制ATP酶相关亚基的表达,进而影响ATP合成[15]。Mutlu-Ingok等[34]利用小豆蔻、小茴香和莳萝草精油处理空肠弯曲杆菌和大肠弯曲杆菌,结果显示处理后胞外ATP浓度显著增加,说明细胞膜破坏导致ATP流失。Friedman等[35]发现经香芹酚处理后,蜡样芽孢杆菌胞内ATP含量减少,但胞外ATP含量没有相应增加,通过测定膜电位以及K+和H+的通透性发现,离子梯度的丧失破坏了细胞内的基本能量代谢过程,从而导致细胞死亡。研究发现反式肉桂醛使阪崎肠杆菌F1Fo-ATP酶下调,进而抑制了ATP合成[36],并能抑制鼠伤寒沙门氏菌ATP合酶α亚基的表达[37]。Gill等[38]研究显示5 mmol/L的丁香酚和40 mmol/L肉桂醛能抑制葡萄糖缺乏的单增李斯特菌生成ATP,而在葡萄糖丰富的培养基中培养后,肉桂醛处理使单增李斯特菌胞内ATP迅速耗尽,而丁香酚处理单增李斯特菌胞内ATP未消耗,可能原因是丁香酚限制单增李斯特菌对葡萄糖的利用能力,抑制了F1Fo-ATP酶,并可能引起细胞离子泄漏,肉桂醛与细胞膜的相互作用是通过离子的泄漏而不是ATP等较大细胞成分的泄漏,从而分散质子动力,导致胞内ATP快速消耗。Chan等[39]利用生物发光大肠杆菌生物传感器HB101_pUCD607_lux研究了异硫氰酸烯丙酯和肉桂醛的剂量-反应关系及作用机制,结果表明异硫氰酸烯丙酯和肉桂醛处理的样品生物发光量显著降低,这是由于ATP和NADPH降低,影响了细菌的代谢活性,而不是仅仅由于细胞膜的屏障功能破坏引起ATP和NADPH的泄漏。
1.4 对蛋白质的影响
精油中的某些成分通过作用病原菌全细胞蛋白质,进而对病原菌的多种生命活动产生影响。例如,山柰精油使大肠杆菌、鼠伤寒沙门氏菌和金黄色葡萄球菌的全蛋白质电泳结果中条带明显减少,且灰度减弱[40]。公丁香精油能抑制金黄色葡萄球菌和大肠杆菌蛋白质的合成[17]。蛋白质作为生命现象的物质基础,是细菌中各种生理功能的行使者,通过蛋白质组学的手段分析抗菌剂对菌体细胞全蛋白质谱的影响,能全面、系统地解析抗菌机理。Silva等[37]评估了鼠伤寒沙门氏菌生物膜细胞和肉桂醛处理的生物膜细胞表达的差异蛋白模式,发现肉桂醛处理后有2 种蛋白质(RNA聚合酶α亚基和延伸因子EF-Tu)水平上调,7 种蛋白质(烯醇化酶、ATP合酶β亚基、果糖二磷酸醛缩酶、过氧化物酶、丝氨酸羟甲基转移酶、膜蛋白和肽基脯氨酰基顺反异构酶)水平下调。Lanciotti等[41]研究了单增李斯特菌Scott A细胞对亚致死剂量的抗菌剂(乙醇、柠檬醛、香芹酚、E-2-己烯醛和百里香精油)的适应性,与最适培养条件下的对照组细胞相比,经抗菌物质处理1 h的单增李斯特菌中有223 个蛋白点合成水平增加或减少(不低于或不高于2 倍,P<0.05),聚类分析表明,不同处理之间的蛋白质组谱图不同,蛋白质组的适应和形成主要涉及细胞周期控制、细胞分裂、染色体、细胞运动性和调控相关蛋白、碳水化合物、丙酮酸、核苷酸和氮代谢、辅助因子和维生素以及应激反应。Sun Yangying等[42]采用同位素标记相对和绝对定量法以及二维液相色谱/串联质谱研究了1,8-桉叶素(0.25 mg/mL,3 h)对沙门氏菌的血清蛋白表达量的影响,阐明了1,8-桉叶素的抗菌机理,结果显示,1,8-桉叶素对沙门氏菌细胞壁和细胞膜结构有明显的破坏作用;实验组共提取3 011 种蛋白,其中差异表达蛋白435 种(差异表达倍数大于1.5 倍),上调123 种,下调312 种;差异表达蛋白质参与了935 个细胞内生物过程、98 种细胞成分、477 个分子功能和86 个京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路,其中,与碳水化合物、核苷酸、氨基酸、脂质和能量代谢相关的蛋白在1,8-桉叶素处理后发生显著变化。di Pasqua等[43]采用基于双向电泳(two-dimensional electrophoresis,2-DEs)和基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF MS)的蛋白质组学方法,研究了在百里香酚亚致死浓度下生长的肠炎沙门氏菌的蛋白质表达变化,结果表明,经百里香酚处理后,许多蛋白质表达水平上调或下调,不同功能的蛋白质发生了显著变化;硫氧还蛋白-1在百里香酚处理的细胞中未表达,可能是由于百里香酚引起了细胞压力;热应激保护机制的关键伴侣蛋白(如GroEL和DnaK)上调或合成,表明百里香酚的存在引起了肠炎沙门菌细胞的应激反应;细胞OMP表达上调,过多的OMP合成引起错误折叠OMP的积累可能导致细菌的包膜应激反应;百里香酚处理后,磷酸转移酶系统中的蛋白质含组氨酸的磷酸载体蛋白浓度降低了一半以上;百里香酚使外膜孔道蛋白(tolerant colicin,TolC)表达上调,TolC是组成革兰氏阴性菌耐药性外排泵的最重要成分,表明百里香酚可能会影响肠炎沙门氏菌的耐药能力;DNA结合蛋白H-NS和50S核糖体蛋白L7/L2在百里香酚处理后表达水平下调,而30S核糖体蛋白S1表达水平上调;百里香酚破坏了柠檬酸代谢途径以及许多参与合成ATP的酶。
1.5 对DNA的影响
DNA是细菌在细胞物质合成和遗传过程中具有重要作用的遗传信息载体,它的任何损伤都会影响遗传物质正常的复制及生长繁殖,而精油中的成分可以破坏DNA结构,或抑制基因表达[19]。研究发现,韩茵陈(Artemisia iwayomogi)精油的主要成分vulgarone B使金黄色葡萄球菌的DNA泄漏,处理时间延长导致DNA裂解,同时vulgarone B能与pBR322质粒载体DNA或λ DNA相互作用,或引起DNA损伤[44]。冷榨橘子精油能诱导耐药金黄色葡萄球菌DNA代谢相关基因表达部分上调和部分下调,主要干扰的DNA代谢包括DNA复制、重组和修复,此外,橘子精油还通过影响细胞壁相关基因的表达促使细胞裂解[18]。精油引起DNA损伤的具体机制仍不清楚,还有待进一步研究。然而,Kohanski等[45]认为抗菌药物对细菌的杀灭能力可能是药物结合的拓扑异构酶与裂解的DNA之间形成稳定相互作用复合物的作用,在抗菌剂存在时,复制叉停滞导致DNA复制机制受阻,DNA合成受到抑制,最终导致细胞死亡。
1.6 对代谢组的影响
当生存环境变化时,细菌代谢物会产生变化,分析环境胁迫对细菌胞内和胞外代谢组的影响通常运用的方法有核磁共振、微阵列、气相色谱-质谱和液相色谱-质谱等[46-47]。近年来,这些技术已经用于研究具有抑菌和/或杀菌活性的天然分子对病原菌代谢组的影响。Picone等[48]评价不同浓度香芹酚(0.67、1.33、2.00 mmol/L)对好氧条件下培养的大肠杆菌555细胞甲醇-水提取代谢物的影响,结果显示,随着香芹酚处理浓度增加,葡萄糖浓度增加,而有机酸(除甲酸盐)浓度降低;香芹酚浓度在0~1.33 mmol/L之间时,甲酸盐浓度随香芹酚浓度的增加而增加,大肠杆菌发酵过程中产生的主要糖分子甲酸盐的增加,表明代谢可能向发酵转变,2.00 mmol/L香芹酚处理甲酸盐浓度下降至0,表明在香芹酚浓度最高时,大肠杆菌生存能力丧失,导致代谢停滞,细胞中甲酸盐消失,甲酸盐是细胞死亡前的最后一个碳源;芳香族氨基酸的浓度在最低浓度香芹酚处理时保持不变,而在较高浓度时显著增加,但丙氨酸不受干扰。Hossain等[49]利用固相微萃取-气相色谱质谱联用法分析了最低抑菌浓度的肉桂醛对大肠杆菌BL21代谢组的影响,研究显示肉桂醛能影响大肠杆菌的生长和代谢,在对数生长中期代谢产物较多,代谢产物种类和浓度变化与细胞密度和肉桂醛的剂量有关,间歇加入肉桂醛(2 g/L)后,分离出约25 种不同的化合物,包括吲哚、烷烃、乙醇、有机酸和酯类等。
1.7 对细胞形态的影响
精油及其成分通过破坏细胞壁、细胞膜和引起细胞内容物泄漏,导致细菌细胞形态的改变,甚至破损。观察精油及其成分对细胞形态的影响主要利用扫描电子显微镜、透射电子显微镜和原子力显微镜等可视技术。Zhang Yunbin等[50]利用扫描电子显微镜观察发现,未处理的大肠杆菌细胞壁呈特殊的条纹状,金黄色葡萄球菌细胞膜表面光滑;在经肉桂精油处理后,大肠杆菌细胞表面呈褶皱和不规则状,且部分细胞胀破,而金黄色葡萄球菌出现大量凹陷和畸形细胞。Chen Zhifen等[51]通过扫描电子显微镜观察发现,呈完整光滑短杆状的大肠杆菌经Alpinia guilinensis精油处理后,细胞相互黏附,出现变形、凹陷、萎缩和破裂的现象;透射电子显微镜观察显示,未处理的大肠杆菌细胞完整,细胞壁和细胞膜清晰可辨,细胞质致密且均匀分布,精油处理后细胞明显受损,细胞壁和细胞膜破坏,细胞质分布不均匀,部分细胞壁变厚,甚至无法分辨,说明发生了膜裂解。la Storia等[52]利用原子力显微镜观察了3.3 mmol/L香芹酚处理的热杀索丝菌1R2、麦芽糖肉食杆菌9P、植物乳杆菌48M、英诺克李斯特菌1770、大肠杆菌32、蜂房哈夫尼菌53M、莓实假单胞菌25P和变形斑沙雷菌42M的细胞表面变化,发现处理前细胞表面光滑均匀且未见明显损伤,但处理后所有菌株细胞表面结构均发生变化;其中,热杀索丝菌1R2表面出现明显的凹凸不平,麦芽糖肉食杆菌9P多数细胞出现分裂间隔,植物乳杆菌48M和英诺克李斯特菌1770细胞顶端可见直径约为5 nm的囊泡,麦芽糖肉食杆菌9P、植物乳杆菌48M和英诺克李斯特菌1770个别细胞边缘出现塌陷区域,大肠杆菌32和莓实假单胞菌25P细胞完全塌陷到载玻片上且细胞表面出现皱纹和锯齿状(有颗粒),蜂房哈夫尼菌53M和变形斑沙雷菌42M表面严重变形;同时,经香芹酚处理后的细菌长度和宽度缩短,表面粗糙度和表面积比增加。Nguyen等[53]研究发现经山苍子叶精油处理后,两株大肠杆菌出现细胞丝化的现象,且长度和宽度均增加。Kwon等[54]利用扫描电子显微镜观察了肉桂醛对蜡样芽孢杆菌形态的影响,发现未处理蜡样芽孢杆菌细胞呈分离的杆状,经肉桂醛处理后,细胞变为细长的丝状结构,细胞之间不分离,不完整的隔膜位于丝状细胞之间。Oussalah等[55]利用透射电子显微镜观察发现经过牛至、肉桂和香薄荷精油处理后大肠杆菌O157:H7和单核增生性李斯特菌的形态破损和细胞膜破坏,其中,牛至精油处理的大肠杆菌细胞壁上有孔洞或白点。
精油对革兰氏阴性菌细胞形态的影响比对革兰氏阳性菌强。研究显示,香芹酚更容易影响革兰氏阴性菌细胞的形态,几乎所有革兰氏阴性细菌在香芹酚处理后表面的粗糙度更显著增加,可能因为革兰氏阴性菌的外膜是香芹酚首要靶点;然而,通常认为革兰氏阴性菌对精油更有抵抗力,所以革兰氏阴性菌细胞表面结构的改变也可以解释为对应激的适应性反应,香芹酚处理可能增加了外膜成分的暴露(如蛋白质和脂质),导致粗糙程度增加[52]。在革兰氏阳性菌中,香芹酚通过肽聚糖层,然后作用于细胞质膜上,细胞膜的结构变化,如流动性的改变,可能会导致革兰氏阳性细胞壁的外部表面发生轻微的改变,使其粗糙程度下降[56]。
1.8 对细胞分裂的影响
细菌细胞分裂由FtsZ控制,这是一种原核同源的微管蛋白[57]。依赖GTP的FtsZ在细胞分裂位点装配形成细丝,这是一种称为Z-环的高度动态的聚合结构,在细胞中组装并收缩细胞包膜,最终将母细胞分离成两个子细胞[58]。精油的某些成分可以作用于细菌中的蛋白质,并可能影响细胞分裂。Domadia等[59]研究显示,肉桂醛抑制体外FtsZ的组装反应和键合,扰乱大肠杆菌体内Z-环的形态,降低单位细胞长度Z-环的频率,肉桂醛抑制依赖GTP的FtsZ聚合,抑制GTP水解;大肠杆菌活细胞共聚焦显微镜结果显示,肉桂醛特异性靶向作用于Z-环空间排列,使Z-环消散,使Z-环形成的频率降低近一半;该研究者还预测了FtsZ的肉桂醛结合区域为C末端区域的肉桂醛结合区(包括FtsZ的T7环),并假设肉桂醛与FtsZ结合,扰乱Z-环的形成,并抑制它的装配动力。Kwon等[54]发现肉桂醛处理蜡样芽孢杆菌后,细胞变成细长的丝状结构,子细胞不会与上代细胞分离,因为隔膜的形成是不完整的。Muthaiyan等[18]研究显示,冷榨橘子精油能诱导耐药金黄色葡萄球菌细胞分裂相关基因下调,包括divIB、ftsA、ftsL和ftsW。la Storia等[52]发现香芹酚处理的麦芽糖肉食杆菌9P细胞中存在分裂隔膜,可能是由于香芹酚影响了细胞分裂相关蛋白质。
1.9 对细菌运动性的影响
运动性在宿主与微生物的相互作用中起着重要的作用,细菌的定植和毒力特性包括多个生物学过程,即信号转导、趋化性和鞭毛运动[15]。精油及其成分通过影响鞭毛相关蛋白质合成,破坏运动性相关蛋白,干扰信号转导系统,降低驱动鞭毛运动所需的质子动力来影响细菌的运动性[3]。Amalaradjou等[36,60]进行的实时荧光定量反转录聚合酶链式反应结果显示,反式肉桂醛显著降低了阪崎肠杆菌运动性相关基因的表达,包括鞭毛结构和生物合成相关的基因fliD、flhD和flgJ,以及鞭毛定子蛋白相关基因motA和motB,经亚抑制浓度反式肉桂醛处理后,细菌运动性显著降低。Burt等[61]将香芹酚和对伞花烃分别与大肠杆菌O157:H7过夜培养后,发现1 mmol/L香芹酚处理的细菌无鞭毛且不运动,鞭毛蛋白含量显著下调,鞭毛合成受阻,1 mmol/L对伞花烃处理的细菌有鞭毛且运动,当对伞花烃浓度增加至10 mmol/L时,细菌不运动且鞭毛蛋白含量显著下调;在大肠杆菌O157:H7对数生长期添加香芹酚和对伞花烃培养后,0.3~1.0 mmol/L香芹酚处理的细菌鞭毛蛋白含量变化不显著,0.5、0.8、1.0 mmol/L香芹酚处理的细菌不运动,0.3~0.8 mmol/L对伞花烃处理的细菌鞭毛蛋白含量变化不显著,0.3 mmol/L对伞花烃处理的细菌运动性降低,0.5 mmol/L和0.8 mmol/L对伞花烃处理的细菌不运动。Gill等[62]研究显示,5 mmol/L和10 mmol/L丁香酚、香芹酚和肉桂醛均抑制了大肠杆菌和单增李斯特菌的鞭毛运动,可能是由于膜质子梯度耗散直接抑制鞭毛运动,或由于结构的变化,如鞭毛的丧失导致运动能力的丧失。van Alphen等[63]研究显示,亚抑制浓度香芹酚处理的空肠弯曲杆菌运动性丧失,免疫印迹结果显示香芹酚未影响鞭毛蛋白质表达,电子显微镜观察发现香芹酚处理后的细菌鞭毛仍然存在,说明香芹酚抑制了空肠弯曲杆菌鞭毛的功能,但不影响鞭毛的合成;此外,香芹酚使空肠弯曲杆菌运动能力丧失,不是由细胞内ATP水平的降低引起的,且香芹酚抑制了细菌对人上皮细胞的侵袭。Inamuco等[64]发现香芹酚能抑制鼠伤寒沙门氏菌的运动性,处理后细菌鞭毛仍然存在,且处理后鼠伤寒沙门氏菌运动能力的丧失与细胞内ATP水平无关,香芹酚能抑制细菌对猪上皮细胞的侵袭,但不影响细菌黏附;此外,香芹酚处理鼠伤寒沙门氏菌后,宿主细胞的防御素的基因表达降低。
1.1 0 对生物膜的影响
生物膜是指细菌附着于活性或惰性实体表面形成的菌落,具有较强黏附力,一般消毒剂和抗生素很难穿透生物膜的胞外脂多糖基质层,造成清洗和杀菌困难[65]。生物膜的形成大体分为3 个阶段,即黏附、增殖/成熟和游离/传播[66]。生物膜的形成有利于细菌存活、防止干燥、抑制抗生素在微生物细胞中的扩散和渗透、代谢合作以及通过水平基因转移提高遗传多样性[15]。多种精油及其成分能影响病原微生物的生物膜。金黄色葡萄球菌在生物膜的增殖和成熟阶段,会产生由多糖、蛋白质和DNA等成分组成的胞外基质,构成金黄色葡萄球菌胞外基质中最主要的多糖为细胞间多糖黏附素(polysaccharide intercellular adhesion,PIA),茶树油能减少金黄色葡萄球菌PIA的表达;同时,金黄色葡萄球菌胞外DNA影响生物膜的黏附和成熟,而茶树油能抑制胞外DNA的释放,进而抑制生物膜的形成,此外,茶树油还能抑制生物膜相关基因(icaA、sarA、cidA和hlA)的表达[66]。周慧[67]研究显示,鼠尾草精油能有效抑制不锈钢、塑料和玻璃表面金黄色葡萄球菌生物膜的形成,且随着精油浓度增加、作用时间延长,生物膜清除率增加。Amalaradjou等[36]研究结果表明,反式肉桂醛通过抑制胞外多糖的合成(纤维素)、鞭毛的形成和功能,以及通过减少基因表达来抑制细胞间信号传导,从而减少坂阪崎肠杆菌的生物膜形成。Nostro等[68]研究显示,清除金黄色葡萄球菌和表皮葡萄球菌产生的生物膜所需要香芹酚和百里香酚的浓度是抑制浮游生物群所需要浓度的2~4 倍,抗菌素的亚抑制浓度能够抑制聚苯乙烯微量滴定平板上生物膜的形成;在抑制生物膜的形成方面,酸性的香芹酚比中性的更有效[69];含有香芹酚和肉桂醛的聚合物薄膜逐渐释放出抗菌物质,可能通过降低黏附能力和干扰鞭毛运动抑制葡萄球菌和大肠杆菌生物膜的形成[70]。Silva等[37]发现肉桂醛降低了鼠伤寒沙门氏菌生物膜的生物量和代谢活性,浮游细胞、生物膜细胞和肉桂醛处理的生物膜细胞的蛋白质组学分析显示,与浮游细胞蛋白组相比,生物膜细胞中过氧化物酶、ATP合酶α亚基、共轭转移切口酶/解旋酶TraI、延伸因子G表达上调,肉桂醛处理后,这些蛋白质下调,说明肉桂醛通过干扰这些蛋白质而影响鼠伤寒沙门氏菌生物膜的形成。Kim等[71]研究显示,体积分数0.05%的肉桂精油和肉桂醛对铜绿假单胞菌生物膜的形成有明显抑制作用,体积分数0.01%的肉桂精油、肉桂醛和丁香酚能显著抑制出肠血性大肠杆菌O157:H7生物膜的形成;同时,肉桂精油显著下调了肠血性大肠杆菌O157:H7生物膜形成相关基因csgAB的表达。
1.1 1 对群体感应活性的影响
细菌通过称为QS系统的细胞间通信系统,感知环境中低分子质量、可扩散的信号分子来调控菌体密度,并在信号分子达到阈值时启动相关基因表达,从而调控细菌的生理行为,以适应环境的变化[72]。QS可以调节许多活动,如毒性因子表达、生物膜形成、胞外蛋白酶产生、DNA转录、生物发光、色素的生成、质粒的转移、群集运动、植物与微生物之间的交流和次生代谢物的产生等。QS基因的表达引起化学信号分子的产生,这些分子称为自体诱导物(autoinducer,AI)或细菌信息素,当细菌到达阈值浓度时,AI随着细菌数量的增长而产生,导致特定基因的激活或抑制[73]。近年来,关于精油作为QS的无毒抑制剂的研究越来越广泛[74]。酰化高丝氨酸内酯类(N-acyl-homoserine lactones,AHLs)是革兰氏阴性菌QS系统中最重要的一类AI信号分子,能够调控许多生理特性的表达。绿薄荷精油对温和气单胞菌AHLs的分泌有抑制作用,并且呈现剂量依赖性,同时,绿薄荷精油通过干扰温和气单胞菌的QS系统,进而抑制生物膜的形成、胞外蛋白酶活力和细菌迁移(群集和泳动)[72]。陈建烟[75]从花叶艳山姜叶片中提取出精油,发现花叶艳山姜叶片精油抑制了黏质沙雷氏菌和铜绿假单胞菌的QS活性,其进一步对精油中具有QS抑制活性的成分进行追踪,结果显示,该化合物为二氢-5,6-去氢卡瓦胡椒素。反式肉桂醛对大肠杆菌、铜绿假单胞菌和化脓链球菌的QS均有抑制作用[15]。Yap等[30]利用两株大肠杆菌生物传感器,证实了肉桂精油可能具有抗QS作用,体积分数0.005%、0.0075%和0.01%的精油均抑制了分别携带lasR和luxR受体基因的大肠杆菌[pSB401]和[pSB1075]的生物发光。Myszka等[76]通过分析百里香精油、香芹酚和百里香酚对荧光假单胞菌KM121的AHLs、运动性、鞭毛基因(flgA)表达和生物膜形成能力的影响,发现百里香精油及其成分具有抗QS和抗生物膜的潜力。寻找靶向细菌QS的新化合物是开发新型抗生素的一个重要的策略,植物源抗生素通过抗QS系统,有效抑制细菌的致病性,且不会引起细菌耐药性。
此外,精油及其成分对病原微生物细胞的抑制作用,还包括使细胞质的凝固、对细胞信号转导和毒力的影响。Gustafson等[77]发现茶树精油处理后,大肠杆菌细胞质凝固,可能是蛋白质变性导致的。细菌中存在一种称为双元系统的信号转导系统,研究表明,冷榨橘子精油能诱导耐药金黄色葡萄球菌双元系统相关基因vraS、vraR、arlS和arlR表达上调,vraSR双元系统正向调控多个参与细胞壁合成的基因,arlSR双元系统参与自溶速率和与聚合物附着有关的细胞壁活性,精油引起这些基因表达的上调,可能是由于细胞壁损伤诱导的保护反应[18]。Amalaradjou等[60]研究显示,反式肉桂醛使阪崎肠杆菌毒力因子相关基因的表达下调,这些毒力基因涉及阪崎肠杆菌多个重要生理行为,包括细菌运动性、宿主组织的黏附和侵袭、巨噬细胞的存活和脂多糖的合成。
2 结 语
精油作为一种具有广谱抗菌活性的公认安全物质,在食品领域具有潜在应用价值,精油及其成分的抗菌机理仍是未来的研究重点。研究精油及其成分之间的协同作用,既可以利用其抗菌活性,又可以在保证食品安全和健康的同时,降低达到特殊抗菌效果的精油使用浓度。此外,精油作为一种混合物,其抗菌效果难以量化,对抗菌机理的深入研究还有望建立精油及其成分和抗菌能力的关系。

