血清炎症因子在子痫前期病人发病中的作用机制及与氧化应激因子的相关性
朱 宇,王素萍,史彦涛
子痫前期是临床孕产妇妊娠期特有的一种疾病,到目前为止该病依然是导致围生期胎儿及孕产妇死亡的一个重要原因,其发病机制也一直是产科学者关注的焦点。子痫前期由2个阶段构成,包括胎盘血流灌注降低及产妇子痫前期综合征,而两者之间的关系如何始终是临床产科研究的热点[1]。文献[2]报道,子痫前期产妇氧化应激反应明显,与此同时子痫前期与炎性反应间的关系也受到越来越多医生的关注。近年来提出的一元化学说、炎性学说、氧化应激学说和内皮细胞损伤学说来阐述子痫前期的发病机制,而氧化应激被认为是目前联系子痫前期胎盘血流灌注不足与子痫前期综合征的重要因素[3]。正常妊娠自身也有炎性反应,而子痫前期是孕产妇对妊娠的过度炎性反应[4]。本研究通过比较子痫前期与健康产妇超敏C反应蛋白(hs-CRP)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)与氧化低密度脂蛋白(ox-LDL)、丙二醛(malondialdehyde,MDA)及8-异构前列腺素(8-isoprostane)水平,以及子痫前期病人中上述炎性与氧化应激因子在该病中的相关性。现作报道。
1 资料与方法
1.1 一般资料 选取2017年我院收治的30例子痫前期孕产妇作为观察组,其中轻度子痫前期18例(轻度组),重度子痫前期12例(重度组)。同期分娩的30名正常孕产妇作为对照组。对照组孕产妇年龄19~37岁,孕35~40周,体质量(62.83±4.82)kg,身高(160.62±9.32)cm,体质量指数为(24.00±3.62)kg/m2。观察组孕产妇年龄20~35岁,孕36~40周,体质量(61.52±4.71)kg,身高(161.32±9.64)cm,体质量指数为(24.37±3.30)kg/m2。2组孕产妇年龄、孕周、身高及体质量指数均具有可比性。
1.2 纳入及排除标准 纳入标准:子痫前期诊断均与《妇产科学》[5]中相关诊断相符合,检查前30 d内均未有急性病史,采集样本前均未服用维生素C和维生素E等药物。排除标准:合并冠心病、高血压、糖尿病、甲状腺疾病、急慢性肾炎及肿瘤等疾病,合并先兆早产、产前出血和胎膜早破等其他妊娠并发症,有吸烟和酗酒史。
1.3 研究方法 血清样本采集及处理:产妇均于空腹状态下早晨抽取10 mL肘静脉血,样本使用无菌试管采集,以3 000 r/min的速度进行离心,离心10 min后收集血清,并放置于-80 ℃冰箱中待检。炎症因子检测方法:采用双抗体夹心酶联免疫吸附法(ELISA)检测血清hs-CRP、TNF-α、IL-6。氧化应激因子检测方法:ELISA检测血清ox-LDL水平,特异性免疫酶分析法检测血清8-isoprostane水平,硫代巴比妥酸反应物比色法测定MDA水平。上述所有检测操作均严格按照试剂盒提供的说明书执行。
1.4 统计学方法 采用t检验、方差分析、q检验和Pearson相关性分析。
2 结果
2.1 孕产妇血清炎症因子、氧化应激因子水平比较 重度组产妇血清hs-CRP、TNF-α、IL-6等高于轻度组,轻度组高于对照组(P<0.01)(见表1)。血清ox-LDL、MDA、8-isoprostane等氧化应激因子水平,重度组产妇高于轻度组,轻度组高于对照组(P<0.01)(见表2)。
2.2 子痫前期产妇血清氧化应激因子与炎症因子相关性分析 子痫前期产妇血清ox-LDL、MDA、8-isoprostane等氧化应激因子与hs-CRP、TNF-α、IL-6等炎症因子水平具有正相关关系(P<0.01)(见表3、图1~3)。

表1 3组血清炎症因子水平比较
q检验:与对照组比较**P<0.01;与轻度组比较△△P<0.01

表2 3组血清氧化应激因子水平比较
q检验:与对照组比较**P<0.01;与轻度组比较△△P<0.01
表3子痫前期产妇血清炎症因子与氧化应激因子相关性分析
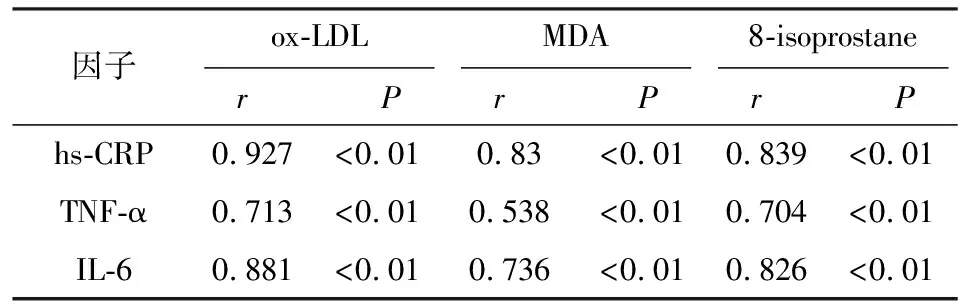
因子ox-LDL r P MDA r P 8-isoprostane r P hs-CRP0.927<0.010.83<0.010.839<0.01TNF-α0.713<0.010.538<0.010.704<0.01IL-60.881<0.010.736<0.010.826<0.01
3 讨论
子痫前期是女性妊娠期一种特发性疾病,在国内其患病率9.4%~10.4%[6]。其对妊娠女性及肚内胎儿带来严重影响,是引起新生儿早产的重要因素之一[7]。文献[8]报道,子痫前期其患病机制可能是因感染或遗传因素引起母体与胎儿免疫系统失衡,导致胎盘异常植入、滋养细胞缺血和免疫损伤,致使胎盘缺血加重,促进血浆细胞毒性因子释放,进而导致全身炎性和氧化应激反应,最后引起各种临床症状。诸多研究[9-10]证实,子痫前期有明显炎性反应,同时氧化应激反应与子痫前期间的关系也在探讨之中。
炎性反应核心在于短时间内血栓素、组胺、IL、TNF诱导黏附于白细胞的分子在内皮细胞表面表达[11]。适度炎性反应有保护机体的作用,然而过度炎性反应会给宿主生理结构和功能带来损伤,导致多器官功能异常,严重者可能致死[12]。当人体出现感染或损伤时,致炎物质会对单核细胞产生刺激,生成TNF-α与IL等前炎性因子,这类因子会诱导肝脏细胞产生如CPR等急性反应蛋白[13]。CPR具有反应快、变化快和半衰期短等特点,被认为是理想的炎性标志物[14]。IL-6是一种重要的细胞因子,与炎性反应密切相关,可通过细胞或体液免疫对宿主组织损伤和防御产生影响,同时其在肝脏细胞生成CPR过程中具有重要作用[15]。TNF-α是一种由巨噬细胞产生的多肽物质,参与机体内多个免疫和生理过程[16]。研究[17]报道,CPR、IL-6和TNF-α在女性怀孕、生产和胎儿发育中具有重要临床价值。近几年来的研究发现,子痫前期是女性对妊娠所产生的过度炎性反应,通常情况下子痫前期与正常妊娠女性体内均有不同程度的炎性反应,但子痫前期炎性反应过度激活,与正常妊娠女性相比,炎性因子水平显著升高[18]。文献[19]报道,子痫前期病人早期妊娠时血清中IL-6、INF-γ、CRP及TNF-α等炎性介质水平显著高于正常妊娠女性。本研究结果显示,观察组产妇血清hs-CRP、TNF-α、IL-6等均明显高于对照组(P<0.01),与徐宝兰等[20]研究报道相似。
氧化应激是指抗氧化防御与活性氧生成处于不平衡状态,而这类不平衡往往会在抗氧化剂活性减少或活性氧产生大于抗氧化防御时发生[21]。活性氧产生过多会引发应激反应,而氧化应激产生的毒性效应又会生成大量羟基、过氧化氢和超氧阴离子等氧化中间产物,并与DNA、蛋白质及脂质结合发生过氧化反应,最终造成组织结构和功能遭到破坏[22]。目前临床反映机体内氧化应激反应的相关指标较多,其中8-isoprostane、ox-LDL和MDA是常见的检测指标。MDA作为过氧化脂质降解产物,可间接反映机体内氧化自由基含量,然而该指标准确度不高,特异性较差,临床应用意义较小[23]。isoprostane类似于前列腺素,是一种新发现的血管活性物质,具有收缩血管的作用,研究[24]报道,isoprostane在机体氧化应激反应下会大量产生,可作为反映机体氧化应激的特异性标志物。子痫前期氧化应激反应较为明显,其中蛋白质过氧化物、脂质过氧化物及isoprostane等明显增加[25]。本研究发现,观察组产妇血清ox-LDL、MDA、8-isoprostane等氧化应激因子均明显高于对照组(P<0.01),与欧阳艳琼[26]报道相似。
氧化应激所致的血管内皮功能障碍在子痫前期发病中具有关键作用,而炎性因子和氧化应激产生是主要元凶。目前临床对于子痫前期的发病机制尚不清楚,考虑可能原因为子痫前期时产妇细胞免疫功能增强,胎盘缺氧缺血,分泌大量炎性因子,致使胎盘组织发生氧化应激反应,直接或间接引起血管内皮受损,最终导致子痫前期[27]。本研究结果显示,子痫前期产妇血清ox-LDL、MDA、8-isoprostane等氧化应激因子与hs-CRP、TNF-α、IL-6等炎症因子水平具有正性相关性(P<0.01),提示子痫前期孕产妇可能同时存在炎性反应和氧化应激反应,与李书平等[28]研究相似。
综上所述,子痫前期是因氧化应激和炎性反应共同作用于血管内皮细胞的结果,主要体现在以下2个方面:一方面炎性与氧化应激互相影响和互相作用,导致血管内皮细胞受损;另一方面,血管内皮细胞受损过程中生成的致炎和氧化应激因子又会互相诱生,并共同促进炎性和氧化应激反应发展。因此,临床可通过干预子痫前期病人机体炎症和氧化应激反应来预防疾病的发生和发展。

