白藜芦醇对急性肺损伤兔内质网应激和细胞凋亡的影响
韩欣洁,孙军平,张明月,于海容,汪建新
1解放军总医院第一医学中心 呼吸科,北京 100853;2解放军陆军第71集团军医院 呼吸科,江苏徐州 221004
急性肺损伤(acute lung injury,ALI)是由严重感染、创伤、脓毒症等多种肺内、肺外因素导致的呼吸系统危重症疾病,发病机制复杂。ALI作为急性呼吸窘迫综合征的早期阶段,若得不到及时治疗,病死率可高达50% ~ 70%[1]。内质网应激(endoplasmic reticulum stress,ERS)是因氧化应激、毒性物质等理化因素引起的内质网功能紊乱状态,表现为内质网腔内错误折叠或者未折叠蛋白聚集以及钙稳态破坏,作为细胞应激状态下生存或凋亡的必经之路,ERS既可以激活下游反应途径促进应激细胞生存,又可以引起Bcl-2、Caspase家族等介导的细胞凋亡。近年来多项研究表明,ERS与ALI等肺部疾病的发生发展密切相关[2-6]。白藜芦醇(resveratrol,Res)是一种小型非黄酮类多酚化合物,存在于虎杖、葡萄等多种植物中,药理学研究提示Res具有抗炎、抗氧化、清除氧自由基、抗肿瘤等多种生物活性,在医学界得到越来越多关注。本实验研究采用内毒素诱导急性肺损伤动物模型,观察白藜芦醇对内质网应激及相关细胞凋亡的影响,探讨其对内毒素诱导急性肺损伤的作用。
材料与方法
1 实验动物 24只雄性3月龄新西兰白兔,体质量2.3 ~ 2.6 kg,购自解放军总医院动物中心,许可证号SCXK(京)2015-0005。
2 主要试剂 脂多糖(lipopolysacchride,LPS)、白藜芦醇均购自Sigma公司;蛋白提取试剂盒、电化学发光(ECL)检测试剂盒、TUNEL检测试剂盒购自北京基谱生物科技有限公司;B淋巴细胞瘤 -2(B-cell lymphoma-2,Bcl-2)抗 体、Bax抗体、活化转录因子4(activating transcription factor 4,ATF4)抗体、转录因子C/EBP同源蛋白(C/EBP-homologous protein,CHOP)抗体、含半胱氨酸的天冬氨酸蛋白水解酶9(cysteinyl aspartate specific proteinase 9,Caspase 9)抗体均购自北京博奥森生物技术有限公司;蛋白激酶R样内质网激酶(protein kinase R-like ER kinase,PERK)抗体购自北京安诺伦生物科技有限公司。
3 实验分组 将兔适应性喂养1周后,随机数字分组法分为空白对照组、急性肺损伤模型组(ALI组)和白藜芦醇干预组(Res组),每组8只。Res组预先给予白藜芦醇250 mg/kg灌胃7 d,1次/d;对照组和ALI组予等量0.9%氯化钠注射液代替。三组实验动物经耳缘静脉给予25%乌拉坦(4 ml/kg)麻醉并固定,ALT组和Res组按兔重量750μg/kg耳缘静脉输注浓度1 g/ml的LPS溶液,建立急性肺损伤模型;对照组给予等量0.9%氯化钠注射液。实验开始4 h后,放血处死兔。
4 兔肺组织HE染色病理检查 放血处死兔后,暴露胸腔后取右肺下叶,0.9%氯化钠注射液冲洗后置于甲醛溶液中固定24 h,石蜡包埋后切片予苏木素-伊红(HE)染色后显微镜下观察。
5 兔肺组织TUNEL染色和图像分析 肺组织用4%多聚甲醛固定,组织切片经PBS洗涤后进行样本通透。加入TUNEL检测液置于37℃预孵育5 min,滴加TUNEL试剂置于湿盒内37℃孵育1 ~ 2 h,滴加FITC试剂工作液置于37℃避光孵育30 min,加入DAPI染液复染细胞核后避光室温孵育10 min。PBS避光洗涤2次,每次5 min,用抗荧光淬灭封片剂封片。镜下全景扫描,正常细胞核在紫外光激发下为蓝色,TUNEL阳性表达为绿色。采用Image-Pro Plus 6.0图像分析系统,将各组TUNEL染色切片进行图像分析,每张切片选取5个高倍视野(400倍),选取的每2个高倍视野之间至少间隔1个高倍视野,计算凋亡指数(apoptosis index,AI),AI=高倍视野内TUNEL染色阳性细胞数/细胞总数×100%,并计算平均数。
6 兔肺组织湿/干重比(wet/dry,W/D)检测 取左肺组织0.9%氯化钠注射液冲洗后滤纸吸干,称湿重;再置于70℃烤箱内烘干24 h,称干重;计算W/D。
7 Western blot检 测 肺 组 织 中 PERK、ATF4、CHOP、Caspase9、Bcl-2、Bax的蛋白表达 按照试剂盒要求提取肺组织样本中蛋白;待测蛋白行凝胶电泳(SDS-PAGE),电泳后湿转法转移至聚偏二氟乙烯(PVDF)膜上;5%脱脂牛奶封闭1h后,分别予Bcl-2(1∶500)、Bax(1∶500)、PERK抗体(1∶ 500)、ATF4(1∶ 500)、CHOP(1∶ 500)或甘油醛-3-磷酸脱氢酶(GAPDH)抗体(1∶3 000)与PVDF膜孵育,4℃过夜;以含吐温的三羟甲基氨基甲烷缓冲液(TBST)洗膜后加入羊抗兔辣根过氧化酶标记二抗,置于37℃孵育50 min;最后TBST洗膜后ECL曝光、显像,行半定量分析。
8 RT-PCR检测肺组织中PERK、ATF4、CHOP、Caspase 9、Bcl-2、Bax mRNA表达 按试剂盒要求提取肺组织样本中总RNA,1%琼脂糖凝胶进行电泳检测RNA的完整性。取总RNA用mRNA cDNA Synthesis Kit进行反转录,mRNA/lncRNA qPCR Kit进行扩增,扩增程序:95℃预变性30 s,(95℃ 5 s,60℃ 30 s)×45个循环,实验操作步骤均按产品说明书进行。以GAPDH为内参基因,采用2-△△CT法进行数据的相对定量分析。实验中应用的引物序列如下,Bcl-2上游引物:5'-GGATGCCTTCGTGG AACTGT-3',下游引物:5'-TCTTCAGAGACACCCA GGAGAA-3';Bax上游引物:5'-CGACGGCAACTTCAACTGG-3',下游引物:5'-ATGGTGAGTGAGGC GGTGA-3;CHOP上游引物:5'-GCTCG'CCAGAGTCTAGTCAG-3',下游引物:5'-CGTTCTCTTGTTCCT TCTCCTTC-3';ATF4上游引物:5'-ACGGACTGGA TGTTGGAGAAAG-3',下游引物:5'-AGGTCGTCC AAGCTCAGCA-3';Caspase9上游引物:5'-TCTATG GCACGGACGGATAC-3',下游引物:5'-CCTGGATGAAGAAGAGCTTGG-3'。
9 统计学方法 使用SPSS22.0进行研究资料分析。观测资料中的计量数据,均通过正态性检验,以-x±s描述。两组间的比较为成组t检验或校正t检验(统计量为t)。多组间的比较为单因素方差分析(统计量为F)+两两比较LSD-t检验(统计量LSD-t)。检验水准α=0.05。
结 果
1 各组兔肺组织HE染色病理形态 肺组织切片经HE染色后显微镜下观察:对照组兔肺组织结构未见明显异常,肺泡腔内未见出血、渗出、炎症细胞浸润,肺泡间隔未见增厚,肺间质血管未见明显异常;ALI组兔肺组织可见弥漫性炎症改变,肺泡间隔明显增厚,其内可见出血,肺间质毛细血管扩张、微血栓形成,微血管内可见中性粒细胞附壁,血管内皮细胞肿胀;Res组肺泡腔未见明显出血、渗出、炎症细胞浸润,肺泡间隔稍增厚,间质血管损伤程度明显轻于ALI组。结果提示,LPS诱导ALI模型成功,应用Res后可减轻ALI的肺组织损伤。见图1。
2 兔肺组织TUNEL染色和凋亡指数 对照组可见极少量TUNEL染色阳性细胞,ALI组和Res组可见大量肺泡间隔细胞TUNEL染色阳性,细胞凋亡较多;Res组肺泡间隔细胞TUNEL染色阳性数目明显少于ALI组,见图2;肺泡间隔凋亡指数,Res组(27.85%±2.89%)明显低于ALI组(42.22%±3.20%),差异有统计学意义(n=8,P<0.001)。
3 兔肺组织湿/干重比(W/D) ALI组肺W/D值(4.20±0.54)较对照组(3.06±0.47)升高(P<0.001),RSV组W/D值(3.48±0.30)较ALI组肺降低(n=8,P<0.001),差异均有统计学意义。
4 肺组织PERK、ATF4、CHOP、Caspase 9、Bcl-2、Bax的蛋白和mRNA表达 对Western blot检测的条带灰度扫描后进行对比,并计算出各组肺组织 PERK、ATF4、CHOP、Caspase 9、Bcl-2、Bax mRNA的相对定量结果,以空白组中一肺组织样本为对照样本,计算各组目的基因转录水平的差异,对比得出:ALI组PERK、ATF4、CHOP、Caspase 9、Bax蛋白水平和mRNA表达显著高于Res组(n=8,P<0.001),Res组Bcl-2蛋白水平和mRNA表达高于ALI组(n=8,P<0.001),差异均有统计学意义(图3,表1,表 2)。
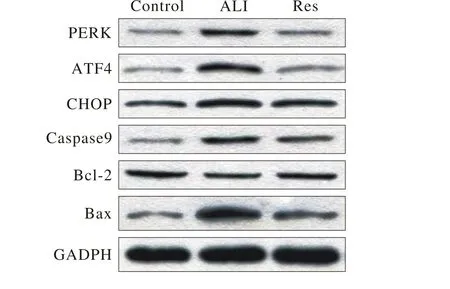
图3 各组兔肺组织PERK、 ATF4、 CHOP、 Caspase 9、 Bcl-2、 Bax蛋白表达Fig. 3 PERK, ATF4, CHOP, Caspase 9, Bcl-2, Bax protein expressions in rabbit lung tissue of each group
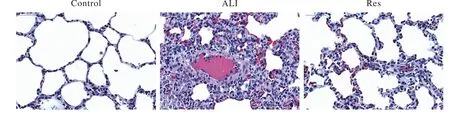
图1 光镜下兔肺组织病理学改变(HE 400×)Fig. 1 Pathological changes of rabbit lung tissue under light microscope (HE 400×)
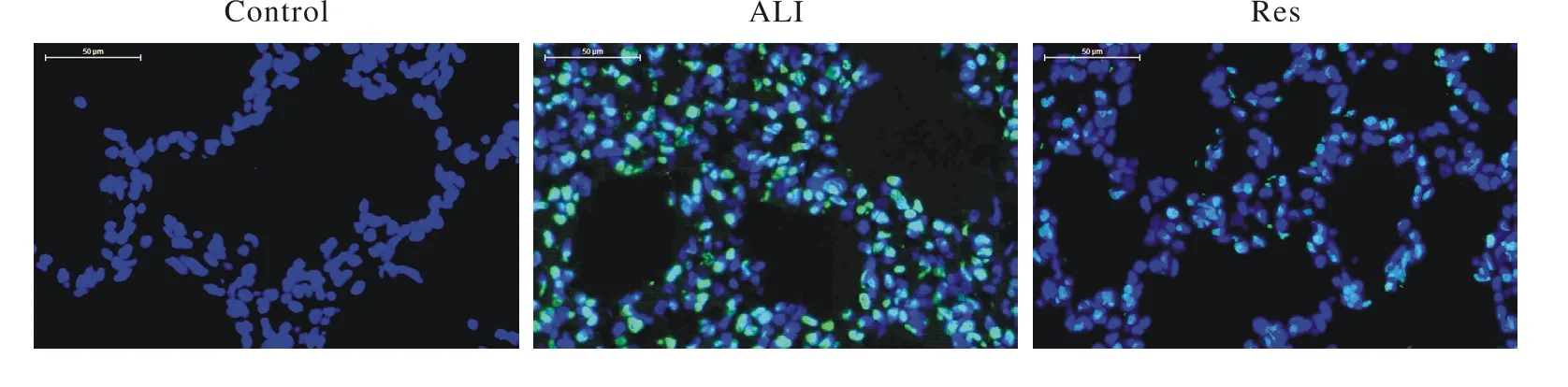
图2 兔肺组织TUNEL染色(400×)Fig. 2 TUNEL staining of rabbit lung tissue(400×)
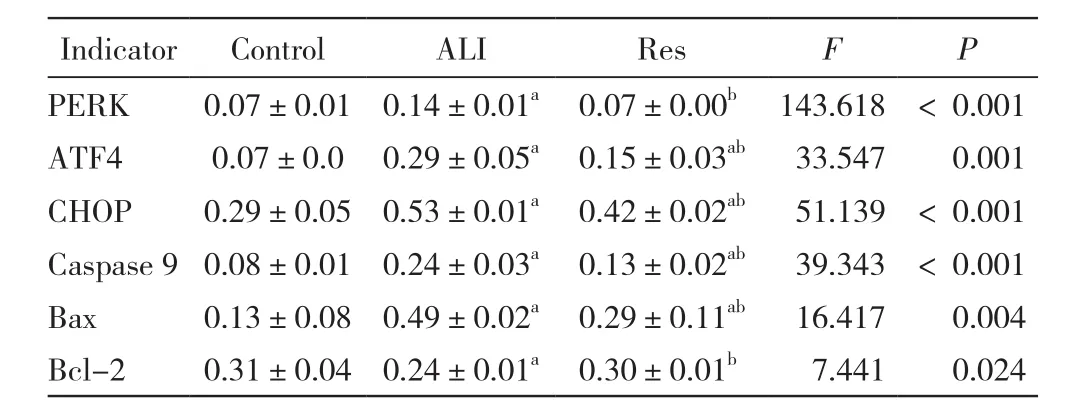
表1 各组兔肺组织PERK、ATF4、CHOP、Caspase 9、Bax、Bcl-2的蛋白表达Tab. 1 Protein expressions of PERK, ATF4, CHOP,Caspase 9, Bax and Bcl-2 in rabbit lung tissue of each group(n=8)
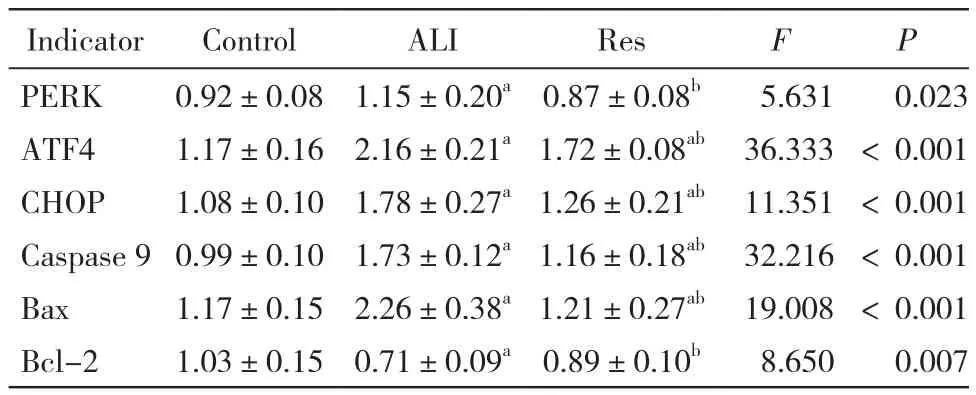
表2 各组兔肺组织PERK、ATF4、CHOP、Caspase 9、Bax、Bcl-2的mRNA表达Tab. 2 mRNA expressions of PERK, ATF4, CHOP,Caspase 9, Bax and Bcl-2 in rabbit lung tissue of each group(n=8)
讨 论
ALI是由非心源性因素如严重感染、大量输血、创伤等导致的急危重症疾病,病理表现为肺泡上皮细胞及毛细血管内皮细胞损伤,弥漫性肺间质及肺泡水肿,临床表现为急性进行性低氧性呼吸功能不全,病情发展至严重阶段(氧合指数<200)被称为急性呼吸窘迫综合征,发病机制复杂,临床病死率高。寻求新的有潜力和前景的治疗药物,减轻肺部损伤、保护残余肺功能,降低病死率,一直是临床治疗和科学研究的目标。
内质网应激是因多种理化因素如氧化应激、营养物质剥夺、毒性物质、缺氧等引起的内质网功能紊乱状态,通过激活内质网膜上感受器,引起下游自我保护反应—未折叠蛋白反应、内质网超负荷反应和固醇调节级联反应。PERK是位于内质网膜上的Ⅰ型跨膜激酶,与Bip解离后的PERK自身寡聚磷酸化激活,选择性翻译编码ATF4 mRNA,ATF4进一步诱导CHOP基因表达,抑制抗凋亡蛋白Bcl-2基因表达,引起Bcl-2/Bax比例失调,激活Caspase蛋白酶家族,最终引起应激细胞凋亡[7]。越来越多的研究表明,内质网应激及细胞凋亡参与了多种因素诱发的ALI[5,8-9]。
随着对中药及其有效成分的研究深入,越来越多的中药及其有效成分因其安全、有效、价格低廉逐渐被应用于临床。白藜芦醇,化学名是(E)-3,5,4'- 三羟基二苯乙烯 [(E)-3,5,4'-trihydorxystilbene],是植物面对感染、强光暴露等应激条件下产生的植物多酚类化合物,主要从桑葚、花生、葡萄、虎杖根茎中提取的一种天然活性物质,已被证实可以用于肥胖、激素依赖性肿瘤、心血管系统疾病的治疗[10]。多项研究提示,白藜芦醇因对ALI的保护作用具有良好的研究前景。粟青等[11]研究表明白藜芦醇可通过抑制NLPR3炎性小体活化,降低IL-1β、IL-18等活化后产物的表达,减轻LPS诱导的小鼠ALI。何梅英和陈文婷[12]实验发现,白藜芦醇通过调节脓毒症大鼠NF-κB通路抑制炎症反应,发挥对ALI的保护作用。于红和朱冬菊[13]的动物研究表明,白藜芦醇可以下调ALI小鼠肺组织GRP78、ATF6、IRE-1ɑ的表达水平,通过拮抗内质网应激反应从而减轻ALI。
本实验中,相比于对照组,ALI组肺组织病理损伤更为严重,兔肺组织可见弥漫性炎症改变,肺泡间隔明显增厚,其内可见出血、肺间质毛细血管扩张、微血栓形成,微血管内可见中性粒细胞附壁和血管内皮细胞肿胀;应用白藜芦醇后可减轻ALI的肺组织损伤,保护肺组织结构完整性。肺组织湿/干重比是反映肺水肿程度的重要指标,应用白藜芦醇干预后的肺组织湿/干重比明显低于LPS组(P<0.05),提示白藜芦醇可以减轻ALI肺水肿程度。本研究通过TUNEL染色结果发现,ALI组肺泡间隔细胞凋亡指数较Res组升高(P<0.05)。ALI组兔肺组织内质网应激标志蛋白和细胞凋亡蛋白PERK、ATF4、CHOP、Caspase 9、Bax的蛋白水平和基因表达明显增加,抗凋亡蛋白Bcl-2蛋白水平和基因表达减少;而白藜芦醇干预后下调了兔肺组织 PERK、ATF4、CHOP、Caspase 9、Bax的蛋白水平和基因表达,上调Bcl-2的蛋白水平和基因表达(P<0.05)。提示白藜芦醇有拮抗内质网应激、减轻细胞凋亡的作用,与相关国内外研究一致。然而,内质网应激涉及的上下游分子通路错综复杂,相关具体作用机制有待进一步深入研究。
综上所述,本实验通过成功复制LPS诱导ALI兔模型,证实白藜芦醇可以通过抑制内质网应激和细胞凋亡,发挥对ALI的保护作用,为白藜芦醇的临床应用提供了理论基础。随着对相关药理机制研究的深入,白藜芦醇显露出良好的临床应用前景,可为临床治疗提供更多选择。
——疾病防治的新靶标

