中国卒中营养标准化管理专家共识
中国卒中营养标准化管理专家委员会
通信作者单位
1100050 北京首都医科大学附属北京天坛医院神经病学中心(王拥军,赵性泉)
2上海市第四人民医院神经内科(王少石)
脑血管病是世界范围内致残率、致死率最高的疾病之一,也是疾病负担最重的疾病之一[1-4]。根据最新流行病学研究报道,我国脑血管病的患病率、发病率和死亡率分别为1114.8/10万、246.8/10万和114.8/10万[5]。脑血管病的发生给患者、家属、社会带来巨大的躯体、精神和经济负担[3,6]。
卒中患者常常出现吞咽障碍、意识障碍、认知障碍、情感障碍等情况,这些脑功能障碍可以引起患者进食困难、营养摄入不足和(或)营养消耗增加(如发热等),从而引发卒中后营养不良或营养风险增加。目前国际文献报道卒中后营养障碍发生率变异较大,波动在6%~62%[7]。FOOD(Feed or Ordinary Diet)研究是一项大规模、多中心、随机对照临床研究,该研究共纳入4023例卒中患者,其中314例(8%)存在营养不良[8]。各研究纳入人群、评价标准、评价时机的异质性是造成卒中后营养不良发生率变异较大的主要原因。
卒中后营养不良显著增加卒中相关肺炎、消化道出血等卒中并发症的风险,延长卒中患者住院时间,增加卒中后致残率和致死率风险。同样是FOOD研究,当校正潜在的混杂因素后,卒中后营养不良是6个月死亡(OR1.82,95%CI1.34~2.47)和不良预后(mRS>2分;OR1.52,95%CI1.05~2.21)的独立危险因素[8]。
卒中后营养管理是组织化卒中管理的一个重要组成部分[9],也是改善卒中预后的潜在干预靶点[10-11]。卒中后营养管理是个系统的工程,需要整合不同的医疗资源、建立科学的评价模式和高效的临床路径,以及有效的质量监测和持续改进体系。
目前国际上尚缺乏针对卒中后营养标准化管理的相关指南或专家共识。在这样的背景下,中国卒中学会组织相关领域的专家,针对卒中后营养的标准化管理,系统评价国际相关研究成果,撰写了《中国卒中营养标准化管理专家共识》(简称专家共识),以期为提高卒中后营养管理的水平、效果和效率提供循证医学依据。
1 专家共识编写方法
本专家共识检索如下数据库Medline/PubMed、Cochrane Database、National Institute for Health and Cl i n ical Excellence(www.nice.org.uk)、万方、维普和北大医学图书馆等全文及摘要数据库。
本专家共识主要检索以下发表类型的文献:随机对照研究、队列研究、病例对照研究、横断面研究、系统综述、Meta分析和临床指南等。
本专家共识的主要检索策略为:stroke AND nutrition;stroke AND malnutrition;stroke AND undernutrition;acute ischemic stroke AND nutrition;intracerebral bleeding AND nutrition;subarachnoid hemorrhage AND nutrition;stroke AND dysphagia;stroke AND nutritional supplements;stroke AND oral supplement;stroke AND tube feeding;stroke AND enteral nutrition;stroke and parenteral nutrition;stroke AND infections;nutrition AND stroke rehabilitation;nutrition AND infections;nutrition AND pressure sores;nutrition AND quality of life;nutrition AN D ma n agement;nutr it ion AN D quantity of care等。
基于上述检索结果,本专家共识撰写参照卒中学会指南制定标准和撰写规范,编写了卒中营养标准化管理的相关共识。本专家共识的产生经过初稿讨论、中期讨论和最终定稿三个阶段。每个阶段专家对推荐意见进行逐一讨论,最终每一条推荐的专家意见一致性大于95%才能通过。
2 相关概念与定义
·营养不良:由于摄入不足或利用障碍引起能量或营养素缺乏的状态,进而导致人体组成改变,生理和精神功能下降,有可能导致不良临床结局[12]。
·营养过剩:营养素(特别是能量)超过正常生长发育及代谢需求的一种营养异常状态,包括超重、肥胖等。
·营养风险:现存或潜在的与营养因素相关的导致患者出现不良临床结局(如感染等并发症、住院时间和住院费用增加等)的风险。存在营养风险的患者最需要相关营养支持治疗,同时也是通过营养支持治疗最能改善临床结局的人群[13-15]。
·营养风险筛查:临床医护人员用经过验证的营养风险筛查工具,来判断患者是否需要营养支持治疗的快速、简便的方法和流程。
·营养评定:由临床营养专业人员通过膳食调查、人体组成测定、人体测量、生化检验、临床检查等方法,对患者的营养代谢、机体功能等进行全面检查和评估,以确定营养不良的类型、程度、影响等,结合适应证和可能的不良反应,制订针对性营养治疗计划,并监测营养支持治疗的疗效的过程。
·营养支持治疗:经肠内或肠外途径为不能正常进食的患者提供适宜营养素的方法。目前临床上营养支持治疗主要包括经口营养、肠内营养和肠外营养。
·肠内营养:经胃肠道提供代谢需要的营养物质及其他各种营养素的营养支持治疗方式。根据给予途径的不同,分为经口肠内营养和管饲肠内营养。
·肠外营养:为无法经胃肠道摄取或摄取营养物不足的患者,经静脉提供包括氨基酸、脂肪、碳水化合物、维生素及矿物质在内的营养素的营养支持治疗方式。
3 卒中后营养不良标准化管理
3.1 卒中营养支持治疗团队
营养支持专业人员(nutrition support professionals,NSP)指主要提供肠内营养和肠外营养支持治疗和管理的专业人员,可以是医师、营养师、药师或护师。NSP的工作模式可以是相互独立或形成一支多学科团队相互合作的营养支持治疗团队。在具体临床实践中,营养支持治疗团队对患者进行营养风险筛查、营养评定,根据相关营养指南和标准,结合临床具体情况制订营养支持治疗计划,实施规范的营养支持疗法,并以标准化流程指导营养支持治疗的各个环节,优化营养支持治疗综合管理,已成为临床营养支持治疗的新模式[16-17]。
3.2 卒中后营养风险筛查
目前,临床上有多个营养风险筛查的工具,如营养风险筛查2002(nutritional risk screening 2002,NRS2002)、营养不良通用筛查工具(malnutrition universal screening tool,MUS T)、简易营养评估工具(m i n i nutritional assessment,MNA)、主观全面评价工具(subjective global assessment,SGA)和NUTRIC(nutrition risk in the critically ill)评分,这些工具的建立各有优缺点[11,18-19]。目前,国际上尚缺乏一个专门针对卒中患者营养风险筛查的工具。
NRS2002是2002年欧洲肠内肠外营养学会(European Society of Parenteral and Enteral Nutrition,ESPEN)专家组在128项随机对照临床研究的基础上,建立的一个有客观依据的营养风险筛查工具[20]。该工具是迄今为止唯一以128项随机对照研究作为循证基础的营养筛查工具,信度和效度在欧洲已得到验证[18,20]。
NRS2002内容包括3个方面:①营养状况受损评分(0~3分);②疾病的严重程度评分(0~3分);③年龄评分;在以上评分基础上年龄≥70岁者加1分;总分为0~7分。根据对128项关于营养支持治疗与临床结局的随机对照试验的分析发现,在NRS2002≥3分的情况下,大部分研究显示营养支持治疗有效(能够改善临床结局);而在NRS2002<3分的情况下,大部分研究显示营养支持治疗无效。因此,将是否具有营养风险的评分临界点定为3分,即NRS2000≥3分为具有营养风险,需要根据患者的临床情况,制订基于个体化的营养计划,给予营养干预;而NRS2000<3分者虽然没有营养风险,但应在其住院期间每周重复筛查1次[11]。从2005年开始,中华医学会肠外肠内营养学分会全国协作组开展了营养风险筛查的具体工作,除BMI采用国内标准(即18.5 kg/m2)外,其余均与欧洲的方法保持一致。
3.3 卒中后营养状态评定
如果患者存在营养风险,需要请营养师等营养支持治疗专业人员进行更准确的营养评估。营养评估是通过膳食调查、人体组成测定、人体测量、生化检验、临床检查等方法,对患者的营养代谢、机体功能等进行全面检查和评估,以确定营养不良的类型、程度、影响因素等,结合适应证和可能的不良反应,制订针对性的营养治疗计划,并监测营养支持治疗的疗效的过程。
传统营养状态的评估方法包括:①膳食调查:如称重法、回顾法、食物频率法和记账法;②人体测量学指标:BMI、腰围、三头肌皮褶厚度、上臂肌围;③生化实验室指标:血常规、总蛋白、白蛋白、前白蛋白、转铁蛋白、视黄醇结合蛋白、血浆氨基酸谱、血脂、糖化血红蛋白、C反应蛋白、免疫功能、维生素、微量元素等的检查;④辅助参考指标:人体成分分析仪。以上指标低于正常参考范围,通常认为存在营养不良。
3.4 卒中后营养支持治疗方案制订
3.4.1 热量需求的估计
目前,国际上有三种估算热量需求的方法:间接测热法[21-22],基于体重的计算公式[23-24]和文献发表的预测公式[21,25]。其中,间接测热法最准确,但需要特殊设备和专人管理,临床普及受限。目前,临床上基于体重的计算公式最为常用:
·轻症(GCS>12分或APACHEⅡ≤16分)非卧床患者能量供给25~35 kcal/(kg·d),糖脂比=7∶3~6∶4,热氮比=100∶1~150∶1;
·轻症卧床患者能量供给20~25 kcal/(kg·d),糖脂比=7∶3~6∶4,热氮比=100∶1~150∶1;
·重症急性应激期患者能量供给20~25 kcal/(kg·d),糖脂比=5∶5,热氮比=100∶1。
3.4.2 蛋白质需求的估计
目前研究证据显示,蛋白质是比脂肪和碳水化合物更为重要的大分子营养物质[26-27]。制订营养支持治疗方案时,蛋白质需求需要独立于热量单独估计。以往研究显示,1.2~1.5 g/(kg·d)蛋白含量可以满足机体代谢需求[26],但最近的研究显示蛋白质需要1.5~2.0 g/(kg·d)[28]。患者每日的蛋白质的需求也可以通过24 h尿液尿素氮(urine urea nitrogen,UUN)的测定进行估计:每日蛋白的需求量(g/d)=[(UUN+4)×6.25][11]。
3.4.3 营养支持治疗途径的选择
肠内营养具有刺激胃肠道蠕动、刺激胃肠激素分泌、改善肠道血液灌注、预防急性胃粘膜病变、保护胃肠黏膜屏障、减少致病菌定植和细菌移位等优势[11]。目前,在针对多种疾病(外伤、脑外伤、烧伤、胰腺炎、外科术后等)的多项Meta分析研究均显示,肠内营养较肠外营养可以降低感染风险、降低总并发症和降低住院时间[29-32]。同时,肠外营养的获益风险比较肠内营养小。因此,对于无肠内营养禁忌,能够耐受肠内营养的患者应首先考虑肠内营养。而对于不能实施肠内营养或肠内营养不能满足热量和蛋白需求的高危营养风险的患者可考虑肠外营养[11]。
临床上最为常用的肠内营养方式为胃内喂养和空肠内喂养。经鼻胃管肠内营养更符合胃肠道生理特性、对操作者经验要求不高,进而避免肠内营养支持治疗的延迟[33]。然而,肠内营养制剂输注的位置降低时(如从胃部降低到小肠近段时),可以明显减少反流和误吸的风险[34]。一项综合12项随机对照研究的Meta分析结果显示,与鼻胃管相比,鼻肠管肠内营养可以明显降低呼吸机相关肺炎发生风险[34]。但鼻肠管的放置对操作者要求较高,因此,可能延迟胃肠营养支持治疗的实施[35]。
长期放置鼻胃管可能发生鼻孔溃疡、食管溃疡、食管狭窄、吸入性肺炎等并发症[36]。因此,对于放置鼻胃管大于4周的患者,可考虑胃造瘘[11,37]。FOOD研究(第三部分)将321例急性卒中伴吞咽障碍患者随机分为经胃造瘘胃肠营养组和经鼻胃管胃肠营养组。主要结局为患者入组后6个月死亡或不良预后(mRS 4~5分)。意向性分析结果显示,与经鼻胃管胃肠营养组相比,经胃造瘘胃肠营养组增加了患者死亡率1.0%(95%CI-10.0~11.9,P=0.9)和死亡或不良预后联合终点7.8%(95%CI0.0~15.5,P=0.05)[38]。因此,卒中伴有吞咽障碍的患者在急性期不建议使用经胃造瘘胃肠营养。
3.4.4 肠内营养制剂的选择
目前国际上关于特定营养配方选择的相关数据相对较少[11]。临床上主要根据患者胃肠功能、合并症、并发症等因素综合考虑,选择不同特点的肠内营养制剂。对于胃肠道功能正常患者,首选整蛋白标准配方。有条件时选用含有膳食纤维的整蛋白标准配方;对于消化或吸收功能障碍患者,可选用短肽型或氨基酸型等预消化配方;对于腹泻或便秘患者,可选择富含膳食纤维配方;对于糖尿病或血糖增高患者,可选用低糖配方;高脂血症或血脂增高患者,可选用高蛋白低脂配方;对于限制液体入量患者,可选用高能量密度配方[21]。
3.4.5 肠内营养开始的时间
FOOD研究(第二部分)将859例急性卒中伴吞咽障碍患者,随机分为早期(入院7 d内)肠内管饲营养组(早期仅给予必要的肠外碳水化合物补充)和延迟(入院7 d后)肠内管饲营养组。主要结局为患者入组后6个月死亡或不良预后(mRS 4~5分)。意向性分析结果显示,6个月后早期肠内营养患者比延迟肠内喂养患者绝对死亡风险减少5.8%(95%CI-0.8~12.5,P=0.09),死亡和不良预后减少1.2%(95%CI-4.2~6.6,P=0.7)[38]。由此提示,卒中伴吞咽障碍患者早期肠内喂养可减少病死率。最近一项Meta分析显示,与延迟的肠内营养相比,入院24~48 h(平均36 h)给予肠内营养可以明显降低感染和死亡的风险[39]。
3.5 卒中后营养支持治疗方案实施
对于接受肠内营养支持治疗的患者,建议床头持续抬高≥30°。输注容量从少到多,即首日500 mL,逐渐(2~5 d内)达到全量;输注速度从慢到快,即首日肠内营养输注20~50 mL/h,次日起逐渐加至80~100 mL/h,约12~24 h内输注完毕。建议使用营养输注泵控制输注速度。输注管道要每4 h用20~30 mL温水冲洗管道1次,每次中断输注或给药前后用20~30 mL温水冲洗管道。
3.6 卒中后营养支持治疗动态监测
临床医师对于接受肠内营养支持治疗的患者,每天都要通过体格检查监测肠鸣音、排气排便情况、腹部形态和液体容量等情况。肠内营养时,应密切监测恶心、呕吐、腹泻、腹胀、呕血、黑便等消化道症状,以及误吸的症状体征。护师应定时检测管饲深度和胃残余液量、颜色和性状等[11]。
应确立患者热量和蛋白需求的目标,动态监测目标达标情况。同时,临床医师应关注患者累积能量缺乏(cumulative caloric deficit)情况,并进行相关的记录。有研究显示累积能量缺乏与不良临床结局事件明显相关[40-41]。
再进食综合征(refeeding syndrome)是一种对于长期饥饿、严重营养不良或营养应激患者实施营养支持治疗时出现的一种体液和电解质代谢紊乱的临床综合征[42]。对于BMI<20 kg/m2、入院前大量体重减轻、长时间禁食的患者,营养支持治疗开始后,应密切监测电解质异常(如低钾血症、低磷血症、低镁血症等)和体液容量[43]。
腹泻是胃肠营养支持治疗常见的并发症。腹泻可以引起电解质紊乱、脱水、皮肤溃疡、伤口感染。虽然营养支持治疗相关腹泻是多因素作用的结果,如营养制剂配方、输注模式、营养液污染等,但有研究显示营养制剂中含有山梨醇成分占了绝大部分(占55%)[44];另外,难辨梭状芽孢杆菌的感染也是重要的原因之一(占17%~22%)[45]。
血糖增高的患者应根据血糖的变化,调整营养制剂的输注速度和胰岛素输注剂量。胰岛素输注时,应密切监测血糖。血脂异常的患者应每周检测血脂。患者应每天监测液体出入量。电解质和生化指标根据实际情况调整监测频率。
对住院患者应定期进行人体测量(如BMI、三头肌皮褶厚度、上臂肌围等)、人体成分分析(如血清白蛋白、前白蛋白、转铁蛋白、淋巴细胞计数等)、能量代谢测定、生化指标检查和营养风险筛查等,根据结果调整摄入能量及特定营养素的供给。
3.7 卒中后营养标准化管理流程
卒中后营养标准化管理的原则是:在循证医学指南和标准的指导下,采用符合临床逻辑和习惯的路径,尽早确定有营养不良或营养风险的患者,制订个体化营养支持治疗方案,并密切监测营养支持治疗的并发症、效果,及时反馈动态调整营养支持治疗方案。在这样的原则指导下,本专家共识推荐“营养风险筛查(Screening)-营养状态评估(Assessment)-营养支持治疗方案制订(Plan)-营养支持治疗方案实施(Intervention)-监测和随访(Monitoring)”的卒中后营养标准化管理模式(SAPIM模式)(图1)。图2以NRS2002营养风险筛查量表为例,图示SAPIM模式下卒中后营养管理的标准临床路径:
第一步:营养风险筛查——NRS2002营养风险筛查量表,评价患者营养状态和营养不良风险;
第二步:营养状态评估——对于营养不良或营养风险的卒中患者(NRS2002≥3分),进行进一步营养评价,重点包括患者目前营养的摄入情况,以及阻碍有效营养摄入的相关因素(如吞咽障碍、意识障碍、认知障碍、情感障碍、应激性溃疡等)。
第三步:营养支持治疗方案制订——根据营养风险评价和营养状态评估的结果,制订卒中后营养支持治疗干预策略(主要包括热量需求、蛋白质需求、营养支持治疗途径、营养制剂选择、营养支持治疗启动时间等)。
第四步:营养支持治疗方案实施——对于确定营养支持治疗的患者,根据预定营养支持治疗方案,实施营养支持治疗。营养风险高危患者或营养摄入不足的患者,首先可考虑经口营养支持治疗。如经口营养支持治疗不适合、失败或不能实现的患者,可咨询营养支持治疗团队医师或遵循相关临床指南,考虑肠内管饲营养或肠外营养。

图1 卒中营养标准化管理SAPIM模式
第五步:营养支持治疗监测和随访——动态监测营养支持治疗的并发症和达标效果等,反馈指导营养支持治疗方案的调整。
4 卒中后营养未来的研究方向
卒中后营养管理的相关研究尚处在初级阶段,有许多自然科学和社会科学问题尚未被回答。本专家共识建议我国未来卒中营养相关研究重点聚焦如下几个方面:
(1)开展队列研究明确国人卒中后营养不良或营养风险的发生情况、危险因素和对卒中结局的影响;
(2)开展大规模、多中心、随机对照研究,探索早期基于卒中后营养风险分层的营养支持治疗对于卒中结局的影响;
(3)开展卒中后营养不良质量监测与改进研究,制订卒中营养不良标准化管理路径、关键绩效指标,以及探索监测和持续改进的管理模式。
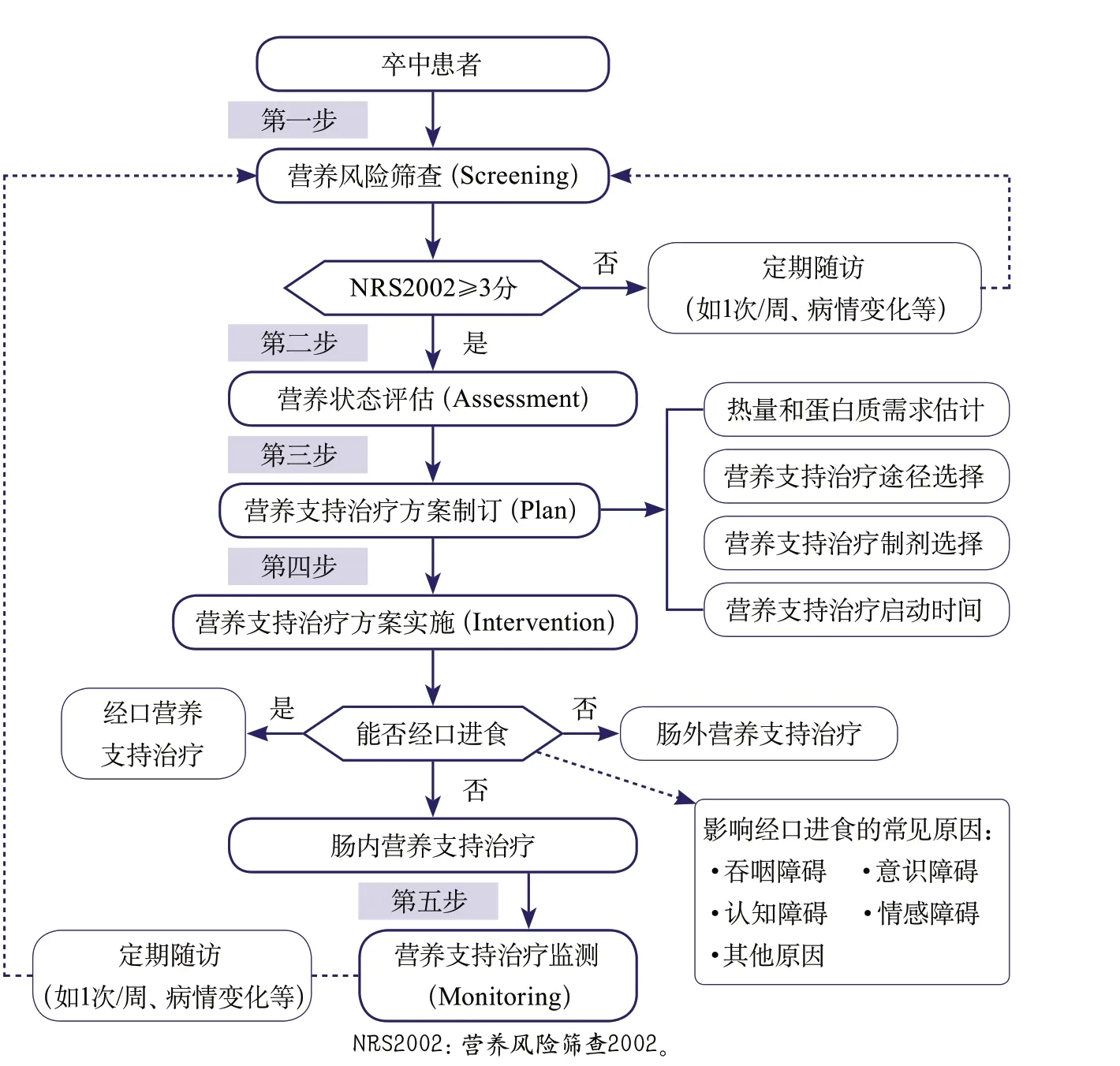
图2 SAPIM模式下卒中营养管理标准临床路径(五步法)
5 中国卒中后营养标准化管理专家共识汇总
问题一:哪些卒中患者需要特定的营养支持治疗?
1 所有的卒中患者均应在住院后24 h内接受营养状态和营养风险评价。
2 所有的卒中患者均应在住院后24 h内接受吞咽障碍的筛查(饮水试验)。
3 对于卒中后营养状态正常或低营养风险的患者,不需要特殊营养支持治疗。
4 对于卒中后存在高营养风险或不能通过自主经口进食获得足够营养的卒中患者,需要考虑营养支持治疗。
5 当卒中患者需要营养支持治疗时,建议咨询营养师或营养支持治疗团队协助制订营养支持治疗方案和监测营养支持治疗疗效。
问题二:如何评价卒中患者营养风险和营养状态?
6 在实施营养支持治疗前,卒中患者均要通过经验证的营养风险筛查量表(如NRS2002、NUTRIC评分等)筛查营养风险。
7 在实施营养支持治疗前,应对影响营养支持治疗方案制订和实施的相关因素进行进一步的营养评估。
问题三:如何制订卒中后营养支持治疗的方案?
8 制订卒中营养支持治疗方案时,需要对热量需求进行估计,从而确定营养支持治疗的目标。
9 制订卒中营养支持治疗时,需要对患者蛋白质的需求进行估计,并要在营养支持治疗的过程中需要动态监测。
10 选择营养支持治疗途径时,应首先考虑肠内营养。当卒中患者肠内营养存在禁忌证、不可实施或不能满足热量和蛋白质需求时,可考虑肠外营养。
问题四:卒中后如何实施经口营养支持治疗?
11 急性卒中患者应在发病7 d内开始胃肠道内进食。
问题五:如何实施肠内营养?
12 卒中患者需要管饲肠内营养支持治疗时,应首先选择鼻胃管或口胃管进行肠内营养支持治疗。
13 卒中患者需要管饲肠内营养支持治疗时,应用鼻胃管大于4周时,可考虑经皮胃造瘘肠内营养。
14 当患者存在胃食管反流病史、胃食管反流的症状和体征或误吸风险时,建议采用持续滴注喂养方式。
15 当对卒中患者使用十二指肠管或空肠管管饲喂养时,建议采用持续滴注喂养方式。
16 对于需要营养支持治疗的卒中患者,肠内营养支持治疗应在住院后24~48 h内开始启动。
17 对于需要营养支持治疗的卒中患者,虽然肠内营养支持治疗应在住院24~48 h内开始启动,但达到营养支持治疗目标的时间尚不确切。建议根据患者耐受情况,于接受肠内营养支持治疗后数天内逐渐达标。
18 对于接受营养支持治疗的卒中患者,临床医师应每天通过体格检查监测患者接受肠内营养支持治疗的反应。
19 对于接受营养支持治疗的卒中患者,营养支持治疗团队需要监测患者热量需求达标情况、累积热量缺失情况,以及不恰当肠内营养终止等情况。
20 对于接受营养支持治疗的卒中患者,临床医师需要评价患者的误吸风险。
21 对于接受营养支持治疗并发生腹泻的卒中患者,临床医师需要对腹泻的原因进行评价,并制订相应的干预措施。
问题六:如何实施肠外营养?
22 当卒中患者肠内营养存在禁忌证、不可实施或不能满足热量和蛋白质需求时,应尽快实施肠外营养。
23 当患者存在静脉炎风险、损失静脉通道、营养供给不足等情况,应避免使用经周围静脉肠外营养。
24 联合应用肠内营养和肠外营养进行营养支持治疗时,当经肠内营养能够达到热量和蛋白需求的60%时,可以逐渐停用肠外营养。
问题七:卒中后营养支持治疗的标准化管理
25 卒中后营养风险筛查和营养评价,应作为卒中医疗质量监测和持续改进的一个组成部分。
26 卒中后营养风险筛查,应作为卒中医疗质量监测和持续改进的一个关键绩效指标。
27 卒中后营养标准化管理,推荐“营养风险筛查(Screening)-营养状态评估(Assessment)-营养支持治疗方案制订(Plan)-营养支持治疗方案实施(Intervention)-监测和随访(Monitoring)”的SAPIM模式。
执笔:冀瑞俊,王春雪
编写委员会名单(按姓氏拼音排序):
安中平 天津环湖医院
陈伟 北京协和医院
胡波 华中科技大学同济医学院附属协和医院
何志义 中国医科大学附属第一医院
冀瑞俊 首都医科大学附属北京天坛医院
柯开富 南通大学附属医院
罗本燕 浙江大学附属第一医院
杨弋 吉林大学白求恩第一医院
王春雪 首都医科大学附属北京天坛医院
王柠 福建医科大学第一附属医院
王青 南方医科大学珠江医院
王少石 上海市第四人民医院
王拥军 首都医科大学附属北京天坛医院
赵性泉 首都医科大学附属北京天坛医院
赵玉武 上海市第六人民医院
张玉梅 首都医科大学附属北京天坛医院
周官恩 天津环湖医院

