合肥地区2型糖尿病患者尿微量白蛋白肌酐比值与DR的关系
魏 科,李永蓉,王志敏
0引言
糖尿病视网膜病变(diabetic retinopathy,DR)是严重威胁视功能的眼底病变,随着人均寿命的延长及人民生活水平的不断改善,我国糖尿病患病率由1980年的0.67%飙升至2013年的10.4%[1],已成为全球糖尿病患者人口最多的国家[2]。DR是糖尿病常见并发症之一[3],我国DR患者占糖尿病患者的21.87%[4],DR成为目前工作年龄人群第一位致盲性眼病。DR的早期干预对疾病的转归影响颇大。目前DR的诊断主要依赖于眼底摄片及眼底造影等影像学方法[5],基层普查存在难度,寻找一些较为简便经济的筛查指标具有一定临床价值。
表1 两组患者基本资料的比较

基本资料NDR组(n=169)DR组(n=112)t/χ2/UP男/女(例)105/6463/490.9690.325年龄[M(P25,P75),岁]54(25,62)57(50,66)7258.5000.001高血压(例)68531.3790.240糖尿病病程[M(P25,P75),a]5.00 (1.00,10.00)10.00(4.25,13.00)6321.500<0.001BMI( x±s,kg/m2)25.22±3.9724.95±3.480.5740.566FBG[M(P25,P75),mmol/L]8.71(6.54,10.95)7.98(6.65,10.30)8755.0000.288HbA1c[M(P25,P75),%]8.90(7.40,10.70)8.65(7.43,10.98)9404.0000.928TB[M(P25,P75),mmol/L]16.30(11.55,20.95)14.00(11.20,20.18)8701.5000.253TC[M(P25,P75),mmol/L]4.26(3.55,4.96)4.10(3.41,4.95)9155.5000.644TG[M(P25,P75),mmol/L]1.57(1.11,2.47)1.56(1.04,2.25)9219.9000.713BUN[M(P25,P75),mmol/L]5.02(4.24,5.97)5.36(4.43,6.55)8315.0000.085UACR[M(P25,P75),mg/g·Cr]4.10(2.40,10.65)14.20(4.70,70.23)5352.500<0.001
1对象和方法
1.2方法采集患者性别、年龄、糖尿病病程、高血压史、体质量指数(body mass index,BMI)、尿微量白蛋白肌酐比值(urine microalbumin creatinine ratio,UACR)、空腹血糖(FBG)、糖化血红蛋白(HbA1c)、总胆红素(TB)、总胆固醇(TC)、甘油三酯(TG)、血尿素(BUN)等资料。血液标本采集时间为晨起空腹,尿液标本采集时间为首次晨尿,所有标本均送检检验中心并出具检测结果。眼底摄片采用OPTOMED Smartscope PRO眼底照相机,拍摄以黄斑中心凹为中心的45°后极部彩色眼底像,根据ETDRS诊断标准[6]对DR进行诊断,由2名眼科主治医师分别进行阅片和诊断,对于诊断存疑者交由第3名眼科副主任医师进行判读。DR患者定义为至少1眼发生DR,非DR(NDR)患者定义为双眼均未发生DR。
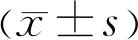
表2 Logistic回归分析结果
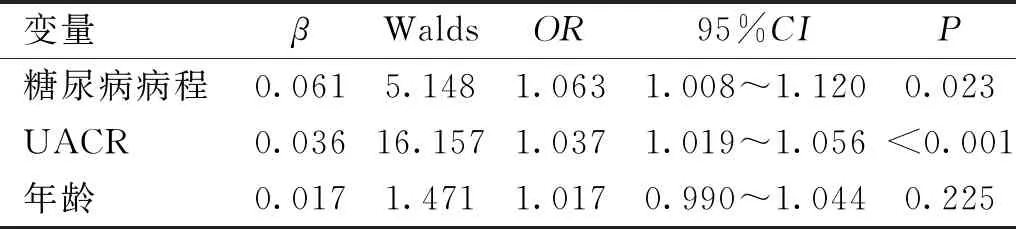
变量βWaldsOR95%CIP糖尿病病程0.0615.1481.0631.008~1.1200.023UACR0.03616.1571.0371.019~1.056<0.001年龄0.0171.4711.0170.990~1.0440.225
表3 DR危险因素ROC曲线特征参数
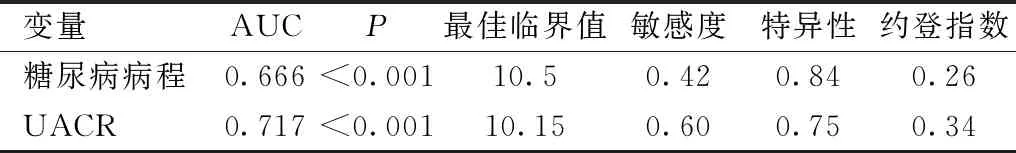
变量AUCP最佳临界值敏感度特异性约登指数糖尿病病程0.666<0.00110.50.420.840.26UACR0.717<0.00110.150.600.750.34
2结果
2.1基本资料根据眼底检查结果,本研究纳入的281例患者中,检出DR患者112例(39.9%,DR组),NDR患者169例(60.1%,NDR组),两组患者年龄、糖尿病病程、UACR比较,差异均有统计学意义(P<0.05),其余各指标差异均无统计学意义(P>0.05),见表1。
2.2二元Logistic回归分析DR发生的危险因素将糖尿病病程、年龄、UACR作为自变量纳入二元Logistic回归分析,结果显示糖尿病病程及UACR为DR发生的危险因素,见表2。Hosmer-Lemeshow拟合优度检验结果满意(χ2=5.981,df=8,P=0.649)。
2.3危险因素ROC曲线分析绘制危险因素ROC曲线,见图1。计算曲线特征参数,见表3。DR危险因素的最佳临界值为糖尿病病程10.5a,UACR为10.15mg/g·Cr。
3讨论
糖尿病患者持续的高血糖状态通过激活多元醇通路、氨基己糖通路等代谢途径,介导氧化应激,对包括视网膜在内富含外周血管的组织造成损伤[7-8],同时糖化后的血红蛋白携氧能力下降,导致末梢组织缺氧,也可引起外周组织受损[9]。肾小球富含毛细血管,可作为观测外周毛细血管系统损害程度的窗口之一,临床上常选取微量蛋白尿为内皮系统损伤标志物[10-11],UACR是尿微量白蛋白与尿肌酐的比值,选取UACR评估肾功能可避免单一指标观测的片面性。研究证实,UACR与24h尿微量白蛋白间具有很好的相关性[12-13],且因其便于取材,UACR已广泛用于糖尿病患者肾功能的评估及心血管类疾病风险预测[14-17]。视网膜同为富含外周微血管系统的组织,有学者报道,糖尿病患者中,肾脏病变与DR高度相关[3,18-21]。Boelter等[22]对巴西地区1 214名2型糖尿病患者研究发现,微量白蛋白尿是2型糖尿病患者DR发生的危险因素。王养忠等[23]对295例2型糖尿病患者研究发现,DR患者与NDR患者间UACR存在显著差异。李梅芳等[24]对上海地区595例2型糖尿病患者的横断面研究结果表明,即使修正糖尿病病程等因素后,UACR与DR发生仍显著相关。本研究结果显示,UACR是DR发生的危险因素,与国内外类似研究结果一致,根据ROC曲线,本研究将UACR临界点定义在10.15mg/g·Cr,当糖尿病患者UACR维持在较高状态时,应关注视网膜微循环系统,警惕DR发生。
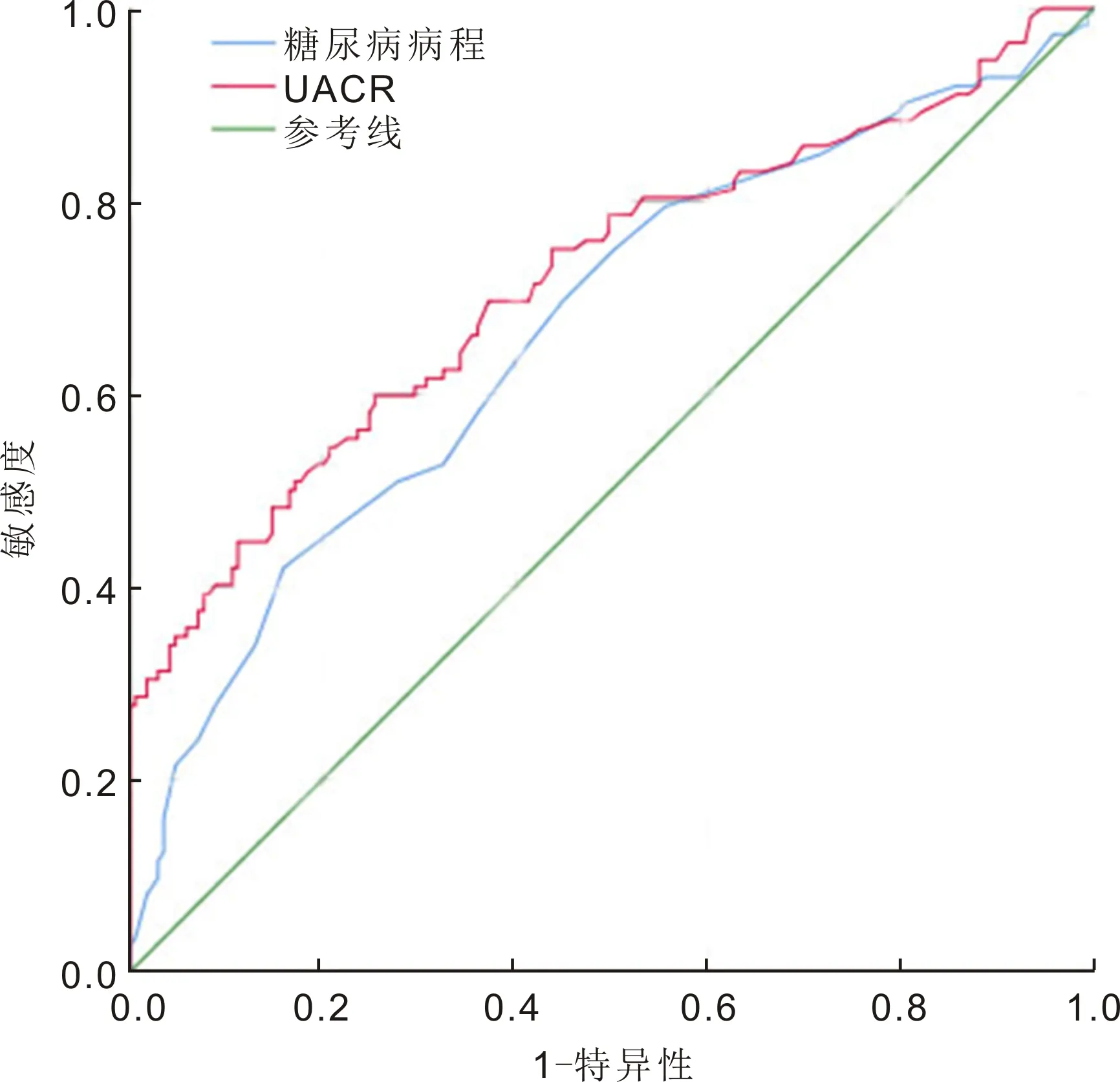
图1危险因素ROC曲线。
糖尿病病程是目前较为公认的DR发生的独立危险因素[25],高血糖状态对于靶器官的损害是一个不断累积的过程,糖尿病病程越长,意味着风险暴露时间越长,DR发生率越高。段春文等[26]通过回顾性分析2型糖尿病患者753例,将糖尿病病程≥4.5a作为DR的独立危险因素。本研究亦发现糖尿病病程为DR风险相关因素,糖尿病病程≥10.5a为DR发生的高危因素,样本量及患者不同的文化程度、生活习惯和医疗依从性等可能引起细节差异,尚需进一步研究。
本研究未发现HbA1c、高血压史等与DR发生存在显著相关,与国内外部分相似研究存在一定差异,分析原因可能包括:(1)本研究样本量偏小,结果可能存在一定程度的偏差;(2)DR病因复杂,部分指标与DR的相关性可能需要进一步研究,如HbA1c为最近8~12wk平均血糖水平的评估指标[27],有国内外学者报道HbA1c只能部分解释糖尿病并发症的发病风险,单纯控制HbA1c不能有效降低糖尿病血管并发症发生风险[28-29];糖尿病心血管并发症防控研究(ACCORD)发现控制收缩压在DR防控方面并无显著作用[30],英国前瞻性糖尿病研究 (UKPDS)指出严格控制血压并不能完全阻止DR[31]。
本研究结果提示UACR及糖尿病病程为DR风险相关因素,对于DR患者的筛查及病情监控具有一定参考价值。但本研究仍存在不足之处:(1)本研究为回顾性研究,样本量较小且有地域限制,若能设计多中心及前瞻性研究,所得结果将更加可靠;(2)本研究中自变量类别较少,尚可能存在其它与DR显著相关的风险因素未被发现;(3)受设备条件及实际操作等因素影响,本研究主要依赖医师通过眼底摄片判断DR,对于部分只存在少量微血管瘤的轻度DR患者可能漏诊,今后需进一步完善。
3刘家燕, 樊映川. 糖尿病视网膜病变的流行病学研究现状. 实用医院临床杂志 2015; 2: 137-138, 139

