rhPGRN通过MAPK/PI3K通路调控自噬和内质网应激并促进细胞增殖*
罗 瑞,秦启忠,刘 敏,尹丹旸,郭风劲
(重庆医科大学基础医学院细胞生物学与遗传学教研室,发育生物学与模式动物平台,重庆400016)
生长因子颗粒体蛋白前体(progranulin,PGRN)由GRN基因编码,是含有593个氨基酸的分泌性糖蛋白,分泌到细胞外后以完整形态或者水解后的组成肽形式发挥功能[1-2]。研究证实PGRN与发育、组织修复再生、肿瘤发生、神经营养和炎症密切相关,并且能调控多种溶酶体酶活性[3-4]。PGRN在神经元和免疫细胞中大量表达,并且在乳腺癌、肾透明细胞癌、骨肉瘤、阿尔茨海默病和其它神经退行性疾病中表达显著增高[1-2,5]。GRN基因的突变涉及了很多常见的疾病包括额颞叶痴呆和神经元蜡样脂褐质沉着症,目前PGRN作为一种生长因子被证实对神经系统疾病和溶酶体贮积病具有治疗作用[3]。文献报道[2,6-7],通过重组PGRN或其衍生的工程化蛋白Atsttrin的局部递送可以在手术诱导的骨关节炎(osteoarthritis,OA)模型中有效抑制炎症,减少软骨基质的降解,减缓OA样表型的进一步发展,并且在非手术诱导的大鼠中表现出对OA的预防效果。已有实验显示转染pHis/Myc-PGRN质粒的稳定293细胞株,细胞增殖速度显著增加[8]。同时,PGRN还可以通过激活股骨头坏死患者体内软骨组织分离的软骨细胞ERK1/2通路,上调聚集蛋白聚糖(aggrecan,ACN)和II型胶原(collagen type II,Col II)的表达,改善软骨细胞合成代谢的能力,但具体机制尚不明确[4,9]。
本研究首先构建含有His标签的PGRN稳转细胞株,进而利用这一稳转细胞株获得具有生物活性的人源重组蛋白rhPGRN。His标签一般由6~12个氨基酸残基组成,作为一种常用的蛋白质纯化亲和标签,在蛋白质纯化方法中日益受到重视[10-11]。重组蛋白N端组氨酸残基上的咪唑基团能与Ni2+、Co2+和Ca2+等金属离子形成配位键并随固相载体中的螯合化合物如亚氨基二乙酸(iminodiacetic acid,IDA)或氨三乙酸(nitrilotriacetic acid,NTA)分离,通过咪唑溶液竞争性洗脱,可以得到约90%或者更高纯度的重组蛋白;同时,His标签可作为重组蛋白的识别标记[11-13]。我们通过大批量培养这一稳转细胞株,获得具有生物活性的重组蛋白,首先通过BCA方法及Western blot检测该重组蛋白的浓度与纯度;进一步通过细胞计数、Western blot和RT-qPCR等方法探讨其对人软骨细胞C28I2和小鼠巨噬细胞RAW264.7增殖、自噬和内质网应激(endoplasmic reticulum stress,ERS)的影响,以期为后续深入研究PGRN生物学功能、开发生物制剂提供参考资料。
材料和方法
1 材料
1.1 细胞 293-PGRN稳转细胞株和C28I2细胞均由纽约大学医学院刘传聚教授馈赠;RAW264.7细胞购自中国科学院细胞库。
1.2 主要试剂 Ni-NTA resin beads购自Novex;细胞培养液购自Gibco;细胞培养皿购自NEST;胎牛血清(fetal bovine serum,FBS)购自PAN;G418购自BioFroxx;青、链霉素溶液和BCA试剂盒购自碧云天生物技术有限公司;PGRN抗体购自Abcam;ERK、p-ERK、微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)-I/-II、蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)和需肌醇酶 1(inositol-requiring enzyme 1,IRE1)抗体购自CST;p-Akt、P62、剪接型X盒 结 合 蛋 白 1(spliced X-box binding protein 1,XBP1s)和Ki67抗体及ECL超敏化学发光液购自Affinity;β-actin抗体购自ABclonal;羊抗兔和羊抗鼠Ⅱ抗购自博士德生物工程有限公司;U0126、3-甲基腺嘌呤(3-methyladenine,3-MA)、巴弗洛霉素A1(bafilomycin A1,Baf-A1)和4-苯基丁酸(4-phenylbutyric acid,4-PBA)购自Sigma。
2 方法
2.1 细胞培养 C28I2和RAW264.7细胞使用含1×105U/L青霉素、100 mg/L链霉素和10%FBS的DMEM培养液在37℃、5%CO2细胞培养箱中常规培养。PGRN稳转细胞株加入100 mg/L的筛选抗生素G418,其余培养条件相同。
2.2 rhPGRN重组蛋白的纯化与鉴定 PGRN稳转细胞培养至150 mm培养皿,汇合度达到95%以上后,更换为25 mL无FBS DMEM培养液继续培养72 h,然后收集细胞培养液,100×g离心3 min后收集细胞上清液。取1 mL Ni-NTA resin beads,加入5 mL去离子水,100×g离心3 min弃去上清,重复3次,同样条件再使用5 mL Native buffer漂洗2次。每管resin beads加入2 mL DMEM培养液混匀后加入细胞上清液中,4℃层析柜内旋转培养器上旋转过夜。离心后收集resin beads入离心管内,加入20 mL预冷的Native buffer旋转 5 min,4℃、100×g离心3 min,重复3次。分别使用6 mL、6 mL、4 mL、4 mL预冷的Elution buffer进行洗脱,4℃旋转8 min,100×g离心3 min,收集4次的滤液使用无菌滤膜过滤至超滤柱内。4℃、4 000×g离心8 min,再加入2 mL无菌PBS,同等条件离心8 min,收集上层液体即为rhPGRN,-80℃保存。用BCA试剂盒、考马斯亮蓝染色和Western blot测定rhPGRN的浓度和纯度。
2.3 C28I2和RAW264.7细胞增殖的变化 将对数生长期的C28I2和RAW264.7细胞分别以每孔2.5×104和0.5×105的密度接种于24孔板中,每组3个复孔,细胞培养液中分别加入100和200 μg/L rhPGRN,每24 h更换培养液并加入rhPGRN,细胞汇合度达到80%后传代至6孔板。分别在2 d、3 d、4 d、5 d用胰酶消化制成细胞悬液,使用细胞计数板计数。细胞数量为计数板4个大格细胞平均数×107/L。
2.4 Western blot检测增殖、自噬和ERS相关蛋白的表达 细胞汇合度达到80%以后,细胞换用无FBS培养液,培养24 h,使用rhPGRN分别处理0、10、30和120 min后检测增殖相关蛋白表达;其余组换用含10%FBS的培养液,使用rhPGRN、3-MA、4-PBA、Baf-A1和U0126分别处理不同组细胞。各组处理的C28I2和RAW264.7细胞中加入1 mL RIPA裂解液后收集裂解液超声破碎,11 500×g离心15 min,收集上清,BCA试剂盒测定蛋白浓度。加入SDS蛋白上样缓冲液,100℃煮沸5 min。12%聚丙烯酰胺凝胶中每孔上样20 μg,120 V恒压电泳,100 V恒压转膜,5%脱脂奶粉封闭,TBST洗膜后4℃孵育Ⅰ抗过夜。TBST洗膜后加入Ⅱ抗常温孵育120 min,硝酸纤维素膜上滴加超敏ECL发光液,暗室胶片曝光。
2.5 RT-qPCR检测细胞周期相关分子的mRNA表达 C28I2和RAW264.7细胞铺皿后待细胞贴壁,使用rhPGRN单独或联合U0126处理24和48 h。首先进行细胞计数,离心后弃去上清,各组细胞加入1 mL裂解液RL,收集裂解物置于无酶EP管,4℃、11 500×g离心10 min,上清液中加入0.2 mL三氯甲烷,振荡15 s,孵育3 min,同样条件离心。取最上层液体加等体积70%乙醇,混匀后加入吸附柱RA中9 500×g离心45 s,分别用500 μL漂洗液RW、去蛋白RE、漂洗液RW洗1次。将吸附柱RA放入无酶EP管中并加入20 μL RNase-free water,11 500×g离心1 min,测浓度后逆转录为cDNA。PCR反应条件为:95℃30 s;95℃5 s,60℃30 s,共39个循环。引物序列见表1。

表1 RT-qPCR引物序列Table 1.Sequences of the primer for RT-qPCR
3 统计学处理
采用GraphPad Prism 6进行统计分析。实验数据均以均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 rhPGRN的提取与鉴定
通过Ni-NTA琼脂糖树脂亲和纯化带有His标签的重组蛋白,使用咪唑溶液洗脱后再进行考马斯亮蓝染色,结果显示目的蛋白rhPGRN分子量约为88 kD,与预期相符,纯度大于95%,另有两次提取的rh-PGRN发生降解,主要降解片段分子量约为72 kD,见图1A。通过BCA法检测蛋白浓度并绘制蛋白浓度标准曲线为y=1.564 4x+0.112 2(R2=0.998 4),测得rhPGRN浓度约为0.44 g/L和0.23 g/L,见图1B。Western blot结果表明,该重组蛋白能与PGRN抗体特异性结合,降解部分几乎不能与抗体结合,见图1C。
2 rhPGRN促进C28I2和RAW264.7细胞的增殖
在C28I2细胞培养液中加入rhPGRN(100 μg/L),处理48 h后与对照组相比细胞数量显著增加(P<0.01);而RAW264.7细胞加入rhPGRN(200 μg/L)后24 h即观察到细胞数量显著增加(P<0.05),见图2。
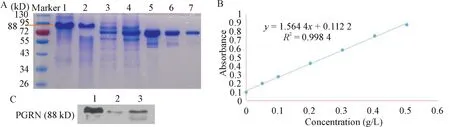
Figure 1.Identification of rhPGRN purity and concentration.A:Coomassie blue staining results(1~2:different batches of rhPGRN;3~4:degraded rhPGRN;5~7:0.5,0.2 and 0.1 g/L standard protein);B:protein standard curve;C:Western blot was used to detect the purified rhPGRN(1~3:different batches of rhPGRN).图1 rhPGRN的纯度及浓度鉴定
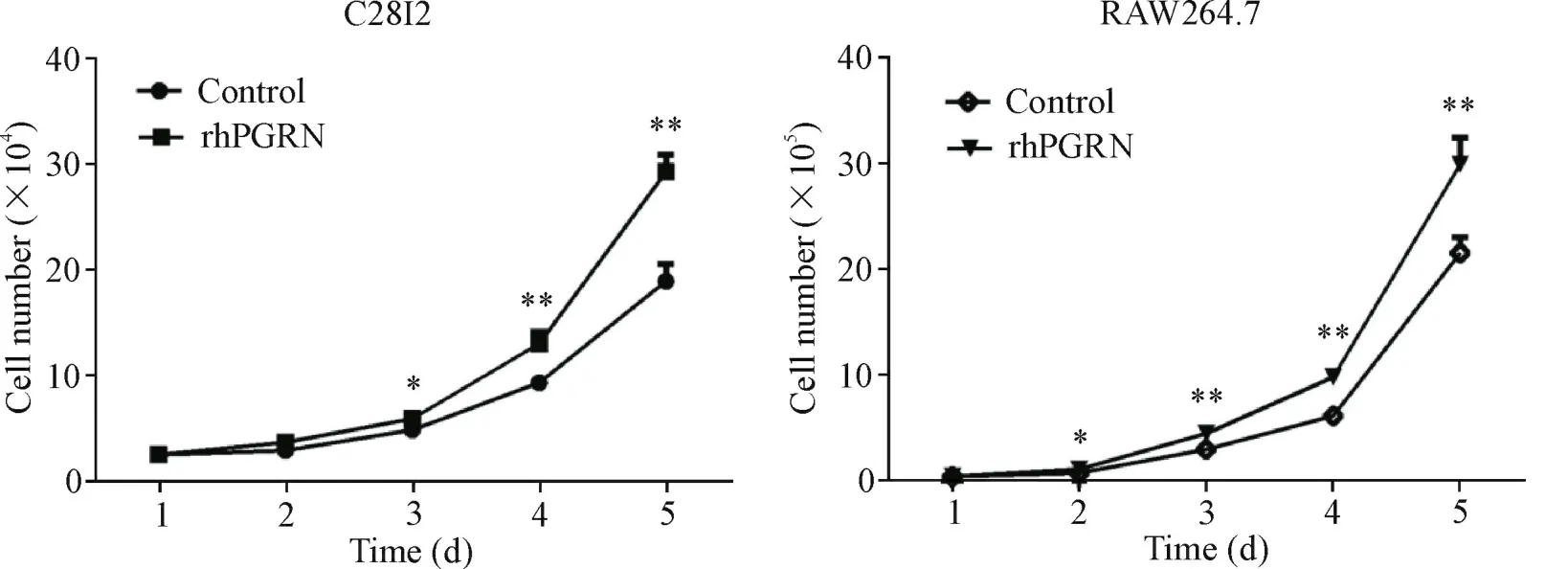
Figure 2.Effect of rhPGRN on proliferation of C28I2 and RAW264.7 cells.Mean±SD.n=3.*P<0.05,**P<0.01 vs control group.图2 rhPGRN对C28I2和RAW264.7细胞增殖的影响
3 rhPGRN对C28I2和RAW264.7细胞周期相关分子mRNA和蛋白表达的影响
在C28I2细胞,rhPGRN处理24 h后,增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、cyclin B1和cyclin D1的mRNA表达均显著上调(P<0.01),处理48 h后,cyclin B1的mRNA表达持续上调(P<0.01),而PCNA和cyclin D1的mRNA表达则较 0 h时无显著差异(P>0.05);rhPGRN 处理RAW264.7细胞24及48 h后,PCNA、cyclin B1和cyclin D1的mRNA表达水平均显著上调(P<0.05或P<0.01),见图3A、B。Western blot结果显示,rhPGRN处理C28I2和RAW264.7细胞24和48 h后,细胞周期相关蛋白Ki67的表达均显著上调(P<0.05或P<0.01),见图3C、D。
4 rhPGRN对C28I2和RAW264.7细胞MAPK和PI3K/Akt信号通路的影响
在C28I2细胞中,rhPGRN处理10 min后p-Akt、p-ERK和ERK蛋白水平均显著增加,并在rhPGRN处理10 min后达到峰值(P<0.01),随着rhPGRN处理时间延长,p-Akt、p-ERK和ERK蛋白水平逐渐降低,p-ERK相对水平(p-ERK/ERK)在120 min的处理时间内持续增高(P<0.01),见图4A。RAW264.7细胞经rhPGRN处理30 min后p-Akt、p-ERK和ERK蛋白水平均达到峰值,随后逐渐降低,p-ERK相对水平在120 min时达到峰值(P<0.01),见图4B。
5 rhPGRN通过调控MAPK信号通路促进细胞的增殖
进一步用ERK通路抑制剂U0126联合rhPGRN分别处理C28I2和RAW264.7细胞,检测细胞增殖相关各项数据。结果显示,C28I2细胞中,与rhPGRN单独处理24 h组相比,U0126+rhPGRN处理24 h后,PCNA、cyclin B1和cyclin D1的mRNA表达下调(P<0.05或P<0.01),Ki67蛋白水平下降(P<0.05);与rhPGRN单独处理48 h组相比,U0126+rhPGRN处理48 h后,cyclin B1和cyclin D1的mRNA表达显著下调(P<0.05或P<0.01),Ki67蛋白水平下降(P<0.05),细胞数量显著降低(P<0.05),见图 5A~C。RAW264.7细胞中,与rhPGRN单独处理24 h组相比,U0126+rhPGRN处理24 h后PCNA、cyclin B1和cyclin D1的 mRNA表达下调(P<0.05或P<0.01),Ki67蛋白水平显著降低(P<0.01);与rhPGRN单独处理48 h组相比,U0126+rhPGRN处理48 h后PCNA、cyclin B1和cyclin D1 mRNA水平下调(P<0.05或P<0.01),Ki67蛋白表达下调(P<0.01),细胞数量显著降低(P<0.05),见图5D~F。
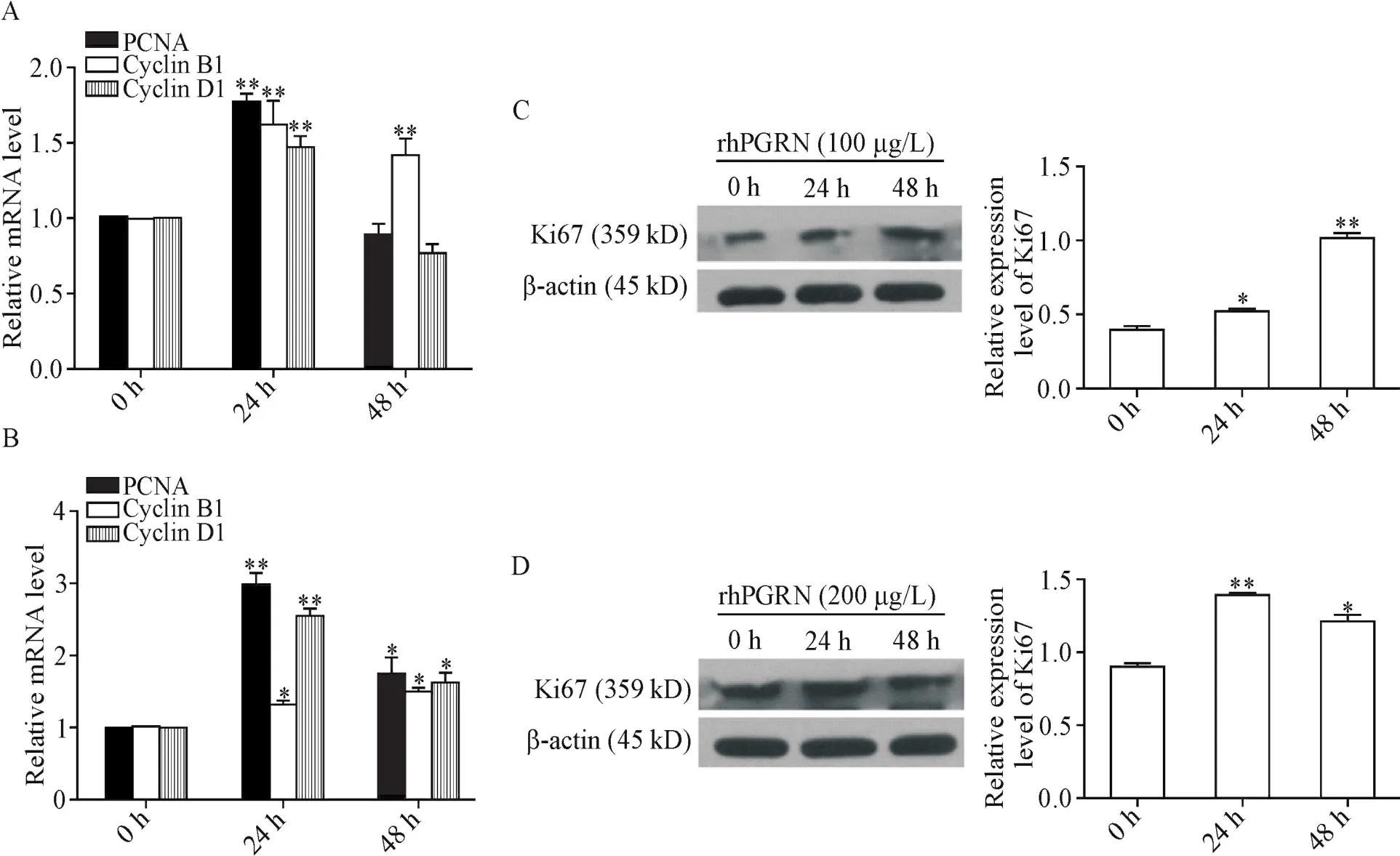
Figure 3.Effect of rhPGRN on the mRNA and protein expression of cell cycle-related molecules.A:RT-qPCR analysis of the mRNA expression of PCNA,cyclin B1 and cyclin D1 in C28I2 cells treated with 100 μg/L rhPGRN;B:RT-qPCR analysis of the mRNA expression of PCNA,cyclin B1 and cyclin D1 in RAW264.7 cells treated with 200 μg/L rhPGRN;C:the protein level of Ki67 in C28I2 cells was detected by Western blot;D:the protein level of Ki67 in RAW264.7 cells was detected by Western blot.Mean±SD.n=3.*P<0.05,**P<0.01 vs 0 h group.图3 rhPGRN对C28I2和RAW264.7细胞周期相关分子mRNA和蛋白表达的影响

Figure 4.Effect of rhPGRN on proliferation-related signaling pathways.The protein levels of p-Akt,p-ERK and ERK in rhPGRN-treated C28I2 cells(A)and RAW264.7 cells(B)were detected by Western blot.Mean±SD.n=3.*P<0.05,**P<0.01 vs 0 min group.图4 rhPGRN对C28I2和RAW264.7细胞增殖相关信号通路的影响
6 rhPGRN诱导细胞自噬和ERS依赖于MAPK信号通路
用U0126联合rhPGRN分别处理C28I2和RAW264.7细胞,并检测自噬和ERS相关蛋白表达。结果显示,rhPGRN处理组LC3-Ⅱ表达上调且P62蛋白水平降低,ERS标志蛋白PERK、IRE1和XBP1s表达上调(P<0.05或P<0.01);与rhPGRN单独处理组相比,U0126+rhPGRN组LC3-Ⅱ表达下调,P62表达上调,C28I2细胞中IRE1和XBP1s表达下调,RAW264.7细胞中PERK、IRE1和XBP1s的表达均显著下调(P<0.05),见图6。
7 rhPGRN通过PI3K/Akt信号通路调控细胞自噬与ERS
进一步采用PI3K/Akt通路抑制剂3-MA联合rh-PGRN分别处理C28I2和RAW264.7细胞,并检测自噬和ERS相关蛋白表达。结果显示,与rhPGRN单独处理组相比,3-MA+rhPGRN处理组LC3-Ⅱ表达下调,P62表达上调(P<0.05或P<0.01),C28I2细胞中XBP1s表达显著降低(P<0.05),RAW264.7细胞中ERS标志蛋白IRE1、XBP1s和PERK的表达均显著降低(P<0.05或P<0.01),见图7。
8 rhPGRN通过调控细胞自噬和ERS促进细胞增殖
采用自噬抑制剂Baf-A1或ERS抑制剂4-PBA与rhPGRN联合处理C28I2和RAW264.7细胞,结果显示,与rhPGRN单独处理组相比,Baf-A1+rhPGRN处理组和4-PBA+rhPGRN处理组细胞增殖标志蛋白Ki67表达均下调(P<0.05或P<0.01),见图8。
讨 论
类风湿性关节炎(rheumatoid arthritis,RA)、OA以及其它关节病的滑膜液中均检测到了PGRN的水平升高;PGRN被证实可以通过拮抗TNF-α信号传导来保护软骨细胞的分解代谢,在骨折组织中PGRN依赖TNFR2增强软骨骨化,发挥促进骨愈合、增强骨再生的作用[6,14]。软骨细胞中,PGRN可以通过激活ERK1/2信号传导和JunB转录因子控制软骨形成,此过程由上游分子BMP2参与调控,ERK1/2信号传导还能激活软骨细胞分化[2,4]。PGRN对炎症状态下巨噬细胞的募集具有重要作用,可以促进炎症部位中性粒细胞和巨噬细胞聚集,其机制可能是通过与TNFR1结合,调节相关趋化因子水平[15]。目前已经开发了多种PGRN的靶向策略,包括使用胺碘酮促进PGRN表达,通过真核质粒、腺病毒、慢病毒载体过表达GRN基因,直接注射或者利用3D打印支架释放重组蛋白,其中一些方法已经进入了临床试验[16-19]。本研究通过His标签蛋白纯化法提取和纯化具有生物活性的人源重组蛋白rhPGRN,并结合细胞计数和细胞增殖相关标志基因的检测,观察到rhPGRN不仅对人源软骨细胞C28I2具有促增殖作用,对鼠源巨噬细胞RAW264.7同样具有促进细胞增殖的作用,只是在不同类型细胞中rhPGRN重组蛋白对增殖相关标志基因时空表达谱的影响具有一定差异性。
PI3K/Akt信号通路调节基本的细胞功能,包括细胞生长、增殖和细胞周期;ERK1/2信号通路同样参与多种生命过程的调节,包括细胞黏附、细胞周期进程、细胞迁移、细胞存活、分化、增殖和转录[20-23]。为了进一步研究rhPGRN促进细胞增殖的机制,接下来我们探讨了rhPGRN是否影响MAPK和PI3K/Akt这两条参与细胞增殖的信号通路。在本研究中,我们观察到rhPGRN通过短暂激活ERK和Akt的磷酸化发挥促增殖作用,并且rhPGRN的这一促增殖作用在加入ERK信号通路抑制剂U0126后被显著抑制,说明rhPGRN对C28I2和RAW264.7细胞的促增殖作用至少部分依赖于MAPK信号通路。
细胞自噬和ERS是维持细胞内稳态,保护细胞存活的一种机制,通过调控细胞的增殖和凋亡实现对细胞稳态的维持,过度的自噬会导致细胞启动自噬性死亡程序,而过度ERS会导致细胞凋亡[24-25]。我们进一步探讨rhPGRN是否通过上述的MAPK/PI3K细胞增殖信号通路调控自噬和ERS。结果显示,rhPGRN可以激活自噬和ERS,采用PI3K/Akt通路抑制剂3-MA后,rhPGRN促进自噬的作用被抑制,显示rhPGRN可能通过PI3K/Akt通路激活细胞自噬;rhPGRN诱导的自噬和ERS均可被U0126抑制,提示rhPGRN通过MAPK信号通路促进细胞自噬和ERS。最后,我们还观察到,与rhPGRN组相比,rhPGRN+Baf-A1组和rhPGRN+4-PBA组增殖相关蛋白Ki67表达均被抑制。一些相关研究也报道了类似的结果,Chen等[26]的研究观察到自噬抑制剂氯喹显著抑制了大鼠肝卵圆细胞增殖;Ishimura等[27]通过ERS抑制剂4-PBA和牛磺熊去氧胆酸处理显著抑制了人血小板衍生生长因子诱导的人冠状动脉平滑肌细胞的增殖和迁移。因此,本研究提示rhPGRN可能通过MAPK/PI3K信号通路调控细胞自噬和ERS,促进细胞的增殖。

Figure 5.Effect of U0126 treatment on rhPGRN-induced cell proliferation.A:RT-qPCR results of different groups of C28I2 cells treated with 10 μmol/L U0126 and 100 μg/L rhPGRN;B:C28I2 cell counting results of different groups;C:the expression of Ki67 in C28I2 cells was determined by Western blot;D:RT-qPCR results of different groups of RAW264.7 cells treated with 10 μmol/L U0126 and 200 μg/L rhPGRN;E:RAW264.7 cell counting results of different groups;F:the expression of Ki67 in RAW264.7 cells was determined by Western blot.Mean±SD.n=3.*P<0.05,**P<0.01 vs control(0 h)group;#P<0.05,##P<0.01 vs rhPGRN(24 h)group;△P<0.05,△△P<0.01 vs rhPGRN(48 h)group.图5 U0126处理对rhPGRN诱导的C28I2和RAW264.7细胞增殖的影响

Figure 6.Effect of U0126 treatment on rhPGRN-induced autophagy and ERS.A:the levels of autophagy-and ERS-related proteins in C28I2 cells treated with 10 μmol/L U0126 and 100 μg/L rhPGRN were detected by Western blot;B:the levels of autophagy-and ERS-related proteins in RAW264.7 cells treated with 10 μmol/L U0126 and 200 μg/L rhPGRN were detected by Western blot.Mean±SD.n=3.*P<0.05,**P<0.01 vs control group;#P<0.05 vs rhPGRN group.图6 U0126处理对rhPGRN诱导的C28I2和RAW264.7细胞自噬和ERS的影响
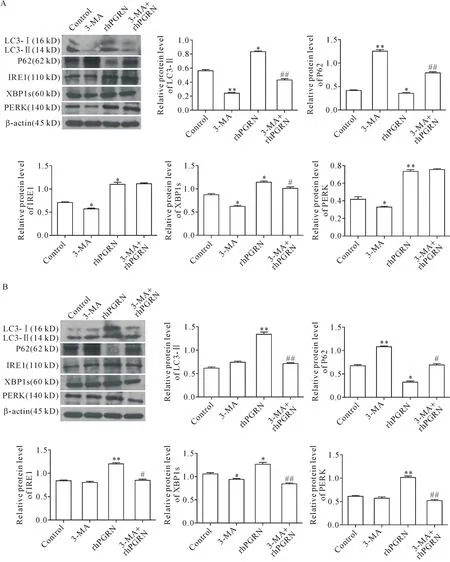
Figure 7.Effects of 3-MA on rhPGRN-induced autophagy and ERS.A:the levels of autophagy-and ERS-related proteins in C28I2 cells treated with 5 μmol/L 3-MA and 100 μg/L rhPGRN were detected by Western blot;B:the levels of autophagy-and ERS-related proteins in RAW264.7 cells treated with 5 μmol/L 3-MA and 200 μg/L rhPGRN were detected by Western blot.Mean±SD.n=3.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs rhPGRN group.图7 3-MA对rhPGRN诱导的C28I2和RAW264.7细胞自噬和ERS的影响
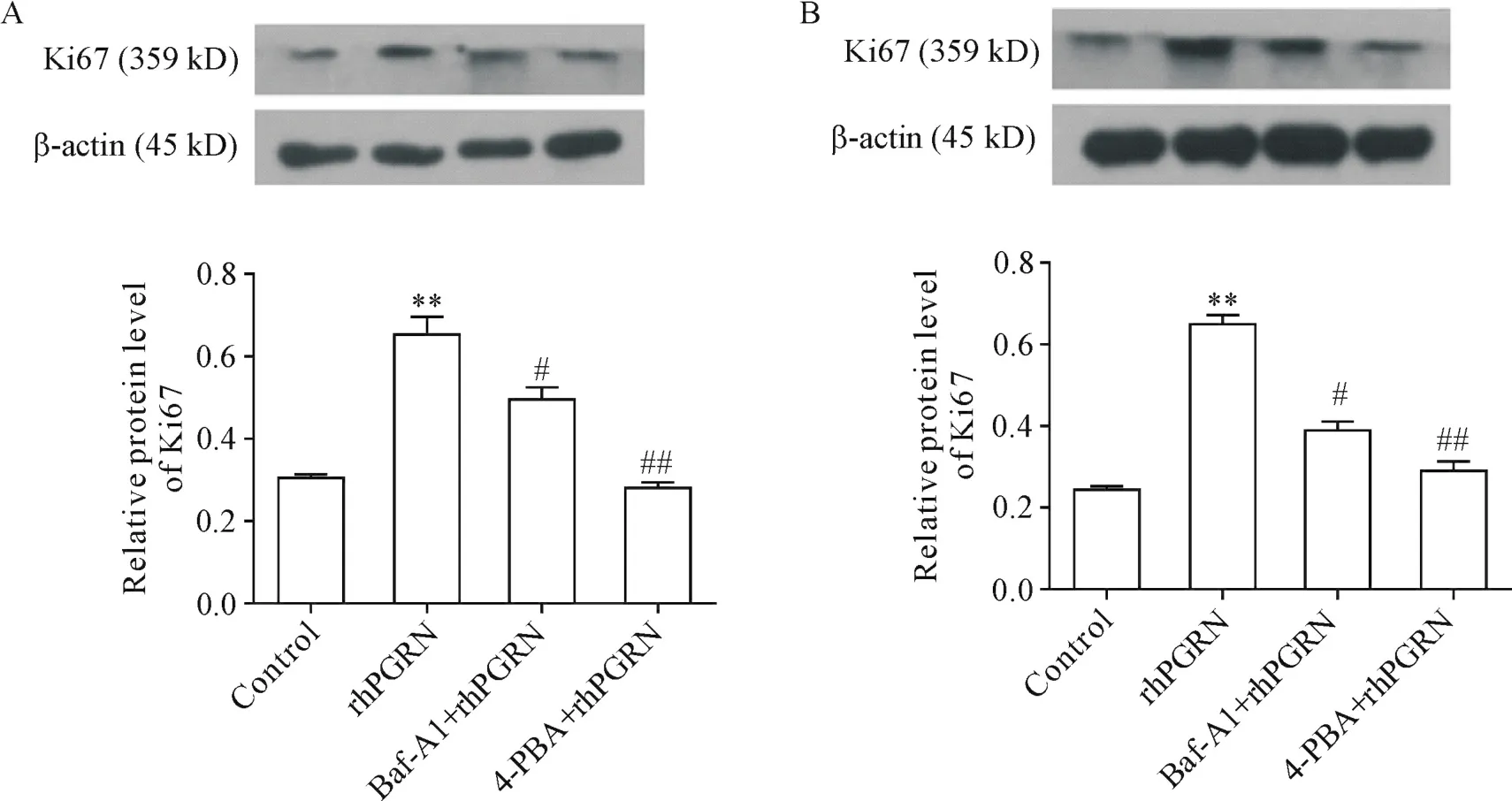
Figure 8.Effect of Baf-A1 and 4-PBA treatment on rhPGRN-induced proliferation of C28I2 cells(A)and RAW264.7 cells(B).The effects of 0.5 μmol/L Baf-A1 and 5 mmol/L 4-PBA on Ki67 expression were detected by Western blot.Mean±SD.n=3.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs rhPGRN group.图8 Baf-A1和4-PBA处理对rhPGRN诱导的C28I2和RAW264.7细胞增殖的影响
最近的研究还报道了PGRN通过PI3K/Akt途径促进胆管癌细胞增殖[28];通过TNFR2/Akt和ERK信号传导途径促进结肠癌细胞增殖[29];在人胃上皮细胞和人调节性T细胞中也被证实具有促增殖作用[30-31];GRN基因的特异性沉默抑制了非小细胞肺癌A549细胞增殖及迁移能力[32];在人角质形成细胞中,PGRN被证实通过Wnt/β-Catenin信号传导通路抑制炎症并促进细胞自噬[33];在脂肪细胞中,PGRN可以通过激活ERS引起自噬增加,引发脂肪细胞胰岛素抵抗,在肝脏细胞中也观察到自噬和ERS的紧密联系[34-35]。本研究通过培养PGRN稳转细胞株获得了活性rhPGRN蛋白,作用于两种不同类型的细胞验证其促增殖、自噬和ERS的生物学功能,并探讨了这些效应与MAPK/PI3K通路的关系。
综上所述,本研究成功提取出较高纯度的人源重组蛋白rhPGRN,并证实rhPGRN通过MAPK/PI3K信号通路调控细胞自噬和ERS,促进C28I2和RAW264.7两种不同类型细胞的增殖,为后续rhPGRN相关药物的研发奠定了基础。

