前列腺素E1通过抑制内质网应激保护心肌梗死后大鼠的心脏*
饶兰兰,马添翼
(中南大学湘雅医学院附属海口医院 1药学部,2心血管内科,海南海口570208)
心肌梗死(myocardial infarction,MI)是严重危害全球人们身体健康的最常见的疾病之一[1]。MI能造成心肌细胞损失(包含凋亡、坏死和其他类型死亡造成的细胞数减少),而梗死区残存的心肌细胞则受到MI后心力衰竭的进一步损伤[2]。心肌细胞死亡的增加和心肌间质纤维化的加重是MI后心室重构和心功能减退的重要原因[3],因此保护心肌细胞免受MI后继续损伤和抑制MI后心肌间质纤维化的加重,有望提高MI后心功能并抑制慢性心力衰竭的进展。
内质网应激(endoplasmic reticulum stress,ERS)诱导的死亡途径不同于死亡受体途径(外源性途径)和线粒体介导的死亡途径(内源性途径)[4],因此内质网也被认为是决定细胞死亡的重要细胞器。当细胞面对缺氧、缺血和钙代谢紊乱等刺激时可导致未折叠的蛋白的积累,引发内质网未折叠蛋白反应以维持细胞稳态和功能稳定性,若ERS反应过度延长或过于严重,则会导致细胞发生凋亡[5]。ERS介导的细胞凋亡涉及3种信号通路:C/EBP同源蛋白(C/EBP homologous protein,CHOP)、caspase-12和c-Jun氨基末端激酶(c-Jun NH2-terminal kinase,JNK)。此外,作为内质网的伴侣蛋白,葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)在ERS动态平衡的调节中也起着关键作用,也是ERS的标志[6]。最近研究发现,ERS参与心血管疾病的病理发展过程,减少由ERS导致的心肌细胞损伤和心室重构可提高MI后的心功能[4,7]。
前列腺素E1(prostaglandin E1,PGE1)也称前列地尔,因为具有多种药理活性如血管扩张、抑制白细胞黏附和血小板聚集、改善血液流变学特性、抗炎等,所以已被广泛用于治疗外周血管疾病、溃疡、肝病、肺动脉高压、缺血性心脏病等[8-10]。近期研究中,PGE1被证明在缺血再灌注肝损伤动物模型中可诱导 GRP78的表达[6],这提示 PGE1具有调节 ERS作用。然而,PGE1对MI后心室重构中的作用尚不清楚。因此,本研究利用冠脉左前降支结扎法建立大鼠MI模型,观察PGE1是否对MI后的心脏具有保护作用,并进一步探讨其机制。
材料和方法
1 实验动物
50只5 周龄雄性SPF级SD大鼠(130~140 g)购自南方医科大学动物实验中心[SCXK(粤)2016-0041],饲养于海南省药物研究所[SYXK(琼)2014-0025]SPF级动物房内。大鼠正常饮食、饮水。饲养环境为室温、57%湿度、采用12 h光/暗循环。
2 实验试剂
苏木素-伊红(HE)染料、戊巴比妥钠、TUNEL试剂盒、RIPA裂解液和BCA试剂盒购自江苏碧云天生物科技公司;Masson三色染色试剂盒购自北京索莱宝科技公司;PGE1(前列地尔注射液,北京泰德制药股份有限公司生产)购自本院门诊药房;同型IgG II抗和Triton X-100均购自Invitrogen;5%牛血清白蛋白购自 Sigma;抗 GRP78、CHOP、caspase-12、Bcl-2、Bax、caspase-3和cleaved caspase-3抗体以及HRP标记的II抗购自Santa Cruz。
3 实验方法
3.1 实验分组与动物模型的建立 50只SD大鼠适应性饲养1周后,10只分入假手术(sham)组,20只分入模型(model)组,20只分入model+PGE1组。参考文献[11]描述,把大鼠固定在手术台上,通过腹腔注射3%戊巴比妥钠(30 mg/kg)对大鼠进行麻醉,并予以插管和呼吸器泵通气,打开大鼠胸腔以暴露心脏,用缝线将冠状动脉左前降支从肺动脉圆锥结扎到左心耳,然后依次关闭胸腔,心电图显示ST段抬高证实构建MI大鼠模型成功。假手术组除不进行冠脉结扎外,其它手术方式与模型组相同。模型+PGE1组大鼠在冠脉结扎造模术后第1~7天,每天通过每只大鼠经尾静脉注射2 μg/kg的PGE1(注:术后第1天注射时间为术后4 h)。假手术组和模型组在假手术或冠脉结扎造模术后第1~7天,每天经尾静脉注射等量的生理盐水。所有大鼠继续饲养8周。
3.2 超声心动图对大鼠心功能的分析 8周后,使用Sonos 7500超声仪(Philips)记录大鼠仰卧时的超声心动图图像。通过观察大鼠心尖四腔的二维声波图像,记录左心室射血分数(left ventricular ejection fraction,LVEF)、左心室短轴缩短率(left ventricular fractional shortening,LVFS)、左心室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)和心输出量(cardiac output,CO)并进行数据分析。
3.3 TTC染色 8周后,每组任取5只大鼠,麻醉后,处死各组的大鼠并取出心脏,放入-80℃速冻10 min后,沿长轴连续切5片厚度为2 mm的心肌切片。心肌切片用1%TTC溶液在37℃条件下染色10 min,随后用4%多聚甲醛固定24 h,拍照,并用ImageJ软件计算梗死面积。
3.4 组织形态学分析 8周后,麻醉处死各组剩余的大鼠并取出心脏,分离左心室组织。左心室组织分成两部分,一部分直接冻存在-80℃(用于后续Western blot检测),另一部分固定在4%多聚甲醛24 h,并包埋在石蜡中进行组织学研究。石蜡包埋组织被切成厚约5 μm的切片,分别予以HE和Masson染色,观察心肌组织的形态。
3.5 TUNEL法检测 按照细胞凋亡检测试剂盒说明书步骤对各组左心室心肌组织石蜡切片进行染色并在荧光显微镜下观察,并计数病变区域或sham组同位置的TUNEL染色阳性(绿色荧光)细胞。
3.6 免疫组化染色 使用常规的免疫组织化学方法对各组左心室心肌组织石蜡切片分别进行GRP78,CHOP、caspase-12、Bcl-2、Bax和 cleaved caspase-3的免疫组织化学染色。上述I抗均为兔单克隆抗体,稀释比例分别为1∶150(抗CHOP抗体)、1∶200(抗GRP78抗体)、1∶300(抗caspase-12抗体)、1∶400(抗Bcl-2抗体和抗Bax抗体)和1∶100(抗cleaved caspase-3抗体)。然后使用苏木精进行核复染。从每个样品中随机选择病变区域或sham组同位置的的5个区域进行观察,并用ImageJ软件对目的蛋白表达进行半定量分析。
3.7 Western blot检测蛋白水平 取各组左心室心肌组织并利用RIPA裂解液萃取细胞蛋白。然后采用BCA法将各组蛋白样品定量至相同浓度后,取20 μg样品蛋白进行SDS-PAGE、转膜和封闭。封闭后以1∶1 000的稀释比例孵育I抗(caspase-12、CHOP、GRP78、Bcl-2、Bax、cleaved caspase-3 和 GAPDH 抗体),4℃过夜。次日用TBST洗涤后再室温孵育相应的HRP标记的II抗1 h,最后洗涤后利用化学发光成像仪显影。以GAPDH为内参照,采用ImageJ软件分析目的条带相对表达。
4 统计学处理
实验数据均采用均数±标准差(mean±SD)表示,并利用GraphPad Prism软件进行后续统计学分析。多组定量资料的两两比较,采用单因素方差分析事后Bonferroni检验。当P<0.05时为差异具有统计学意义。
结 果
1 各组大鼠的入组情况
因sham组无大鼠死亡,故sham组纳入10只大鼠;model组在术后第1、2、3、5和9天各发生1、2、1、3和1只大鼠死亡,故仅纳入12只大鼠;model+PGE1组在术后第3、4和8天各发生1、1和2只大鼠死亡,故纳入16只大鼠。
2 PGE1提高MI后的大鼠心功能
术后8周,通过超声仪分别检测各组大鼠的心功能,结果显示,与sham组相比,model组大鼠的LVEF、LVFS和CO显著降低,而LVEDD显著升高(均P<0.01);与 model组相比,model+PGE1组大鼠的LVEF、LVFS和CO显著升高(P<0.01或P<0.05),LVEDD显著降低(P<0.01),见图1。以上结果提示PGE1可提高MI后大鼠的心功能。
3 PGE1降低MI后的小鼠心肌梗死和病理形态学改变
通过HE和Masson染色观察心肌组织病理学改变,结果显示,sham组大鼠左心室区域心肌细胞形状规则,心肌纤维排列整齐,心肌间质间未见明显的炎性细胞浸润(图2A),也未见明显的胶原沉积(图2B);model组大鼠左心室区域梗死区和非梗死区边界清晰,梗死区炎性细胞浸润,心肌细胞形态不规则,心肌条纹紊乱或消失(图2A),出现心肌间质纤维化和大量胶原沉积(图2B);model+PGE1组大鼠左心室区域梗死区和非梗死区边界清晰(但梗死区较小),梗死区炎性细胞浸润较model组轻,心肌细胞形状和心肌纤维排列也趋向正常(图2A),梗死区心肌间质纤维化和胶原沉积也较model组轻(图2B)。对Masson染色阳性区面积统计显示,与sham组相比,model组大鼠的心肌Masson染色阳性面积显著增大(P<0.01);与model组相比,model+PGE1组心肌Masson染色阳性面积显著减小(P<0.01),见图2B。TTC染色结果显示,与sham组相比,model组大鼠的心肌梗死面积显著增大(P<0.01);与model组相比,model+PGE1组心肌梗死面积显著减小(P<0.01),见图2C。
4 PGE1减轻MI后的心肌损伤
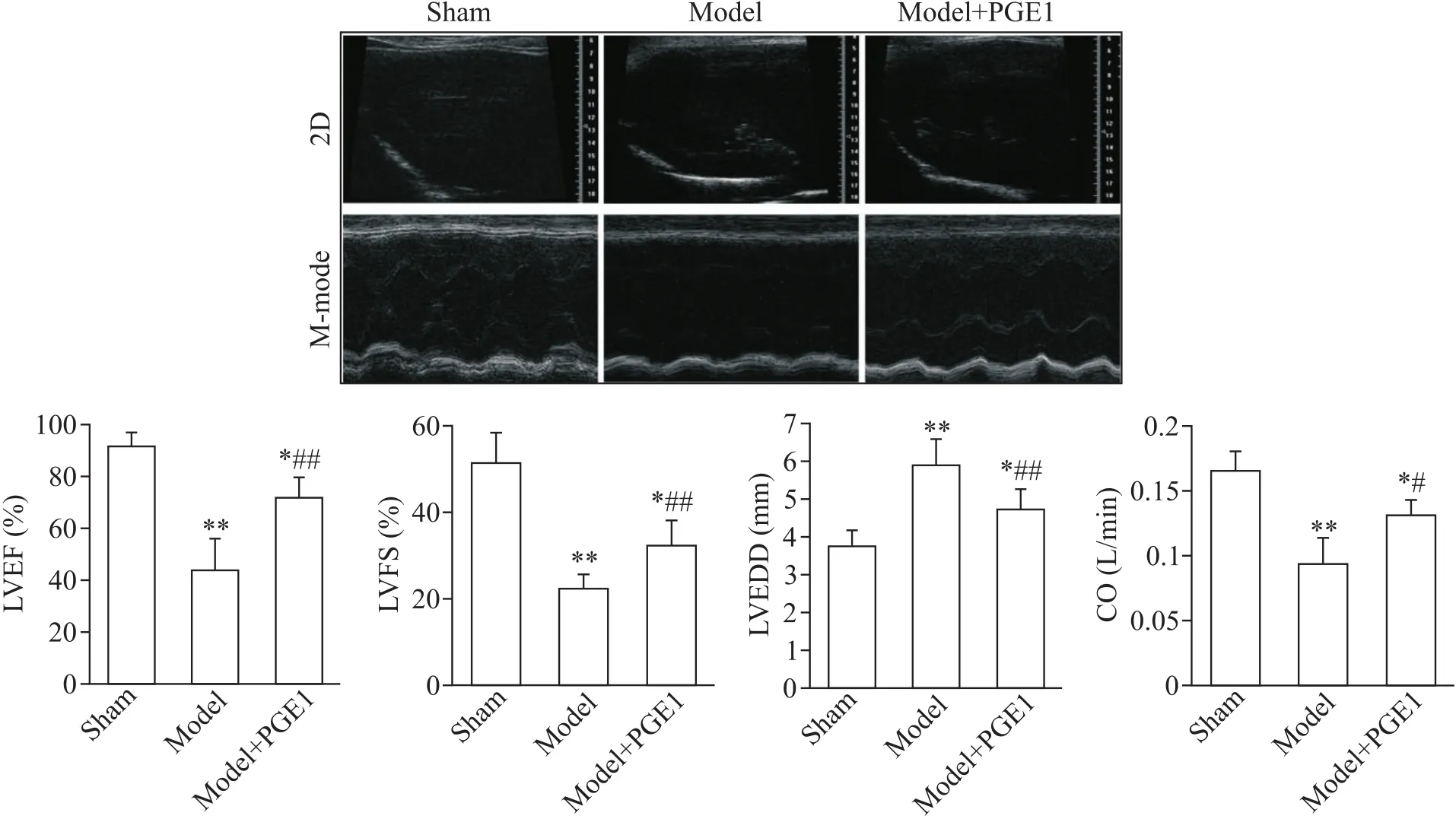
Figure 1.Effect of PGE1 on the cardiac function parameters after MI in rats.LEVF:left ventricular ejection fraction;LEFS:left ventricular fractional shortening;LVEDD:left ventricular end-diastolic dimension;CO:cardiac output.Mean±SD.n=10 in sham group;n=12 in model group;n=16 in model+PGE1 group.*P<0.05,**P<0.01 vs sham group;#P<0.05,##P<0.01 vs model group.图1 PGE1对MI后大鼠心功能参数的影响

Figure 2.Effect of PGE1 on the pathological changes and the infarct size of cardiac tissues after MI in rats.A:representative images of HE staining(scale bar=50 μm);B:representative images of Masson staining(scale bar=50 μm)and quantitative results of Masson staining-positive size;C:representative images of TTC staining(scale in millimeters)and quantitative results of infarct size in cardiac tissues.Mean±SD.n=5.*P<0.05,**P<0.01 vs sham group;##P<0.01vs model group.图2 PGE1对MI后大鼠心肌组织病理改变和梗死灶大小的影响
TUNEL法结果显示,与sham组同位置心肌切片相比,model组大鼠心肌切片的病变区的TUNEL阳性细胞数量显著增加(P<0.01);与model组相比,model+PGE1组大鼠心肌切片的病变区的TUNEL阳性细胞数量显著降低(P<0.01),见图3A。免疫组化染色观察结果显示,sham组同位置心肌组织Bcl-2呈中阳性,Bax呈弱阳性,cleaved caspase-3呈阴性表达;model组病变区心肌组织Bcl-2呈阴性,Bax和cleaved caspase-3呈强阳性弥散表达;model+PGE1组病变区心肌组织Bcl-2呈强阳性弥散表达,Bax和cleaved caspase-3呈中阳性表达,见图3B。进一步用ImageJ软件量化免疫组化染色图中蛋白表达结果显示,与sham组同位置心肌组织相比,model组病变区心肌组织Bcl-2表达显著降低、Bax和cleaved caspase-3表达显著增加(P<0.01);与model组病变区心肌组织相比,model+PGE1组病变区心肌组织Bcl-2表达显著增加、Bax和cleaved caspase-3表达显著降低(P<0.01),见图 3B。Western blot结果显示,与sham组相比,Model组心肌组织Bcl-2表达显著降低、Bax和cleaved caspase-3的蛋白水平显著增加(P<0.01);与 model组相比,model+PGE1组心肌组织Bcl-2表达显著增加、Bax和cleaved caspase-3的蛋白水平显著降低(P<0.01),见图3C。

Figure 3.Effect of PGE1 on myocardial damage after MI in rats.A:the representative images of cardiac tissues with TUNEL staining(scale bar=100 μm)and the quantitative results of TUNEL-positive cells;B:the representative images of immunohistochemical staining(scale bar=100 μm)for Bcl-2,Bax and cleaved caspase-3 in cardiac tissues and the quantitative results;C:the representative Western blot images and quantitative results of the protein levels of Bcl-2,Bax and cleaved caspase-3.Mean±SD.n=5 in sham group;n=7 in model group;n=9 in model+PGE1 group.**P<0.01 vs sham group;##P<0.01 vs model group.图3 PGE1对MI后大鼠心肌损伤的影响
5 PGE1抑制MI后的内质网应激水平
通过免疫组化和Western blot法检测ERS标志分子GRP78、CHOP和caspase-12的表达水平来评价PGE1对ERS的影响。免疫组化染色观察结果显示,sham组同位置心肌组织的caspase-12、CHOP和GRP78呈阴性表达;model组病变区心肌组织的caspase-12、CHOP和GRP78呈强阳性弥散表达;model+PGE1组病变区心肌组织的caspase-12、CHOP和GRP78呈中阳性表达,见图4A。进一步用ImageJ软件量化免疫组化染色图中蛋白表达结果显示,与sham组同位置心肌组织相比,model组病变区心肌组织caspase-12、CHOP和GRP78的表达显著增加(P<0.01);与model组相比,model+PGE1组病变区心肌组织caspase-12、CHOP和GRP78的表达显著减少(P<0.01),见图4A。Western blot结果显示,与sham组相比,model组心肌组织caspase-12、CHOP和GRP78的表达显著增加(P<0.01);与model组相比,model+PGE1组心肌组织caspase-12、CHOP和GRP78的表达显著减少(P<0.01),见图4B。

Figure 4.Effect of PGE1 on the ERS level of cardiac tissues after MI in rats.A:the representative images of immunohistochemical staining(scale bar=100 μm)for caspase-12,CHOP and GRP78 in cardiac tissues and the quantitative results;B:the representative Western blot images and quantitative results of the expression levels of caspase-12,CHOP and GRP78.Mean±SD.n=5 in sham group;n=7 in model group;n=9 in model+PGE1 group.*P<0.05,**P<0.01 vs sham group;##P<0.01 vs model group.图4 PGE1对MI后大鼠心肌组织ERS水平的影响
讨 论
缺氧、氧化应激、炎症反应等各种刺激均是MI引发ERS的常见激活因素[5]。本研究显示冠脉结扎8周后心肌组织的CHOP、GRP78和caspase-12表达显著升高,表明MI 8周后存在心肌组织ERS的激活。有证据表明,在MI 4周后心肌细胞GRP78和CHOP开始显著升高,伴随 caspase-3 的激活[4,7]。由于 caspase-3的激活参与线粒体介导、死亡受体和ERS诱导的死亡途径,因此cleaved caspase-3被认为是细胞死亡的标志。MI后的心力衰竭可诱导ERS,而ERS过度反应又进一步促进心肌细胞cleaved caspase-3的表达,进一步加重心力衰竭的发展[4,7,12]。本研究结果显示,MI 8周后心肌细胞死亡增多,心肌组织促凋亡因子Bax和凋亡标志物cleaved caspase-3表达升高,抑凋亡因子Bcl-2表达降低,心肌梗死面积的扩大。
PGE1因具有扩张血管、抑制血小板聚集、保护细胞等作用,被广泛应用于脑血管疾病及循环系统、呼吸系统和外周血管疾病的治疗。最近研究发现,PGE1可通过降低内质网分子伴侣CHOP和GRP78的表达抑制ERS诱导的细胞凋亡[6]。本研究结果显示,PGE1能抑制MI大鼠的GRP78、CHOP和caspase-12表达升高,提示PGE1能显著降低MI后的ERS水平;且PGE1能抑制Bax表达和促进Bcl-2表达,降低caspase-3的活化,减少MI后心肌细胞死亡的数量。另外,MI后心功能减退不仅与心肌细胞损失相关,还与心肌间质的胶原沉积和炎性因子浸润相关;胶原过度沉积能导致心肌间质组织纤维化,降低心功能;炎性因子浸润不仅能促使心肌细胞死亡,还能加重MI后心力衰竭的发展[13-14]。ERS的过度激活能增加MI后炎性因子浸润和胶原异常增生[4,7]。本研究结果显示,PGE1能减少MI 8周后胶原过量沉积,减轻炎症反应,并减缓心功能的降低。结合以上实验结果推测,PGE1可能通过抑制MI后ERS的激活,随之抑制心肌细胞死亡、胶原异常增生和炎症,最终提高MI后的心功能。
综上所述,PGE1可减缓MI后慢性心力衰竭的进展,其机制可能是其通过抑制MI后心肌ERS的激活,进而减少胶原过量沉积、炎性浸润和心肌细胞死亡并提高MI后的心功能。

