碳青霉烯类耐药大肠埃希菌耐药基因型检测及同源性分析
胡志军,吴希静,潘晓龙,崇慧峰,朱娟娟,赵哲,唐吉斌
作者单位:铜陵市人民医院,a检验科,b妇产科,安徽 铜陵244000
碳青霉烯类耐药肠杆菌科细菌(Carbapenem-resistant Enterobacteriaceae,CRE)在我国临床上越来越常见,美国疾病控制和预防中心(CDC)已经将CRE定义为对全球公众健康构成严重威胁三种微生物之一[1],但碳青霉烯类耐药大肠埃希菌分离率相对稳定,一直维持在2%左右[2-3]。大肠埃希菌对碳青霉烯类抗生素的耐药机制在各地区均见到不同报道。因此,笔者检测临床分离的碳青霉烯类耐药大肠埃希菌所携带的碳青霉烯酶耐药基因型,并对其进行同源性分析,为医院感染和临床提供参考依据。
1 材料与方法
1.1 材料 25株碳青霉烯类耐药大肠埃希菌分离自2012年9月至2016年10月铜陵市人民医院临床标本,剔除同一病人重复菌株。抗菌药物纸片和培养基分别为英国OXOID公司和合肥天达公司产品。
1.2 方法
1.2.1 细菌培养鉴定和药敏试验 严格按照操作规程进行,梅里埃公司Vitek-2 Compact型细菌鉴定仪进行细菌鉴定。采用纸片扩散法进行药敏试验,依据CLSI 2015年[4]标准判断结果。质控菌株为大肠埃希菌ATCC 25922。
1.2.2 EDTA双纸片协同试验 将培养过夜的细菌制成0.5麦氏浓度菌液,接种MH平板,晾干后中间贴IPM,相距1~2 cm处贴EDTA纸片(含4 μL 0.5 M EDTA)。培养18~24 h后,以IPM抑菌圈在EDTA纸片侧明显扩大者为金属酶阳性。
1.2.3 改良Hodge试验 参照CLSI 2015推荐方法进行。
1.2.4 碳青霉烯酶基因检测 (1)PCR试剂与仪器:PCR试剂盒、琼脂糖(进口分装)、DNA Marker、电泳缓冲液等试剂为上海生工产品。扩增用瑞士罗氏cobas z 480型PCR仪进行。(2)PCR方法:煮沸法提取细菌DNA模板,实验严格按照试剂盒说明书操作。各引物序列(表1)由上海生工合成。扩增产物经(137V)凝胶电泳30 min后,置凝胶成像系统上成像。(3)基因测序:阳性扩增产物由上海生工公司进行纯化和测序,测序结果经BLASTn比对来确定碳青霉烯酶基因型。

表1 PCR引物序列
1.2.5 肠杆菌科基因间重复一致序列PCR (ERIC-PCR)(1)ERIC-PCR方法:煮沸法提取细菌DNA模板,严格按照生工PCR反应试剂盒(B532073)说明书操作。反应体系共50 μL,ERIC-PCR引物:E1 5′-ATGTAAGCTCCTGGGGATTCAC-3′,E2 5′-AAGTAAGTGACTGGG GTGAGCG-3′。反应条件为:预变性94℃ 7 min,变性94℃ 1 min,退火52℃ 1 min,延伸65℃8 min,共30个循环,最后65℃延伸16 min。扩增产物经(46 V)凝胶电泳2 h后,置凝胶成像系统上成像。(2)DNA同源性分析:电泳后,分型条带位置完全相同和相差1~2条者为同一基因型,相差3条及以上者为不同型别。
2 结果
2.1 碳青霉烯类耐药大肠埃希菌的科室和标本来源 25株碳青霉烯类耐药大肠埃希菌分离自临床13个科室,其中肝胆外科和胃肠外科各4(16.0%)株,泌尿外科和神经外科各3(12.0%)株,耳鼻喉头颈外科和骨科各2(8.0%)株,急诊科、妇科、呼吸内科、神经内科、肾内科、重症医学科和中医风湿科各1(4.0%)株。标本分布中,分离自中段尿最多,11(44.0%)株,其次是痰液6(24.0%)株,脓标本3(12.0%)株,胆汁和引流液各2(8.0%)株,血液标本1(4.0%)株。
2.2 改良Hodge试验结果 25株碳青霉烯类耐药大肠埃希菌改良Hodge试验8株阳性,阳性率32.0%。
2.3 金属酶初筛试验结果 25株碳青霉烯类耐药大肠埃希菌中,EDTA协同试验13株阳性,阳性率52.0%。
2.4 碳青霉烯酶基因型检测结果
2.4.1 PCR扩增结果 25株碳青霉烯类耐药大肠埃希菌中分别扩增出4株NDM基因、1株IMP基因和1株KPC基因阳性产物;未见VIM和OXA-48型阳性产物。
2.4.2 PCR产物测序结果 扩增阳性产物测序序列经BLASTn网上比对后与目标基因型同源性均为100%,分别为4株NDM-1型(图1)、1株IMP-4型和1株KPC-2型碳青霉烯酶。
2.5 ERIC⁃PCR同源性分析结果
2.5.1 ERIC-PCR同源性分型结果 25株碳青霉烯类耐药大肠埃希菌应用ERIC-PCR扩增后电泳,对电泳条带进行基因分型,每株细菌产生3~7条扩增条带,称为指纹图谱,部分结果见图2。16株碳青霉烯类耐药大肠埃希菌共分10型,无明显优势型别。其中9株细菌未扩增出有效条带,未分型。
2.5.2 10型碳青霉烯类耐药大肠埃希菌在科室流行情况 10型碳青霉烯类耐药大肠埃希菌在临床科室中呈散在分布,未见同一型别的细菌在同一科室集中出现,并且同一科室的几株细菌还分离自不同年份。
3 讨论
大肠埃希菌是医院感染最多见的病原菌,但令人欣慰的是细菌耐药性监测显示碳青霉烯类耐药大肠埃希菌感染率并未出现明显增加,维持在1%~3%。尽管近年大肠埃希菌耐药率未见明星上升,而且存在一定的好转趋势[8],但仍需密切关注此类细菌的变化。
CRE的耐药机制目前报道最多的是产碳青霉烯酶肺炎克雷伯菌,在大肠埃希菌中报道的较少,基本都是散在出现。而且国内外研究均提示碳青霉烯类耐药大肠埃希菌的耐药机制有明显的地域性差异,在不同的地方检出的耐药基因型也不一样[9-13]。本研究中,金属酶筛选试验双纸片协同试验阳性率为52.0%;而改良Hodge试验阳性率较低,为32.0%,说明本地区碳青霉烯类耐药大肠埃希菌的耐药机制可能以产B类金属酶为主,随后的耐药基因也证实上面观点。本研究中,检出5例B类金属酶耐药基因(4例blaNDM-1和1例blaIMP-4)和1例A类碳青霉烯酶耐药基因(blaKPC-2)。近年,国内外均有报道携带blaNDM-1型耐药基因的碳青霉烯类耐药大肠埃希菌[9-10,14-15],而新德里金属β-内酰胺酶(NDM)在2008年首次从肺炎克雷伯菌中发现,被称为“超级细菌”。随后在印度、巴基斯坦、科威特、美国等国家[16-17]均有报道,尤其NDM-1在新加坡、印度等国家是最常见的碳青霉烯酶基因型。但在我国并不多见,只有一些散在报道。本研究中碳青霉烯类耐药大肠埃希菌却是携带blaNDM-1型耐药基因为主,这类细菌耐药性强,需要我们高度重视,密切监测这类细菌,避免出现暴发流行。

图1 碳青霉烯类耐药大肠埃希菌的NDM-1型测序结果部分峰图
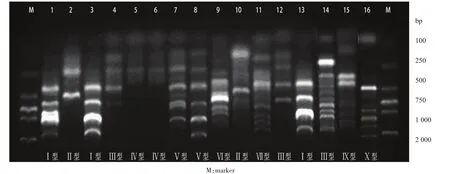
图2 碳青霉烯类耐药大肠埃希菌的基因间重复一致序列聚合酶链反应技术指纹图谱
此外,本研究还检测到1例携带blaIMP-4型耐药基因的碳青霉烯类耐药大肠埃希菌,IMP是最常见的B类碳青霉烯酶,在我国主要为IMP-4和IMP-8型。同时,还检出1例携带blaKPC-2型耐药基因的碳青霉烯类耐药大肠埃希菌,KPC-2基因主要见于肺炎克雷伯菌,也是本地区碳青霉烯类耐药肺炎克雷伯菌的主要耐药基因,在碳青霉烯类耐药大肠埃希菌中也是时有报道,但一般并不构成主要类型。遗憾的是,实验条件限制,本研究可能漏检了其他基因型,膜孔蛋白和外排泵机制也未作研究。
脉冲场凝胶电泳(PFGE技术)是目前国际公认的病原菌同源性分析的金标准,但其仪器昂贵,操作复杂,不适用于基层实验室开展。而ERIC-PCR技术操作简单、分型效率高,已成为肠杆菌科DNA基因分型常用方法[18-19]。本研究的ERIC-PCR同源性分析结果显示,碳青霉烯类耐药大肠埃希菌分属于10个不同的流行克隆型,10型碳青霉烯类耐药大肠埃希菌在临床科室中均呈散在分布,25株细菌分离自13个不同的临床科室,未见同一型别的细菌在同一科室集中出现,并且同一科室的几株细菌还分离自不同年份,这些都提示该细菌在本院只是散在流行,未出现暴发流行的情况。
综上所述,本地区碳青霉烯类耐药大肠埃希菌的耐药机制以携带B类碳青霉烯酶(金属酶)为主,尤其是携带blaNDM-1型耐药基因最常见,同时还存在blaIMP-4和blaKPC-2型耐药基因,未发现暴发流行,呈现散在流行,为院感控制工作提供了实验室依据。

