IgG4相关性硬化性胰腺炎1例报道及文献复习
张德华, 赵 婕
1.山西医科大学,山西 太原 030000;2.山西医科大学第二医院消化内科
病例患者,男,59岁,主因上腹部憋胀不适3个月余,于2019年6月4日入院,3个月前无明显诱因出现持续性上腹部憋胀不适,进食后明显,伴腰背部困痛,偶有进食后反酸,无恶心、呕吐、发热、腹痛、腹泻,无呕血、黑便,于2019年4月16日就诊于山西省人民医院行CT示:胰头部占位,胰头Ca可能,为进一步明确诊断,4月21日在山西省肿瘤医院行MRCP示:胰头占位,考虑恶性,4月28日行胰十二指肠联合切除+活检术(见图1~3),活检回报:胰腺腺泡萎缩,间质纤维组织增生伴大量淋巴细胞、浆细胞及嗜酸性类细胞浸润,伴淋巴滤泡形成,未见癌。免疫组化:AE1/AE3(残余上皮+),CK7(残余上皮+),CK19(残余上皮+),CD3(部分淋巴细胞+),CD20(部分淋巴细胞+),IgG(浆细胞+),IgG4(部分区域>10/HPF),Ki67(约50%+),考虑“IgG4相关性硬化性胰腺炎”,为求进一步诊治,收住我科。患者自发病以来,精神、食欲可,睡眠欠佳,大、小便正常,体质量1个月内减轻约5 kg。既往史:2019年4月28日于山西省肿瘤医院行胰十二指肠联合切除+活检术。个人史:抽烟40余年,平均10支/d,饮酒30余年,平均2两/d。
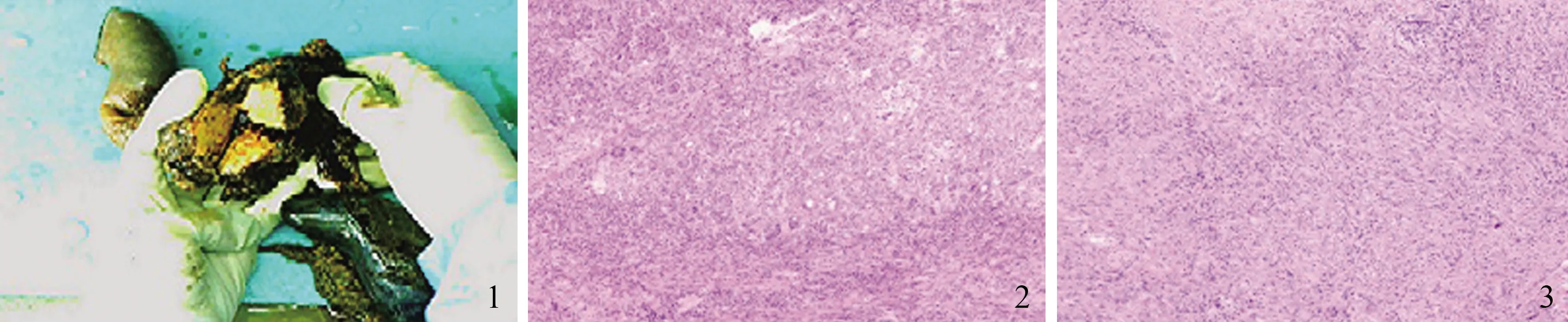
图1 胰十二指肠联合切除;图2~3 胰腺细胞病理(HE染色,放大200倍)Fig 1 Pancreaticoduodenectomy; Fig 2-3 Pathology pancreas cell
查体:全身皮肤黏膜无黄染,无肝掌、蜘蛛痣,无扑翼样震颤。全身浅表淋巴结未触及肿大。巩膜无黄染。腹软,全腹无压痛,肝脾脏肋下未触及,Murphy氏征阴性。无移动性浊音。辅助检查(2019年6月5日):血常规:(-);血沉10 mm/h,CRP 25.8 mg/L;ALT 29.10 U/L,AST 47.90 U/L,ALB 33.50 g/L,GGT 205.00 U/L,ALP 440.00 U/L,血糖5.08 mmol/L,血糖(2 h)8.81 mmol/L,D二聚体:425 ng/ml,肾功能(-);血脂肪酶11.50 U/L;血淀粉酶28.60 U/L;多肿瘤标志物(-),ANA-M2阴性(-);ANA谱(-);ENA谱(-);类风湿筛查:(-);自身免疫肝病六项:(-);细胞因子系列:IL-6 11.42 pg/ml;IL-10 5.35 pg/ml;TNF-α 2.61 pg/ml;IgG4 3 300 mg/L。心电图:窦性心动过缓,心率:54次/min,心电图大致正常;腹部彩超:胰头实性占位伴周围小淋巴结肿大,主胰管轻度扩张,胆囊稍大,内胆泥沉积,肝S2段高回声结节—血管瘤?必要时超声造影检查,腹部CT(平扫+增强):胰头部占位,胰头Ca可能,伴肝内、外胆管、胰管扩张,胆囊大,肝门部、腹腔及腹膜后多发肿大淋巴结,肝脏多发小囊肿,前列腺肥大伴钙化,盆腔积液;上腹部增强CT:胰十二指肠联合切除术后改变,胰体囊肿,右肾中级契形低密度影,考虑肾梗死,胆囊显影欠佳,请结合临床,腹腔积液;MRCP:胰头占位,考虑恶性,致胆系及胰管梗阻征象;胃镜:胰十二指肠联合切除术后 胃潴留 食管贲门病变?贲门炎可能性大。
诊断:(1)IgG4相关性硬化性胰腺炎,(2)胰十二指肠联合切除术后,(3)肝多发囊肿,(4)胃潴留,(5)食管贲门病变?贲门炎可能性大;治疗:醋酸泼尼松片15 mg qd,沙利度胺片50 mg qn;熊去氧胆酸胶囊0.25 tid。2019年6月15日复查肝功:ALT 9.60 U/L,AST 14.70 U/L,ALB 33.80 g/L,ALP 163.00 U/L,GGT 70.20 U/L。治疗2周后临床症状减轻,复查IgG4 3 070 mg/L,CRP 10.20 mg/L,考虑糖皮质激素诱导缓解IgG4相关性硬化性胰腺炎有效,3周后复查ESR、CRP均在正常范围,免疫筛查均阴性,ALT 9.10 U/L,AST 17.10 U/L,ALB 34.30 g/L,GGT 69.20 U/L,ALP 147.03 U/L,IgG4 2 630 mg/L,CRP 9.20 mg/L;3个月后复查ESR、CRP、淀粉酶均在正常范围,免疫筛查均阴性,ALT 9.12 U/L,AST 17.19 U/L,ALB 34.30 g/L,GGT 69.12 U/L,ALP 107 U/L,IgG4 2 031 mg/L;6个月后复查ESR、肝功、淀粉酶均在正常范围,免疫筛查均阴性,CRP 14.1 mg/L,IgG4 1 834 mg/L,该患者无上腹部憋胀等不适,病情稳定,激素逐渐减量,现为醋酸泼尼松片5 mg qd维持治疗,进一步随访中。
讨论(1)分型与临床表现:自身免疫性胰腺炎(AIP)是一种慢性的胰腺纤维炎症性疾病,是IgG4-RD最常见的一种表现形式。目前相关国际研究认为AIP有两种类型[1]:1型AIP即IgG4-AIP,又称淋巴浆细胞硬化性胰腺炎,与IgG4阳性抗体有关,伴有闭塞性静脉炎及组织纤维化[2];2型AIP,即特发性导管中心性胰腺炎,IgG4抗体阴性[3]。虽然1型AIP有更多的外显化表现和更常见的复发,但两种类型的AIP临床均可表现为无痛性梗阻性黄疸、乏力、体质量减轻,均对皮质类固醇治疗有反应,组织学检查是目前唯一的鉴别方法[4-6]。
AIP与胰腺癌临床表现相似,且1型AIP患者常合并腹膜后纤维化、浆膜腔积液等征象,部分患者肿瘤标志物如CA199升高,更易被误诊为胰腺癌,将AIP诊断为胰腺癌导致不必要的手术,延误患者病情,不同的研究报道CA199用于鉴别肿块型胰腺炎(其中大部分为AIP)的敏感度为56%~87.5%,特异度为60%~95%,但其临界值从37 U/ml到306.75 U/ml不等[4,7-8]。因此,早期鉴别二者对于患者避免不必要的开腹及胰腺手术有十分重要的意义。
(2)血清学特点:IgG4是诊断该病的唯一血清学指标,也是诊断的重要指标。Hamano等[9]以血清IgG4>1 350 mg/L作为AIP与胰腺癌的鉴别点,诊断AIP的灵敏度为95%,特异度为97%;Chari[10]的研究结果显示,以血清IgG4>1 440 mg/L作为两者鉴别诊断的界点,诊断AIP的灵敏度为95%,特异度为97%;Ngwa等[11]认为IgG4升高超过正常值上限的2倍在IgG4相关AIP中更为常见;Meng等[6]研究表明,AIP患者IgG4阳性率可达86.0%。因此,IgG4作为1型AIP相关的血清标志物,对于AIP的诊断具有重要作用。
(3)影像学特点:1型AIP典型表现[12-13]:超声检查:弥漫增大的低回声胰腺;CT/MRI检查:可见胰腺弥漫/局部/节段肿大伴延迟强化,胰腺周围常呈现低密度晕环;ERCP/MRCP检查:不伴远端扩张的长段或多发主胰管狭窄(1级),不伴远端扩张的节段性或局灶性主胰管狭窄(2级);胰腺/胰腺外病变的影像学表现在2周内缓解或消退。
(4)病理组织学特点:胰腺导管周围有大量的淋巴细胞/浆细胞浸润和纤维化;IgG4阳性浆细胞浸润(>10个/HPE)和(或)IgG4/IgG>40%,腺泡细胞萎缩伴有席纹状纤维化、闭塞性静脉炎[14]。
(5)治疗:激素是治疗AIP的首选药物,但治疗的初治剂量和维持剂量的选择仍有争议。日本学者建议起始剂量为泼尼松龙0.6 mg·kg-1·d-1,持续2~4周;之后逐渐减量,3~6个月后减量至5 mg/d;随后2.5~5 mg/d维持3年[15]。Kamisawa等[16]报道激素治疗后约98%的患者病情缓解,而未接受激素治疗的患者缓解率为78%,经维持治疗仍有25%的患者复发。Mayo医院推荐的治疗方案的起始剂量为泼尼松40 mg/d,持续4周,随后每周减量5 mg,7周后停用,总疗程11周,应用此种方案后50%的患者在中位数3个月(0~14个月)后复发。而国内的经验是:对于活动性者,泼尼松的起始剂量为1 mg/kg,维持4周后开始减量,每2周减5 mg,30 mg/d后每2周减2.5 mg,逐渐减至最小有效剂量维持2~3年[17];激素疗效不佳时可考虑换用或联合免疫调节剂(硫唑嘌呤、霉酚酸酯、环孢素A等)及生物制剂治疗[18]。因此,对AIP患者的治疗应根据临床症状、严重程度、疾病进展情况,充分评估患者的风险与获益来选择治疗方案。
综上所述,由于IgG4相关性硬化性胰腺炎缺乏特异的临床表现、血清学指标及影像学指标,与各种炎症及肿瘤疾病症状相似。且目前我们对该疾病的病因、发病机制、诊断、治疗等方面的认识尚不足,因此需要给予充分重视,并不断地努力探寻其病因、发病机制和寻求更高、更灵敏的诊断标准及治疗方法,同时对疾病的远期预后进行更准确的评估。

