儿童新型冠状病毒肺炎1例临床检验结果启示
王仁峰 孙鹏 郝贵亮 温荣 李俊新 李文杰
2019年12月武汉市陆续发现了多例新型冠状病毒肺炎患者,随后研究显示其为一种新型冠状病毒(Coronavirus,CoV),于2020年1月7日被世界卫生组织(World Health Organization,WHO)临时命名为2019 新型冠状病毒(2019-nCoV)[1]。该病毒随后被重命名为严重急性呼吸系统综合症冠状病毒2(SARS-CoV-2),其引起的疾病被称为2019 冠状病毒病(COVID-19)。SARS-CoV-2 主要经飞沫和接触传播,在相对密闭的环境中长时间暴露于高浓度气溶胶的情况下存在经气溶胶传播的可能[2],2020年1月20日我国将新型冠状病毒感染的肺炎纳入法定乙类传染病,并采取甲类传染病的预防、控制措施[3]。COVID-19 自湖北省武汉市暴发以来,已蔓延至全国大部分省市[4]。根据《新型冠状病毒肺炎诊疗方案(试行第七版)》,发病早期外周血白细胞总数正常或降低,淋巴细胞计数减少,病情严重时淋巴细胞数进行性减少,多数患者C反应蛋白(CRP)和红细胞沉降率升高,降钙素原正常。因疫情爆发初期感染者以中老年人和合并基础疾病患者为主,未见儿童患者,专家们曾一度认为儿童对病毒不易感[5],但随后不同地区出现多例儿童感染报道。2020年2月2日国家卫生健康委员会发布了“关于做好儿童和孕产妇新型冠状病毒感染的肺炎疫情防控工作的通知”[6],明确指出,儿童和孕产妇是SARS-CoV-2 的易感人群。由于儿童感染数量不多,其临床特点及检验数据报道相对较少,因此本文对本院1例新冠肺炎儿童患者检验结果进行梳理总结,以期为一线防疫工作提供素材。
1 材料与方法
1.1 临床资料
患儿男,1岁5月,患儿因与COVID-19确诊病例密切接触,于2月4日取咽拭子进行新型冠状病毒核酸检测呈阳性,以“新型冠状病毒感染”收入即墨市人民医院住院治疗。肺部CT(图1)显示双肺纹理清晰,左肺上叶透光度不均匀减低,右肺下叶见条片状密度增高影,边界清,专家会诊后确诊为COVID-19,于2月12日转入本院治疗。患儿自起病以来无发热、寒战、抽搐,无咳痰、喘息、憋气、气促及呼吸困难,无面色发绀,无恶心、呕吐、腹痛及腹泻,精神可,饮食、睡眠尚可,大、小便正常。本研究遵守国际协调理事会临床试验规范和赫尔辛基宣言,通过了青岛市妇女儿童医院临床研究伦理委员会的批准。
1.2 试剂与仪器
核酸提取试剂盒及及新型冠状病毒(2019-CoV)ORF1ab/N基因双重核酸检测试剂盒均来自中山大学达安基因股份公司,核酸检测仪为美国Thermo Fisher公司7500型实时荧光PCR 仪。Sysmex XN-1000 全血细胞分析仪购自日本希森美康公司,全自动CRP 分析仪购自上海奥普生物医药有限公司,呼吸道病原体谱抗体IgM 检测试剂盒(间接免疫荧光法)购自欧蒙医学实验诊断股份公司。
1.3 方法
1.3.1 标本采集
受检者标本由专业医护人员采集,及时转运至实验室检测。核酸标本检测前置于56℃灭活30 min。采集患儿静脉血2 mL 于EDTA-K2 抗凝管进行血常规及C反应蛋白检测;采集静脉血2 mL,置于含分离胶的黄头真空采血管内,静置待血液凝固,3 500×g 离心5 min,取血清进行呼吸道病原体谱检测。
1.3.2 样本检测
所有操作均按照仪器及试剂说明书进行。核酸检测采用实时荧光定量PCR(RT-PCR)技术,针对2019-nCoV基因组中开放读码框1ab(open reading frame 1ab,ORF1ab)和核壳蛋白(nucleocapsid protein,N)进行检测。如果检测样本在FAM和VIC 通道Ct值≤40,且有明显的扩增曲线,可判定样本为2019 新型冠状病毒阳性;如果样本仅在FAM 或VIC 单通道Ct值≤40,另一通道无扩增曲线,结果需复检,复检结果一致可判定样本2019新型冠状病毒阳性,复检结果阴性可判定为未检测到2019 新型冠状病毒;如果样本FAM和VIC通道无扩增曲线或Ct值>40,且Cy5 通道有扩增曲线,可判定样本未检测到2019 新型冠状病毒。
1.4 统计学分析
采用SPSS 19.0 进行数据处理。进行描述性分析。
2 结果
2.1 患儿血常规、C反应蛋白、呼吸道病原体谱结果
患儿入院以来血常规、CRP 检测结果见表1。血常规结果显示,患儿发病初期,白细胞及淋巴细胞在相对正常水平,随后淋巴细胞水平有较明显升高,CRP 结果正常。患儿住院期间分别于2月13日、25日进行呼吸道病原体(包括呼吸道合胞病毒、腺病毒、甲型流感病毒、乙型流感病毒、副流感病毒、肺炎支原体、肺炎衣原体、嗜肺军团菌)检测,两次检测均呈现甲型流感病毒、乙型流感病毒、肺炎支原体IgM 阳性反应,提示呼吸道病原体合并感染见表1。
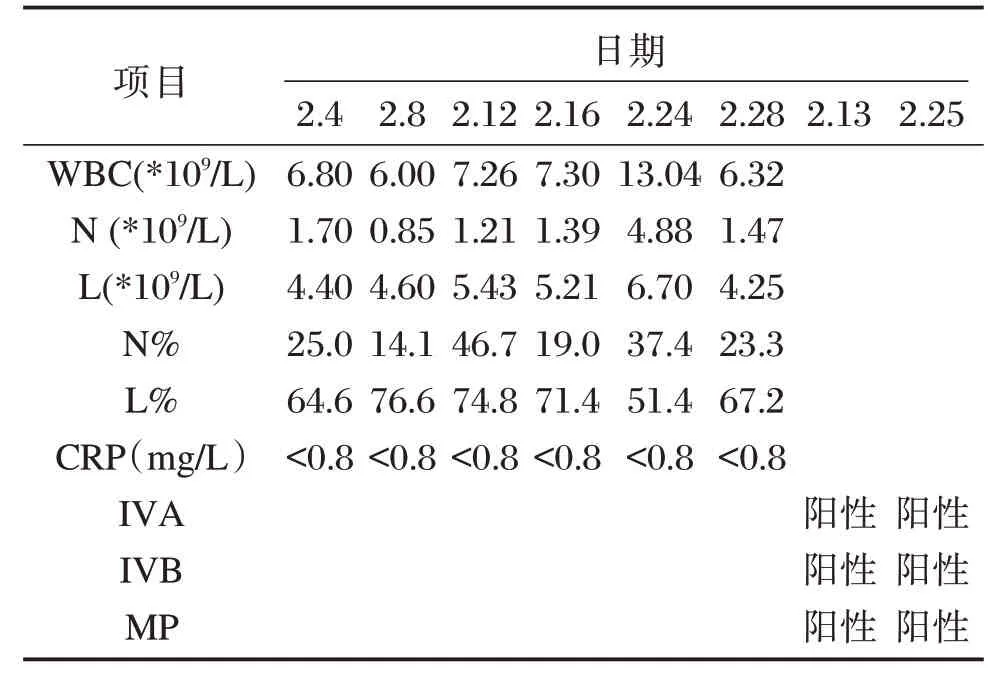
表1 患儿SARS-CoV-2 感染后临床检验结果Table1 Clinical results of children with SARS-CoV-2 infection
2.2 多样本核酸检测结果
患儿入院以来多次新型冠状病毒核酸检测结果见图2。通过实时荧光定量PCR 对患儿多样本进行新型冠状病毒核酸检测(图2),结果显示,患儿鼻拭子、咽拭子、肛拭子及粪便新型冠状病毒核酸检测均呈阳性,且在肛拭子和粪便中检出病毒核酸持续时间更长,而在其他样本中则为阴性(血液、尿液等)。
3 讨论
COVID-19 疫情在中国持续向好,国外还处于爆发大流行上升阶段,及时、正确了解新型冠状病毒相关特征是诊断及治疗的重要环节,也是疫情防控工作中的重要环节。SARS-CoV-2是继α-冠状病毒属的HCoV-229E、HCoV-NL63,β-冠状病毒属的HCoV-HKU1、MERS-CoV、SARS-CoV 之后的第七个可以感染人类的冠状病毒[7-8]。数据研究表明,SARS-CoV-2 的传播能力与SARS 冠状病毒相似,其繁殖数(reproduction number,R0)分别为1.4~5.5,2.0~5.0[9-10]。由于免疫系统不成熟,儿童是该疾病的易感人群。尽管目前儿童确诊病例数占比相对较小,但随着更多地区开展病原学检测,儿童感染病例数有增加的趋势,应予以高度重视。但现阶段相关研究报道较少,因此准确掌握检验结果动态变化对儿童病例的诊疗具有重要意义。
本文报道的确诊病例无明显发热及明显呼吸道症状,均因与确诊患者密切接触而入院就诊,通过核酸检测确诊。通过多次对患儿多样本核酸检测发现,除在鼻咽拭子中发现SARS-CoV-2 的存在,在其大便及肛拭子也检测到病毒核酸,且持续时间较长,特别是当鼻咽拭子转阴后,大便核酸阳性仍可持续1 周以上,在其他体液中(血液、眼泪)未检测到病毒核酸。根据《新型冠状病毒肺炎诊疗方案(试行第七版)》[2],新冠肺炎患者出院应连续两次呼吸道标本核酸检测阴性(采样时间至少间隔24 h),但此时患者大便病毒核酸可能依然呈阳性,存在潜在传染风险。因此患者出院后建议妥善处理其大便等分泌物,同时进行相应隔离措施,以防再次出现感染情况。进一步分析发现患儿发病初期鼻咽拭子核酸检测呈阳性,此时淋巴细胞计数处于相对正常水平;随后鼻咽拭子持续转阴,患儿淋巴细胞水平逐步升高,并维持在较高水平,直至2月18日鼻咽拭子再次阳性,其之后的血常规结果显示白细胞及淋巴细胞均有明显升高;2月28日粪便病毒核酸转阴后,淋巴细胞计数又恢复相对正常水平。上述结果分析显示,淋巴细胞水平与病毒核酸结果存在一定相关性,通过其联合检测对儿童COVID-19 诊疗效果观察具有重要意义。另外,呼吸道病原体谱检测发现,患儿甲型流感病毒、乙型流感病毒、肺炎支原体IgM 抗体持续阳性,是否SARS-CoV-2 对已感染呼吸道病原体的患者更加易感,或易与呼吸道病原体合并感染有待进一步的探讨,这为以后的研究及诊疗提供了新的方向。
由于只有1例儿童确诊病例的检测结果,存在一定局限性,希望能给临床抗疫一线提供一定的参考,期待更多的临床研究报道,为更好的诊疗、控制疫情提供基础。

