银杏叶提取物对H2O2致SH-SY5Y损伤细胞糖代谢的影响
张 徽,王淑静,袁天宇,杨 骄,代民言,张 琦,金成斌
(哈尔滨商业大学 药学院,哈尔滨 150076)
近年来,阿尔茨海默症(Alzheimer’s disease,AD)、帕金森综合征(Parkinson’s disease,PD)等神经退行性疾病的发病率逐年增高,这些疾病虽然具有不同的组织病理学特征,但可能具有共同的细胞和分子机制[1].目前认为蛋白质异常聚积、氧化应激、糖代谢障碍等均会引起神经退行性疾病[2].其中氧化应激是指体内活性氧自由基(Reactive oxygen species,ROS)和活性氮自由基(Reactive nitrogen species,RNS)的产生与清除发生失衡导致神经细胞和组织氧化损伤[3].神经元的正常活动需要提供大量的能量,脑的质量约占机体总质量的2%,但脑的耗能量约占全身总量的20%,耗糖量约占25%.氧化损伤时,过高的ROS可引起线粒体的损伤,直接影响能量生成[4].研究表明AD患者常伴随脑能量不足[5],因此推测抑制氧化应激、改善细胞糖代谢、减少神经细胞凋亡可预防和治疗神经退行性疾病.
银杏叶提取物(Ginkgobilobaextract)含有多种活性成分,具有抗氧化、抗凋亡、抗肿瘤、抑制血小板活性、改善脑血流、神经保护等多种药理作用[6].银杏叶提取物的神经保护作用已被广泛认可,文献报道其作用机制主要是与清除ROS等氧自由基、提高谷胱甘肽过氧化物酶(GSH-Px)等抗氧化酶活性、抑制脂质过氧化[7]等有关,而在糖代谢方面鲜有报道.本研究采用银杏叶提取物作用于H2O2诱导的SH-SY5Y氧化损伤细胞,以观察银杏叶提取物对SH-SY5Y氧化损伤细胞的保护作用及对糖代谢的影响,从而为银杏叶提取物的神经保护作用及机制研究提供思路.
1 材料和方法
1.1 主要材料
人神经母细胞瘤细胞(SH-SY5Y)由哈尔滨商业大学药学院保存;银杏叶提取物注射液(L1100)购自中豪国际有限公司;H2O2购自天津北联试剂;DMEM培养液、胎牛血清、胰蛋白酶购自Invitrogen公司;MTT购自Sigma公司;Anexin V试剂盒购自生工生物工程有限公司;HE试剂盒、PI染料、己糖激酶试剂盒、丙酮酸激酶试剂盒、琥珀酸脱氢酶试剂盒、苹果酸脱氢酶试剂盒及LD、ATP含量测定试剂盒均购于南京建成生物工程研究所.
1.2 方法
1.2.1 细胞培养
人神经母细胞瘤细胞(SH-SYY5)在含有10%胎牛血清及1%青链霉素的DMEM培养基中,置于37 ℃、5%CO2培养箱中培养,2~3天传代1次.
1.2.2 SH-SY5Y细胞氧化损伤模型中H2O2的浓度筛选
取对数生长期的SH-SY5Y细胞,用PBS漂洗、胰酶消化,制成单细胞悬液并调整细胞浓度为1×105个/mL.取96孔板,四周每孔加入100 μL PBS,其余每孔加细胞悬液100 μL,置于37 ℃、5%CO2培养箱中培养24 h,弃原液,实验组每孔分别加入100 μL终浓度为0.25、0.50、0.75、1.00、1.25、1.50、1.75 mmol/L的H2O2,对照组加入等量无血清DMEM培养基.每组设6个复孔,培养24 h后加10 μL MTT,继续培养4 h后加入150 μL DMSO,在490 nm波长检测吸光度(OD)值.具体方法参考文献[8].
1.2.3 银杏叶提取物给药浓度筛选
将对数生长期SH-SY5Y细胞制成单细胞悬液,调整细胞浓度为1×105个/mL,铺于96孔板.设置对照组、模型组(1.0 mmol/L H2O2)、银杏叶提取物给药组.给药组加入100 μL终浓度分别为50、100、200、400、800 μmol/L的银杏叶提取物,对照组和模型组加等量无血清DMEM培养基.每组各设6个复孔,放入5%CO2培养箱中培养4 h后,模型组、给药组分别加入100μL终浓度为1.0 mmol/L的H2O2,对照组加入等量无血清DMEM培养基,后续操作同1.2.2.
1.2.4 生长曲线法
取对数生长期的SH-SY5Y细胞制成单细胞悬液,调整浓度为1×105个/mL接种于24孔板中,每孔400 μL,37 ℃、5%CO2培养箱中培养24 h.给药组加入400 μL终浓度为100 μmol/L银杏叶提取物,对照组和模型组加入等量无血清DMEM培养基.放入培养箱中培养4 h后,模型组、给药组加入400 μL终浓度为1.0 mmol/L的H2O2,继续培养24 h.每组设置3个复孔,加入0.4%台盼蓝溶液.在光镜下多次计数取平均值,持续计数6 d,绘制生长曲线.
1.2.5 HE染色法
取对数生长期的SH-SY5Y细胞制成单细胞悬液,调整细胞浓度为1×105/mL.将消毒后的盖玻片放置于6孔板中,每孔滴加1 mL细胞悬液于盖玻片上,静置15 min,37 ℃、5%CO2培养箱中培养24 h.给药组加入1 mL终浓度为100 μmol/L银杏叶提取物,对照组和模型组加入等量无血清DMEM培养基.放入培养箱中培养4 h后,模型组、给药组加入1mL终浓度为1.0 mmol/L的H2O2.用苏木素-伊红(HE)染色、显微镜观察,具体方法参考文献[8].
1.2.6 流式细胞术检测细胞周期
取对数生长期的SH-SY5Y细胞制成单细胞悬液,调整浓度为2×105/mL.每孔加入1 mL细胞悬液于6孔板.给药组加入1 mL终浓度为100 μmol/L银杏叶提取物,对照组和模型组分别加入等量无血清DMEM培养基.放入37 ℃、5%CO2培养箱中培养4 h后,模型组、给药组加入1 mL终浓度为1.0 mmol/L的H2O2,继续培养24 h.收集细胞,细胞固定、染色、上机检测,按照试剂盒进行详细操作,采用Flowjo 10.0分析软件进行数据分析.
1.2.7 流式细胞术检测细胞凋亡(Annexin)
同1.2.6分组处理并收集细胞,1 000 r/min离心5 min,弃上清,加入10 μL标记溶液进行细胞重悬,室温避光孵育15 min.再次离心,加入荧光溶液,4 ℃冰箱避光20 min,并适当振动.过400目尼龙筛,上机检测,具体步骤按照试剂盒进行操作.采用Flowjo 10.0分析结果.
1.2.8 糖代谢相关酶活力及代谢产物含量测定
将对数生长期的SH-SY5Y细胞制成细胞悬液,调整细胞浓度为2×105个/mL,每孔1 mL接种于6孔板中,置37 ℃、5%CO2培养箱中培养24 h.给药组加入1 mL终浓度为100 μmol/L的银杏叶提取物,对照组和模型组加入等体积的无血清DMEM培养液.放入37 ℃、5%CO2培养箱中培养4 h后,模型组、给药组加入1mL终浓度为1.0 mmol/L的H2O2,继续培养24 h.收集细胞,2 000 r/min离心5 min,弃去上清液.0.9%生理盐水重悬细胞2次,将样品置于超声波细胞粉碎机粉碎.ATP样品加入300 μL热双蒸水,沸水浴中匀浆破碎后继续加热10 min,将悬液取出继续漩涡混匀.取一部分样品用于测定样品含蛋白量,其余样品按照试剂盒操作测定HK、PK、SDH、MDH的酶活力及含LD和ATP的量.具体方法参考文献[8].
1.2.9 统计方法
2 实验结果
2.1 H2O2制备氧化损伤细胞模型浓度的筛选
MTT结果显示,H2O2可明显抑制细胞增殖.随H2O2浓度的升高,对SH-SY5Y细胞的增殖抑制作用逐渐增强,梯度变化明显,具有明显的浓度依赖性.测得IC50值为1.13 mmol/L,H2O2的浓度为1.0 mmol/L时抑制率为39.14%,1.25 mmol/L 时抑制率为87.37%.结合IC50值和实验数据,选定1.0 mmol/L的H2O2为SH-SY5Y氧化损伤细胞的造模浓度.见表1.
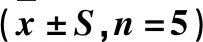
表1 不同浓度H2O2对SH-SY5Y细胞活性的影响
2.2 银杏叶提取物给药浓度的筛选
根据MTT结果,模型组细胞抑制率为39.14%.给药组与模型组相比,随银杏叶提取物浓度的升高,SH-SY5Y损伤细胞的抑制作用逐渐降低.根据多次MTT预实验结果,银杏叶提取物终浓度为100 μmol/L时抑制率为11.15%,200 μmol/L抑制率为10.78%.100 μmol/L相对于200 μmol/L的给药浓度低但作用效果接近,因此选定100 μmol/L为银杏叶提取物的给药浓度,并用于后续实验.见表2.
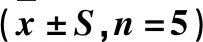
表2 不同浓度的银杏叶提取物对H2O2诱导SH-SY5Y损伤细胞的影响
2.3 生长曲线法检测细胞生长情况
如图1所示,对照组SH-SY5Y细胞在第3天细胞数达到峰值.模型组在第2天细胞数达到峰值,与对照组相比模型组细胞数减少.银杏叶提取物给药组细胞数始终高于模型组,与对照组生长趋势相近,在第4天给药组与对照组细胞浓度接近.推测银杏叶提取物可以促进细胞增殖,同MTT实验结果一致.
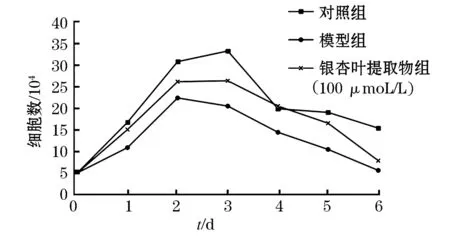
图1 银杏叶提取物作用H2O2诱导SH-SY5Y损伤细胞的生长曲线
2.4 HE染色法观察细胞形态变化
如图2所示,与对照相比,模型组SH-SY5Y细胞数量明显减少,细胞形态改变明显且不规则、细胞核颜色加深、胞质凝集.银杏叶提取物给药组与模型组相比,细胞数量较多、细胞形态改变较小,细胞数量和形态与对照组细胞更接近.
2.5 流式检测细胞周期结果
采用流式细胞仪PI单染法检测细胞周期.结果如图3、4所示,与对照组相比,模型组G0/G1与G2/M期百分率显著下降(P<0.01),S期百分率略有升高.与模型组相比,银杏叶提取物给药组G0/G1期和G2/M期百分率显著升高(P<0.01,P<0.05).因此推测银杏叶提取物可改善H2O2所致SH-SY5Y损伤细胞的周期.
2.6 流式检测细胞凋亡结果
如图5所示结果,模型组SH-SY5Y细胞凋亡率为36.1%,与对照相比,细胞凋亡率明显升高(P<0.01).银杏叶提取物给药组细胞凋亡率为6.35%,与模型组相比,细胞凋亡率显著降低(P<0.01).银杏叶提取物可降低H2O2所致SH-SY5Y损伤细胞的凋亡率.

图2 银杏叶提取物作用H2O2诱导SH-SY5Y损伤细胞的HE染色结果(40×10)
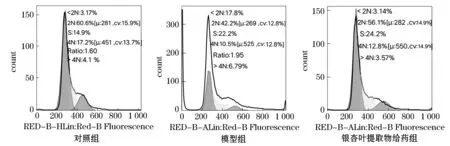
图3 银杏叶提取物作用H2O2诱导SH-SY5Y损伤细胞流式检测细胞周期结果
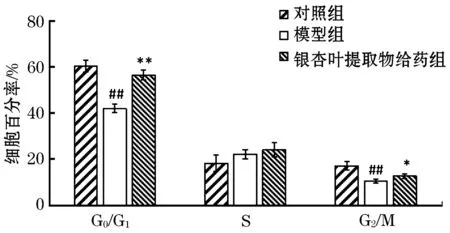
注:与对照组相比,##P<0.01,#P<0.05;与模型组相比,**P<0.01,*P<0.05
2.7 糖代谢相关酶活力检测结果
在糖代谢的过程中,HK、PK是糖酵解的第一个和最后一个关键酶,SDH、MDH属于三羧酸循环中的酶,其催化反应脱下的氢可直接进入氧化磷酸化产能过程.如表3所示,与对照组相比,模型组HK、PK、SDH、MDH的活力值均明显减低(P<0.01),说明H2O2影响了SH-SY5Y细胞糖酵解和有氧氧化过程.与模型组相比,银杏叶提取物给药组HK、PK、SDH、MDH的活力明显增高(P<0.01),因此推测银杏叶提取物可通过提高两种产能途径相关酶活力改善SH-SY5Y损伤细胞的糖代谢过程.
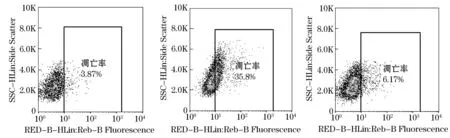
图5 银杏叶提取物作用H2O2诱导SH-SY5Y损伤细胞流式检测细胞凋亡结果
表3 银杏叶提取物对H2O2诱导SH-SY5Y损伤细胞糖代谢酶活力的影响
注:与对照组相比,##P<0.01,#P<0.05;与模型组相比,**P<0.01,*P<0.05
2.8 对糖代谢产物影响结果
LD是糖酵解的最终产物,影响细胞周围的酸性环境.ATP是能量的利用和贮存中心,关系到细胞的增殖、转移、转化等各种生理功能.如表4所示,与对照组比较,模型组细胞含LD和ATP量显著减低(P<0.01).与模型组相比,银杏叶提取物给药组含LD和ATP量明显增加(P<0.01),说明H2O2通过减少糖酵解和有氧氧化过程中LD和ATP的量进而影响能量生成,而银杏叶提取物可增加SH-SY5Y损伤细胞含LD和ATP的量.
表4 银杏叶提取物对H2O2诱导SH-SY5Y损伤细胞含糖代谢产物量的影响
注:与对照组相比,##P<0.01,#P<0.05;与模型组相比,**P<0.01,*P<0.05
3 讨 论
随着人口老龄化速度的加剧,神经退行性疾病严重威胁人类的健康[9].氧化应激被认为是引起神经退行性疾病的重要因素之一.当细胞积累某些过量的活性物质时,氧化和抗氧化动态平衡会被破坏,产生氧化损伤,其中H2O2是活性物质之一[10].由于H2O2易透过细胞膜而引起氧化应激反应,多用于构建氧化应激导致神经损伤的体外细胞模型.在正常条件下,葡萄糖是脑组织的唯一能源,并且脑细胞中含有完整的糖酵解酶系.研究发现,脑是机体糖代谢最旺盛的器官,因此充足的氧和能量供应是维持脑正常生理功能的重要条件[11].若糖代谢紊乱,将会影响神经细胞正常的生理功能以及神经细胞周围的微环境[12].很多文献报道银杏叶提取物通过降低脑组织活性氧含量、提高抗氧化酶的活性来改善氧化应激造成的神经损伤[13],ROS与线粒体的能量生成和细胞凋亡等生理活动密切相关[14].但银杏叶提取物是否会通过影响脑的糖代谢、增加脑的能量生成等途径来达到治疗神经退行性疾病的目的,其相关实验还鲜有报道.
为了探究银杏叶提取物对H2O2所致SH-SY5Y损伤细胞活性的影响,本实验选用H2O2造模,MTT结果显示随H2O2浓度的升高,对SH-SY5Y细胞的增殖抑制作用逐渐增强,具有明显的浓度依赖性.测得IC50值为1.13 mmol/L,当H2O2浓度为1.0 mmol/L时抑制率为39.14%,当H2O2浓度为1.25 mmol/L时抑制率为87.37%.结合IC50值和实验数据,最终选定1.0 mmol/LH2O2为SH-SY5Y细胞氧化损伤造的模浓度.在筛选银杏叶提取物最终给药浓度时,与模型组相比,随银杏叶提取物浓度的升高,SH-SY5Y损伤细胞的抑制作用逐渐降低.当银杏叶提取物终浓度为100 μmol/L时抑制率为11.15%,200 μmol/L时抑制率为10.78%.100 μmol/L比200 μmol/L的给药浓度低,但作用效果接近,因此选定100 μmol/L为最终给药浓度,并用于后续实验.
生长曲线法显示银杏叶提取物可保护H2O2损伤的SH-SY5Y细胞,且具有时间依赖性.与模型组相比,银杏叶提取物给药组细胞数量明显增多,且与对照组生长趋势相近,在第4天时给药组与对照组细胞浓度接近.流式细胞仪PI单染检测细胞周期的结果显示,与模型组比,银杏叶提取物给药组在G0/G1期和G2/M期百分率显著升高(P<0.01,P<0.05).因此推测银杏叶提取物能提高H2O2所致SH-SY5Y损伤细胞的增殖活性.
细胞凋亡是导致AD患者神经元减少以及认知功能障碍的重要原因[15],本实验采用Anexin V单染法检测凋亡活性,模型组细胞的凋亡率为36.1%,银杏叶提取物给药组细胞凋亡率为6.35%.与模型组相比,细胞凋亡率显著降低(P<0.01).由此推断银杏叶提取物可抑制SH-SY5Y损伤细胞的凋亡.HE染色结果显示,模型组细胞数明显减少,形态不规则、细胞核颜色加深、细胞质凝集.而银杏叶提取物给药组与模型组相比,细胞数目增多,形态趋于对照组,说明银杏叶提取物可改善H2O2诱导的SH-SY5Y损伤细胞的形态.
为了进一步探究银杏叶提取物对SH-SY5Y损伤细胞糖代谢的影响,本实验采用了分光光度试剂盒检测了糖代谢相关酶活力和糖代谢产物的含量.其中HK、PK是糖酵解途径的关键酶,其活力高低决定糖酵解的速度和方向.SDH是唯一存在于线粒体内膜上的酶,其活性可直接反映线粒体功能.SDH、MDH是三羧酸循环中的脱氢酶,其脱下的氢可以进入呼吸链的氧化磷酸化过程并产生ATP,其活力可测定三羧酸循环运转效率.乳酸是糖酵解代谢终产物,ATP为所有细胞能量代谢的终产物,反映总体能量供应情况.实验结果显示,模型组HK、PK、SDH、MDH的酶活力、含LD和ATP的量均明显降低,推测H2O2可抑制SH-SY5Y糖酵解、三羧酸循环和氧化磷酸化过程,破坏细胞线粒体功能,抑制产能并最终造成细胞损伤.而经银杏叶提取物预处理后,HK、PK、SDH、MDH的酶活力和能量代谢产物含LD、ATP的量明显增加,推测银杏叶提取物可通调节糖代谢相关酶活力、增加含LD和ATP的量来保护H2O2诱导的SH-SY5Y损伤细胞.
综上所述,推测银杏叶提取物可以通过提高糖代谢相关酶HK、PK、SDH、MDH的活力和增加代谢产物LD和ATP的含量促进H2O2诱导SH-SY5Y氧化损伤细胞的增殖,抑制其凋亡,进而达到神经保护作用.对神经退行性疾病的发病机制、临床治疗具有一定的指导意义,同时也对银杏叶提取物的临床应用及作用机制研究提供了新的思路.

