奶粉中沙门氏菌检测能力验证结果与分析
柴洪艳 乔璐 陈亮
沙门氏菌在自然界中广泛存在,易污染水源、食品等,短时间大量增殖[1,2]。沙门氏菌是北京市乃至全国食源性疾病的主要致病菌之一。可致败血症和肠炎等[3],对人们身体健康造成危害。能力验证是保证检测质量必要手段,可以用来评估检测能力[4,5]。2017年底,全国共431个实验室参加了“2017年国家食品安全风险监测网微生物质量控制考核暨2017年国家认监委能力验证计划C类项目-食源性沙门菌检验分型”。北京铁路疾病预防控制中心实验室也参与了该项目,共接到3份奶粉样品,编号分别为2017S-01(002)-1;2017S-01(002)-2;2017S-01(002)-3,并对3份样品进行了沙门氏菌检测且完成血清学分型。现将结果报道如下。
1 材料与方法
1.1 设备 低温恒温培养箱(日本SANYO公司)、VITEK2全自动微生物鉴定系统(法国梅里埃公司)、生物安全柜(美国LABCONCO公司)。
1.2 培养基及试剂 缓冲蛋白胨水(BPW)、四硫磺酸钠煌绿(TTB)增菌液、亚硒酸盐胱氨酸(SC)增菌液、亚硫酸铋(BS)琼脂、沙门氏菌显色培养基、营养琼脂等均购自北京君立康科技发展有限责任公司和陆桥技术有限责任公司;VITEK 2 GN鉴定卡购自生物梅里埃公司;沙门氏菌诊断血清购自宁波天润生物药业。所有培养基和试剂均在有效期内使用。
1.3 方法
1.3.1 样品处理:根据此次考核检测要求,将装有冻干菌的西林瓶于室温下放置15 min复温;无菌操作打开西林瓶,加入1 mL缓冲蛋白胨水(BPW)溶液进行复溶,室温静置3 min;充分混悬西林瓶内容物,静置30 s,以消除产生的泡沫。
1.3.2 预增菌和增菌:将上述溶液转移至含有220 mL灭菌BPW的样品均质袋中,再用灭菌BPW充分洗涤西林瓶内壁4次,每次1 mL,洗涤合并到样品均质袋中;向样品均质袋中分别加入相应编号样品基质袋中的基质,振荡混匀后,按照GB 4789.4-2016 36℃预增18 h[6];低温恒温培养箱中取出轻轻摇动培养过的样品混合物,移取1mL转种于TTB内,于(42±1)℃培养24 h。同时,另取1 mL转种于SC内,于36℃分别培养24 h。
1.3.3 分离:使用一次性接种环分别取增菌液1环,分别划线接种于BS琼脂平板和沙门氏菌显色培养基,BS琼脂平板36℃培养48 h,沙门氏菌显色培养基36℃培养24 h。
1.3.4 生化试验:自选择琼脂平板上分别挑取3~5个可疑菌落接种三糖铁琼脂。同时接种营养琼脂平板36℃培养24 h。选取营养琼脂平板上的纯菌落,按VITEK2全自动微生物鉴定系统的要求进行上机鉴定。
1.3.5 血清学鉴定:将VITEK2全自动微生物鉴定系统和三糖铁结果符合沙门氏菌的菌落进行血清凝集实验。首先进行生理盐水对照,如不凝集再进行多价菌体抗原(O)和多价鞭毛抗原(H)抗血清的凝集。
1.3.6 结果判定:根据选择性培养基菌落特征、三糖铁初步生化结果和VITEK2全自动微生物系统生化鉴定结果以及血清凝集情况进行综合判定。
2 结果
2.1 分离菌落形态特征 三份奶粉样品在不同培养基上菌落形态特征不同,其中2017S-01(002)-2在BS、沙门氏菌显色培养基、营养琼脂上均无菌落生长;而2017S-01(002)-1和2017S-01(002)-3均表现为有菌落生长,且特征与沙门氏菌的生长特征基本相符合(表1),2017S-01(002)-2未检出沙门氏菌。
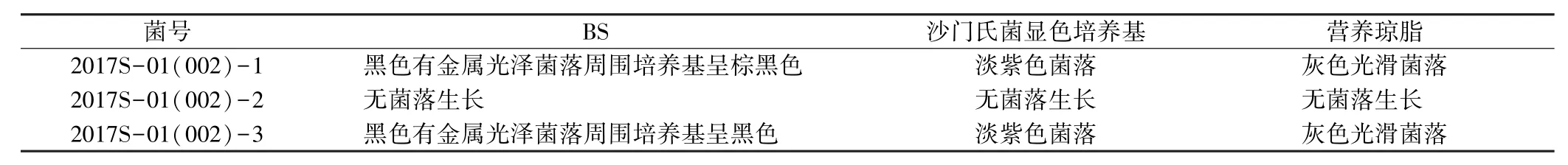
表1 分离菌落形态特征
2.2 三糖铁反应结果 2017S-01(002)-1考核样品产酸产碱,产气产硫化氢,而2017S-01(002)-3考核样品产酸产碱,不产气产硫化氢(表2)。
2.3 系统生化鉴定结果 取营养琼脂平板上的纯菌落进行上机鉴定,其中2017S-01(002)-1和2017S-01(002)-3的VITEK2生化结果见表3和4。

表2 考核样品在三糖铁反应结果
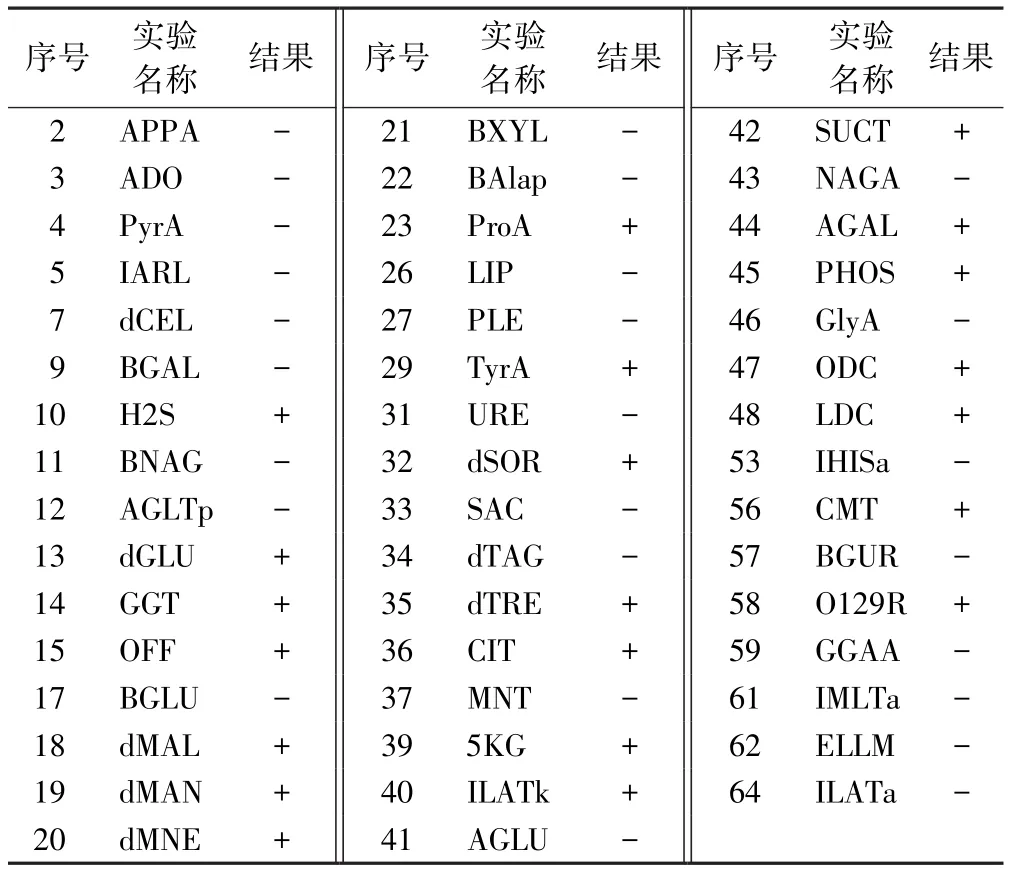
表3 2017S-01(002)-1样品VITEK2生化结果
2.4 生化鉴定结果 从VITEK2全自动微生物鉴定系统生化鉴定结果看出,其中2017S-01(002)-1鉴定为肠炎沙门菌血清型,2017S-01(002)-3被鉴定为沙门菌群,且符合率均较高,分别为98%和99%。
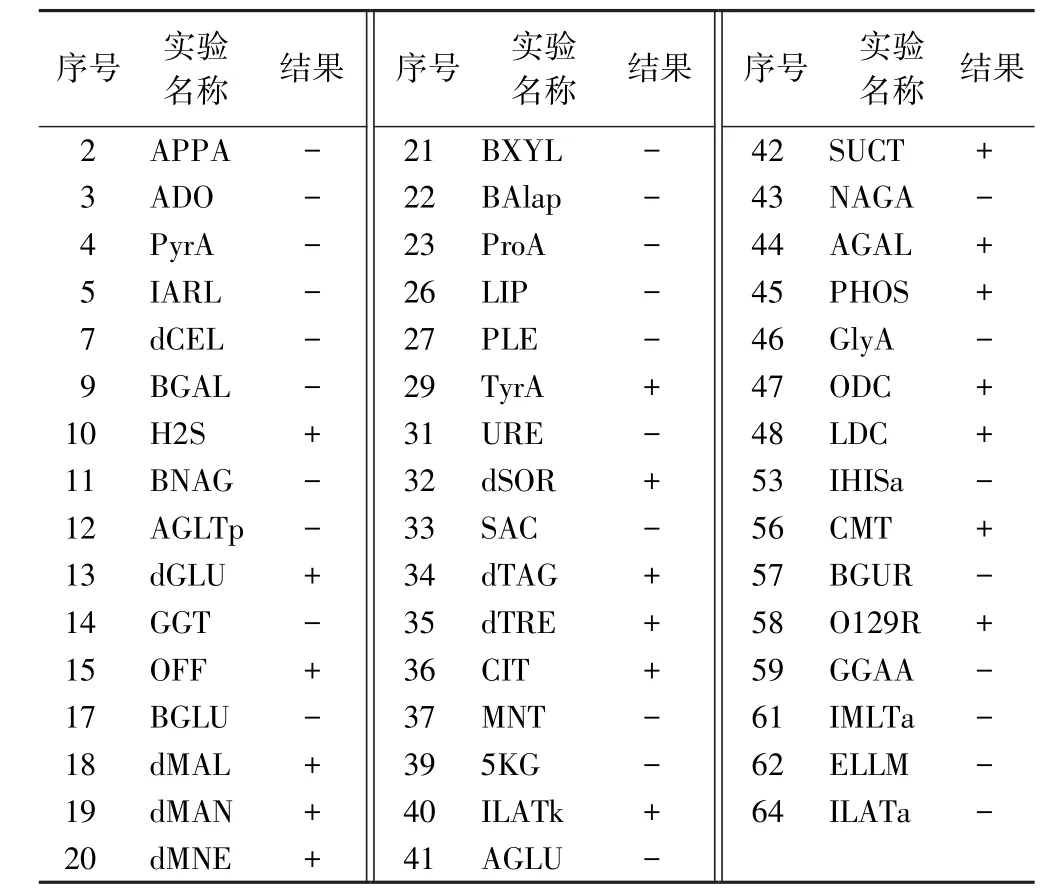
表4 样品2017S-01(002)-3 VITEK2生化结果
2.5 血清凝集实验结果 2017S-01(002)-1和2017S-01(002)-3血清凝集情况不同,生理盐水均不凝集,其中2017S-01(002)-1菌体抗原O4,12、O9,12、O9均凝集,O4 不凝集;鞭毛抗原 Hg、Hm、H1,v、H7均凝集,Hv不凝集。其中2017S-01(002)-1菌鞭毛抗原第二相在初始凝集时不凝集,故作了诱导实验。用已知的第一相血清做H抗原第二相的诱导凝集试验,最后第二相凝集。2017S-01(002)-3菌体抗原 O4、O5、O27、O4,12、O9,12 均凝集,O9 不凝集;鞭毛抗原 Hd、H1,v、H1,2,3,5、H2 均凝集,Hv、H5 不凝集(表5)。

表5 血清凝集情况
2.6 鉴定结果 根据选择性培养基、三糖铁和VITEK2全自动微生物系统生化鉴定结果以及血清凝集情况综合判定为2017S-01(002)-2未检出沙门氏菌。 2017S-01(002)-1、2017S-01(002)-3盲样分别为检出肠炎沙门氏菌、检出斯坦利沙门氏菌。
3 讨论
3.1 通过能力验证可以提高实验室检测水平,确保结果的准确性,同时发现检测问题,及时改进纠正[7,8]。沙门菌属血清型别较多,对检测人员技术水平和经验有较高的要求[9]。此次能力验证三份奶粉样品检测准确率达100%,与指定菌一致,能力验证结果满意,验证了实验室沙门氏菌的检验能力。
3.2 此次沙门氏菌能力验证表明,在打开样品进行初步分离时,必须按能力验证要求操作,这与相关报道一致[10]。首先在室温放置几分钟,其次加入的初次增菌液的次数按要求加入,且反复吹打,尽量使西林瓶内的所有细菌都洗脱下来,有时能力验证所含细菌量少,如果不按此步操作,很容易造成细菌漏检。
3.3 GB4789.4-2016 5.3中要求划线接种BS平板和XLD平板(或HE平板或沙门显色培养基),3种平板可以自选其一。沙门氏菌显色培养基菌落特征明显,容易识别[11],可直接对菌落进行初筛[12,13]。使检测者根据颜色特征能初步判定结果方向,可基本排除与沙门氏菌属特征相近的其他细菌,提高检测效率。此次能力验证试验提示沙门氏菌显色培养基优于XLD和HE培养基。
3.4 此次能力验证中,2017S-01(002)-1号奶粉样本通过VITEK2全自动微生物鉴定系统鉴定为肠炎沙门菌血清型,但在实际工作中必须按照国标方法要求进行血清凝集试验,综合菌落特征、三糖铁、生化结果才能最终判定检验结果。
3.5 沙门氏菌血清凝集时难点在H抗原的第二相诱导[14],此次沙门氏菌的能力验证,在血清凝集部分,做了诱导试验。传统的方法是使用琼脂粉,用水溶解后再高压灭菌,制成平板或U型管,且每次需要现用现配,过程繁琐。本次能力验证为了适应实际需要,改进了原有的半固体琼脂的配制方法,将储备的营养琼脂和营养肉汤煮沸冷却至50℃左右,使用无菌大试管,分别加入4 mL、5 mL、6 mL营养琼脂,再加入营养肉汤至20 mL,制成不同浓度的半固体琼脂溶液,倒入平板,凝固后进行诱导试验,此次能力验证菌株在加入6 mL营养琼脂的比例浓度中诱导情况最好。此方法不仅简单便于操作,更能根据不同沙门氏菌的菌株特点,多制备几个浓度,以免半固体琼脂平板太软或太硬影响凝集效果,能够尽可能早出具检测报告。另外要从蔓延生长的菌苔边缘挑取菌落凝集[15],否则影响凝集效果。

