维生素B12对氧化应激损伤下神经细胞的保护机制
叶璐霞,徐莉菲,薛榆洁,童鹤艳,何逸昉,李校堃
(温州医科大学 药学院,浙江 温州 325035)
创伤性脑损伤是指暴力造成的脑实质损伤,并引起感觉、运动功能障碍[1],甚至脑死亡等严重后果,具有较高病死率及致残率。创伤性脑损伤后的继发性损伤是这几年的研究热点,其中氧化应激是继发性脑损伤的重要环节之一[2]。维生素B12,作为叶酸中的辅酶,在神经系统发育过程中起着重要作用[3]。研究发现维生素B12的缺乏将导致蛋氨酸和S-腺苷蛋氨酸的合成障碍[4]。临床上维生素B12广泛用于治疗周围神经损伤修复,或与其他药物联合使用治疗其他神经疾病等[5]。另外,最近有报道发现维生素B12能够清除超氧化物来促进神经轴突再生情况[6]。本研究通过PC12细胞运用H2O2模型来模拟脑创伤后的氧化应激损伤,探讨维生素B12对氧化应激损伤神经细胞的保护作用。
1 材料和方法
1.1 材料
1.1.1 细胞处理及分组:高分化鼠嗜铬细胞瘤细胞(PC12)购自中科院上海细胞中心。细胞培养基为RPMI 1640添加10% FBS,以及100 U/mL青霉素和100 U/mL链霉素,培养环境为37 ℃,5% CO2。细胞长满后,进行细胞铺板,待细胞长到80%~90%后,将细胞分为对照组(Control),损伤组(H2O2),维生素B12保护组(H2O2+VitB12)。H2O2组采用200 μmol/L 的H2O2刺激,H2O2+VitB12组提前2 h给予维生素B12(200 μmol/L)预处理,以30 min作为时间间隔观察细胞形态变化,待大量细胞发生形态改变时再进行后续实验。
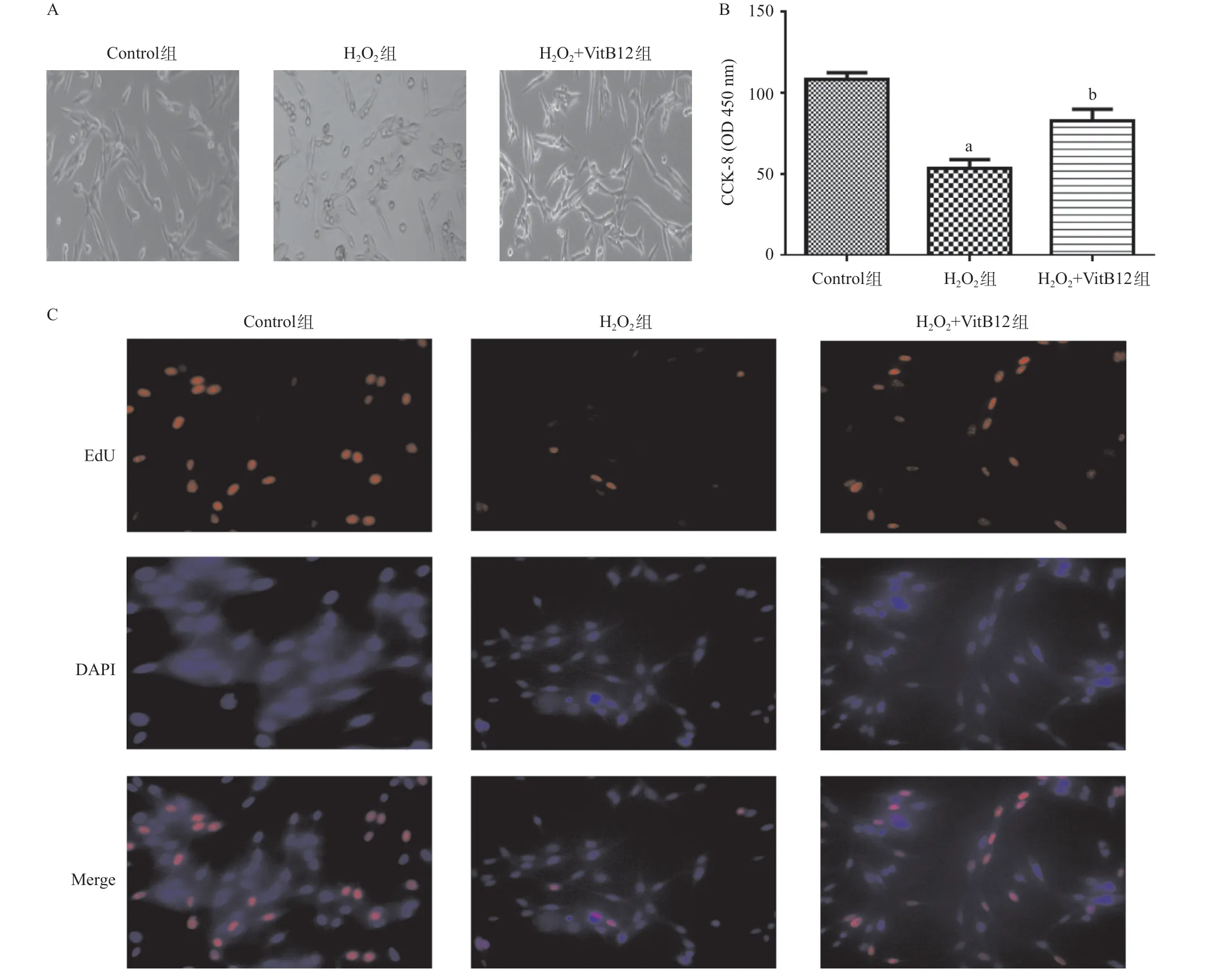
图1 3组PC12细胞的形态、细胞增殖能力和DNA复制水平比较
1.1.2 药品及试剂:EdU染色试剂盒购自广州市锐博生物科技有限公司,Bcl-2、Bax和P62、ATG-5、LC3等一抗和二抗购于英国Abcam公司。
1.2 方法
1.2.1 细胞生存率实验:细胞长满后,加入维生素B12提前预保护2 h,然后加入200 μmol/L H2O2诱导损伤,一段时间后倒掉培养基,加入含CCK-8的无血清培养基,1~4 h后用酶标仪OD 450 nm检测细胞活性。
1.2.2 细胞损伤情况检测:细胞处理后,用倒置显微镜观察细胞形态;或加入稀释好的EdU溶液,孵育2 h,然后细胞固化,再加入1×Apollo®染色反应液,避光、室温条件下,在脱色摇床孵育30 min 后,弃染色反应液,然后加入100 μL渗透剂(0.5% TritonX-100的PBS)在脱色摇床上清洗2~3次,每次10 min,弃渗透剂,然后加入hoechst33342反应液,最后荧光显微镜检测。
1.2.3 Western blot及免疫荧光检测:细胞处理 后,加入裂解液,提取蛋白,然后蛋白定量,制胶,电泳,转膜,牛奶封闭2 h,用PBST洗膜3次,每次 7 min,一抗孵育过夜,用PBST洗膜3 次,每次 7 min,二抗孵育2 h,用PBST洗膜3次,每次7 min,最后曝光;或细胞固定后,加入渗透剂,然后封闭,加入一抗孵育过夜,用PBST洗脱3次,每次5 min,避光加入荧光二抗孵育1 h,用PBST洗脱3次,每次5 min,避光加DAPI,封片,然后荧光显微镜检测。
1.3 统计学处理方法 采用GraphPad Prism软件进行数据分析。计量资料用 ±s表示,多组间比较采用单因素方差分析,组间两两比较用LSD-t 法。P<0.05为差异有统计学意义。
2 结果
2.1 3组PC12细胞形态、细胞增殖能力和DNA复制水平比较 与Control组比,H202组的PC12细胞形态为圆形,H202+VitB12组的PC12细胞形态更加饱满,见图1A。与Control组比,H202组的PC12细胞增殖能力较低,差异有统计学意义(P<0.01);与H202组比,H202+VitB12组的PC12细胞增殖能力较高,差异有统计学意义(P<0.01),见图1B。与Control组比,H202组的PC12细胞中DNA复制水平较低,与H202组比,H202+VitB12组的PC12细胞中的DNA复制水平上升,见图1C。
2.2 3 组PC12 细胞凋亡蛋白表达水平比较 与Control组比,H202组的Bax蛋白表达量显著上升,Bcl-2 的蛋白表达量显著下降,差异有统计学意义(均P<0.01);与H202组比,H202+VitB12组Bax蛋白的表达下降,Bcl-2的蛋白表达量上升,差异有统计学意义(P<0.05),见图2。
2.3 3组自噬蛋白水平比较 与Control组比,H202组的ATG-5和LC3的蛋白表达量上升,P62的蛋白表达量下降,差异有统计学意义(均P <0.05);与H202组比,H202+VitB12组ATG-5和LC3的蛋白表达量降低,P62蛋白表达量升高,差异有统计学意义(均P<0.05)。与Control组比,H202组的LC3荧光强度显著上升;与H202组比,H202+VitB12组的LC3荧光强度下降。见图3。
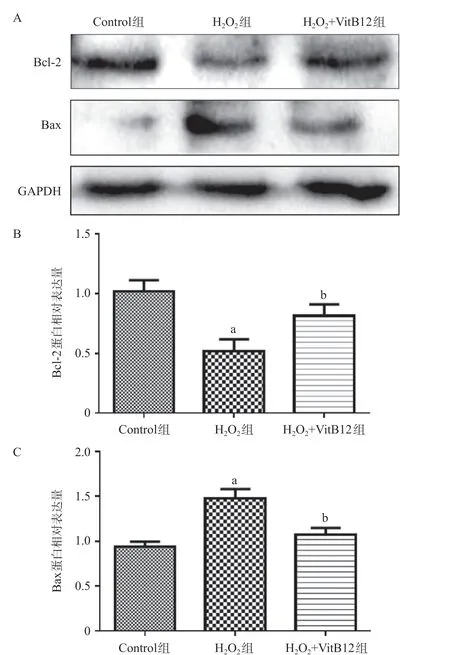
图2 3组PC12细胞Bcl-2、Bax蛋白表达水平比较
3 讨论
创伤性脑损伤的病理机制非常复杂,分为原发性损伤和继发性损伤[4,7]。继发性损伤是指血脑屏障开放后造成继发神经元凋亡[16],其中氧化应激诱导是重要机制之一[2]。因此本研究采用PC12细胞模拟神经元,通过H202刺激构建氧化应激模型,来模拟脑创伤后的神经细胞的损伤。维生素B12是临床常用的治疗神经疾病的药物,主要治疗神经痛、末梢神经炎及周围神经病变等[9,17],被认为具有显著修复神经的作用[8],然而维生素B12用于治疗脑创伤后的神经损伤修复目前鲜见报道。
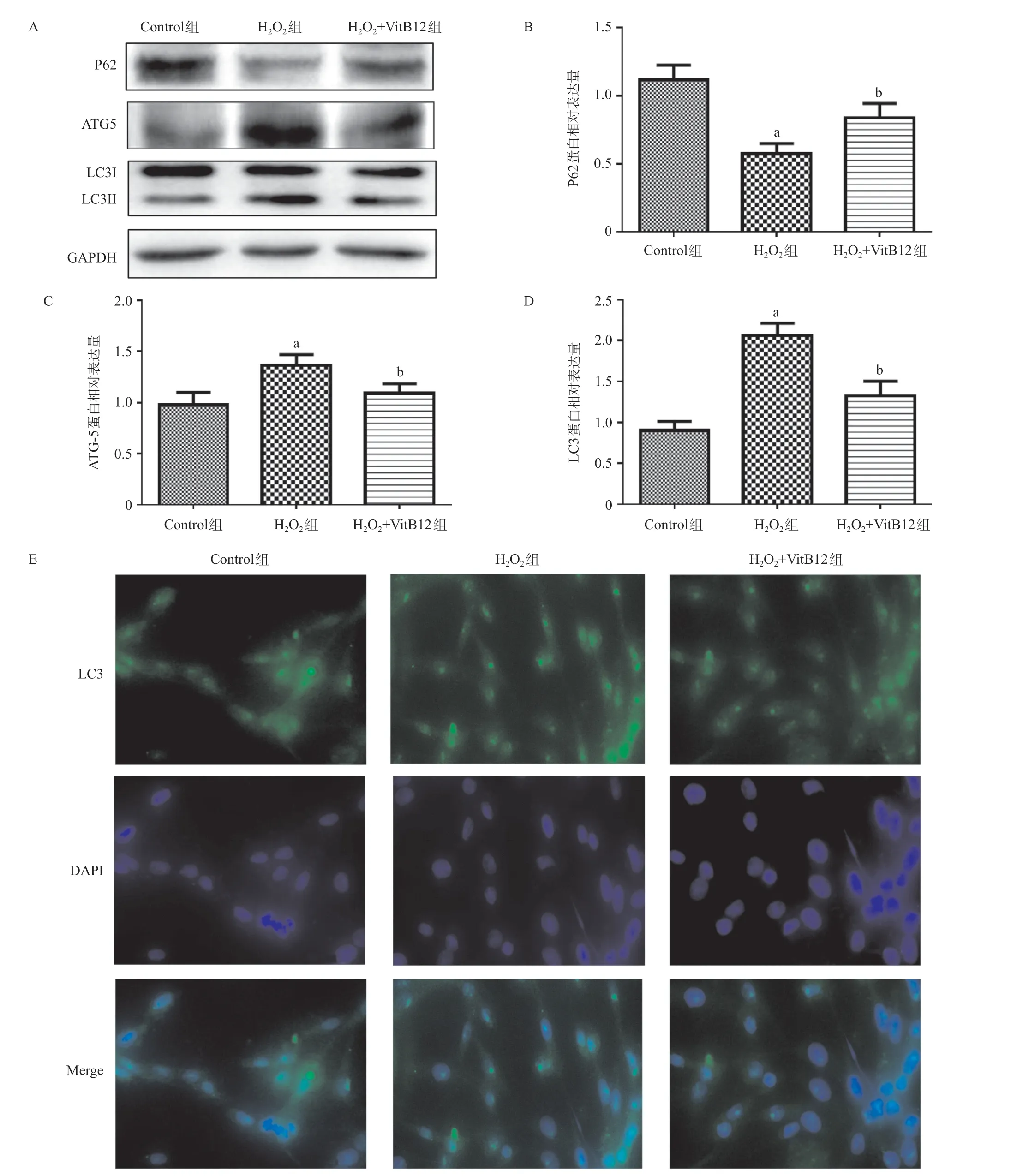
图3 3组PC12细胞P62、ATG-5、LC3蛋白表达水平比较
细胞凋亡是细胞在一定的生理或病理条件下,受多种基因精确调控的主动的、程序化的死亡过程,是机体重要的自稳调节机制[12]。在众多的凋亡调控基因中,Bcl-2 蛋白家族和胱天蛋白酶(Caspase)家族目前最受关注[13],其中Bcl-2基因和Bax基因是目前已知的在凋亡调控过程中功能相互对立的一对最重要的调控基因。结果发现受氧化应激的细胞表现出Bax蛋白表达量上升,Bcl-2下降,而维生素B12能减弱Bax蛋白表达量的上升和Bcl-2的下降,这提示维生素B12能够有效减少损伤后凋亡信号的激活从而保护PC12细胞。细胞自噬也参与了多种疾病的发生和发展,自噬与凋亡之间存在着复杂的交互调控,自噬本身也会诱发细胞死 亡[15]。本研究发现,H202处理后神经细胞中的自噬相关蛋白均被显著激活。Western blot结果表示,损伤组的LC3、ATG-5的蛋白表达明显上升,而维生素B12预保护能降低自噬相关蛋白的表达。免疫荧光结果同样证实了H202诱导后LC3呈点状分布在细胞质基质中,维生素B12预处理后能够减少胞浆中的LC3激活。这些结果提示维生素B12能够抑制氧化应激后的自噬水平升高,是保护神经细胞的另一重要原因。EdU是一种胸腺嘧啶核苷类似物,能够在细胞增殖时期代替胸腺嘧啶渗入正在复制的DNA分子中,它能有效反映DNA复制活性[11]。通过EdU染色结果可以发现,H202处理后发现,处于复制期的DNA数目较少,而维生素B12预保护后能有效提高神经细胞DNA复制水平。这进一步提示维生素B12能够改善氧化应激造成的细胞损伤。
本研究显示维生素B12能有效抑制氧化应激诱导的神经损伤,抑制H202对细胞凋亡的影响,进一步机制研究提示维生素B12通过调控自噬来抑制凋亡信号激活从而保护神经细胞。本研究在信号通路方面的研究还不够完善,比如自噬激活剂或抑制剂对神经细胞的影响的作用,有待于深入探讨。

