低免疫原性脱细胞神经基质的制备及其理化性能
王建英,李芳红,李花琼,王荣华,王辰飞,赵子建,
(1.温州医科大学 眼视光学院 生物医学工程学院,浙江 温州 325035;2.广东工业大学 生物医药学院,广东 广州 510006)
外周神经损伤会导致感觉和运动功能的永久性损害和神经性疼痛,使患者的生活质量下降,给患者和社会带来巨大的经济负担[1-2]。现有的神经移植物存在来源有限、疾病传播、免疫排斥等问题。目前,因异种(猪)神经与人神经有着极其相似的解剖结构,为再生轴突提供指导和支持,是一种潜在的神经移植物[3],异种脱细胞神经基质已成为用于修复较长神经缺损的移植物研究热点。本研究以α-1,3-半乳糖苷转移酶基因敲除(α-1,3-galactoside transferase gene knockout,GTKO)猪坐骨神经为实验原料,采用自主设计的低渗溶液、胰蛋白酶、低浓度去垢剂及核酸酶组合的四联脱细胞方案,制备低免疫原性异种脱细胞神经基质,检验脱细胞效果并尝试建立一套完整的神经脱细胞方案,探索低免疫原性脱细胞神经基质用于修复长距离外周神经缺损的可行性。
1 材料和方法
1.1 材料
1.1.1 主要试剂:PBS、枸橼酸盐修复液、DAB显色试剂盒(ZLI-9001)、兔SP试剂盒(SP-9001)、小鼠SP试剂盒(SP-9002)购自北京中杉金桥生物技术有限公司;SDS、2.5%戊二醛购自上海阿拉丁公司;胰蛋白酶、醋酸异戊酯购自上海麦克林公司。DNA酶、RNA酶为美国Sigma公司产品。HE染色试剂盒购自上海生工生物工程股份有限公司。Triton-X100、DAPI染液、天狼猩红染液购自北京索莱宝科技有限公司。胶原检测试剂盒SircolTMsoluble collagen assay(S1000)购自英国Biocolor公司。抗I型胶原抗体(ab34710)、抗层黏连蛋白抗体(ab11575)、抗纤连蛋白抗体(ab6328)购自英国Abcam公司。抗agal抗体(I21412)、DNA提取试剂盒Residual DNA Sample Preparation Kit(4413686)、DNA检测试剂盒Quant-iTTMPicoGreen dsDNA Reagent and Kits(P11496)购自美国Thermo公司。小鼠成纤维细胞系(L929)购自中国科学院上海生命科学研究院细胞资源中心。
1.1.2 主要仪器:Milli-Q超纯水仪(美国Millipore公司),DM 500型光学显微镜、DM 2500 LED型正置荧光显微镜(德国Leica公司),KD-BM型生物组织包埋机、KD2260型切片机(金华科迪仪器设备公司),LGJ-10型真空冷冻干燥机(北京华兴科技发展有限公司),*/SU8220场发射扫描电子显微镜(日本Hitach公司),全波长微孔读板机(美国BioTek精宏公司)。
1.2 方法
1.2.1 猪外周神经的获得:南京华贞生物医药科技有限公司为本研究提供GTKO猪神经原料。经解剖后取得猪坐骨神经,入无菌PBS中立刻低温运回实验室。在实验室去除神经组织中多余的脂肪及结缔组织,并用无菌PBS清洗3次(连续搅拌),每次 15 min,去除残余血液,保存在-20 ℃冰箱中备用。
1.2.2 脱细胞方法:在脱细胞处理前,先将神经组织彻底清洗,然后将神经组织放入超纯水中, 4 ℃过夜。第2天将神经组织放入含0.25%胰蛋白酶(m/v)的PBS溶液中,37 ℃水浴作用1 h。将神经组织放入含0.1% SDS的PBS中,室温下振荡处理24 h,此步骤共循环2次。再将神经组织放入pH为 7.5 的50 mmol/L Tris-HCl溶液中,加入50 U/mL DNA酶和5 U/mL RNA酶,37 ℃水浴作用3 h。最后将神经组织在无菌PBS中清洗72 h,每24 h换液。将脱细胞神经基质放入-20 ℃冰箱中保存待检。
1.2.3 HE染色:将样品在4%多聚甲醛中固定24 h,经梯度乙醇脱水、二甲苯透明,浸蜡后包埋成组织块,将神经样品的横截面切取4 μm厚的薄片,转移至防脱片上,烤片,经二甲苯脱蜡,梯度乙醇复水,然后进行组织学染色后显微镜下观察。
1.2.4 DAPI染色:DAPI是一种能够与DNA强力结合的荧光染料。在天然神经与脱细胞神经切片上滴加DAPI工作液,室温避光孵育10 min,PBS漂洗3次,每次5 min。封片后荧光显微镜下观察。
1.2.5 残留DNA定量检测:分别称取天然神经与脱细胞神经各10 mg(n=3),配制10 μL蛋白酶K加60 μL蛋白酶K缓冲液,每个样品中加入70 μL消化液,于56 ℃水浴槽内消化,至待测样品完全消化,无肉眼可见颗粒样物为止。向2个反应体系各组加400 μL裂解液,涡旋10 s,静置10 min,直至完全溶解。加入磁珠液30 μL(37 ℃水浴预热),震荡10 min。加入400 μL结合液,室温下震荡孵育10 min。离心5 s,置于磁力架,静置 5 min。弃上清液,加300 μL洗涤液,涡旋10 s,快速离心15 s,置于磁力架,静置1 min,再漂洗DNA至少2次,最后一次快速离心25 s,收集磁珠。在弃上清液后,室温离心管敞口放置干燥,不得超过5 min。加100 μL溶出液,涡旋震荡5 min,70 ℃水浴5 min(中途涡旋)。快速离心25 s,置于磁力架2 min,将原各组转移上清液至新的一组离心管。加50 μL溶出液,涡旋震荡5 min,70 ℃水浴5 min(中途涡旋),在新的一组离心管中共获得150 μL的溶出液,再将其涡旋混匀后快速离心25 s, 获得最终纯化后的DNA。使用PicoGreen荧光定量测定脱细胞前后的神经组织DNA含量。采用Quant-iTTMPicoGreen dsDNA试剂盒,将样品与荧光液等体积混合,室温避光孵育5 min,在485 nm激发波长和 520 nm发射波长下测定荧光值,根据标准品的浓度和对应的荧光值绘制标准曲线,根据标准曲线得出样品DNA残留量。
1.2.6 天狼猩红染色:在天然神经与脱细胞神经切片上滴weigert铁苏木素染色液,染色10~20 min, 酸性分化液分化数秒,自来水洗5~10 min,然后天狼猩红染色液染色1 h,流水稍微冲洗,脱水、透明后,中性树胶封片,显微镜下观察。天狼猩红染色使胶原纤维呈红色、细胞核呈蓝色、肌纤维成黄色。
1.2.7 免疫组织化学检测:将天然神经与脱细胞神经切片用枸橼酸钠抗原修复液进行抗原修复,内源性过氧化物酶阻断剂室温孵育10 min,PBS缓冲液清洗3次。滴加封闭用正常山羊血清工作液,室温孵育1 h,将切片分别与抗I型胶原抗体、抗层黏连蛋白抗体、抗纤连蛋白抗体以1:200(v/v)的稀释度4 ℃孵育过夜,PBS洗涤3次,滴加生物素标记山羊抗兔/鼠IgG,室温孵育1 h,PBS缓冲液冲洗3 次。再滴加辣根酶标记链霉卵白素工作液,室温孵育15 min,DAB显色,苏木素复染核。
1.2.8 胶原定量检测:称取天然神经与脱细胞神经各10 mg(n=3),在胃蛋白酶浓度为0.1 mg/mL的0.5 mol/L乙酸溶液中4 ℃过夜孵育,酶活性在 4 ℃下有效去除末端非螺旋端肽以将胶原释放到溶液中。胶原蛋白标准品使用含有0、5、10和15 μg胶原蛋白参考标准品的等分试样100 μL。向标准曲线样品和测试样品(100 μL)中加入1 mL Sircol Dye Reagent,机械振荡混匀30 min,在此期间,胶原-染料复合物将从可溶性未结合的染料中形成并沉淀出来,以12 000 r/min离心10 min。倒掉上清液,留底部沉淀。将750 μL盐酸盐洗涤试剂加在胶原染料颗粒上,从颗粒表面和微量离心管内表面除去未结合的染料,以12 000 r/min离心10 min。将洗涤液排入废物容器中,将250 μL碱性试剂添加到样品中,涡旋,当所有结合的染料已经溶解时,将200 μL样品转移到96孔板的各个孔中,酶标仪参数设置为555 nm,或最接近匹配蓝绿色滤色片。测试空白试剂、标准品和测试样品的吸光度,从标准曲线获得胶原蛋白浓度。
1.2.9 异种抗原检测:将天然神经与脱细胞神经切片经枸橼酸钠溶液抗原修复,正常山羊血清封闭后,滴加抗a-gal抗体(1:1 000)4 ℃孵育过夜,因所购买的抗a-gal抗体自带荧光,孵育抗a-gal抗体后直接封片,在荧光显微镜下观察。
1.2.10 扫描电镜:将天然神经与脱细胞神经样品经2.5%戊二醛固定24 h,梯度乙醇脱水,醋酸异戊酯置换乙醇,然后将样品冷冻干燥24 h,喷金镀膜后扫描电镜观察。
1.2.11 细胞毒性检测:将L929细胞置于MEM培养液中37 ℃、5% CO2湿度饱和培养。培养液每隔3 d更换1次,待细胞融合度达到80%~90%时,进行1次传代,并选第3代对数生长期的细胞进行实验研究。参考GB/T 16886.5-2003体外细胞毒性试验与GB/T 16886.12-2000样品制备和参照材料,按0.1 g/mL的比例将脱细胞神经基质浸泡于MEM培养基中,37 ℃ 培养24 h,制备浸提液,以完全培养基作为对照。将L929细胞按1 000个/孔的密度接种于96孔细胞培养板内,每孔加入MEM培养基100 μL,置于CO2培养箱中,待细胞贴壁后,实验组完全培养基更换为浸提液,分别在培养第1、第2、第3天每孔加入10 μL CCK-8溶液,培养箱内孵育2 h后测OD450。在CCK-8方法中,OD值越大,细胞活性越好,表明材料毒性越小。
1.3 统计学处理方法 采用Graphpad Prism7.0软件进行统计学分析。计量资料以±s 表示,2组比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 脱细胞效果 HE结果显示脱细胞神经组织结构保留完整,有着与天然神经类似的神经束与结缔组织。在天然神经中,可看到在神经内膜及神经束膜中均有大量细胞,包括施万细胞及组织间隙细胞。脱细胞神经HE染色结果显示细胞已从组织中去除(见图1)。DAPI染色结果显示,天然神经组织有较强的蓝色荧光,即细胞核成分,而脱细胞神经组织并无细胞核成分(见图2)。HE与DAPI结果均表明脱细胞过程将神经组织中的细胞成分完全去除。DNA残留检测结果显示天然神经和脱细胞神经的DNA含量平均值分别为(831.62±29.37)ng/mg与(35.72±2.14)ng/mg。可见与天然神经相比,脱细胞神经有极低的DNA含量,进一步表明脱细胞神经基质细胞去除完全。
2.2 胶原纤维保留情况 天狼猩红染色结果显示天然神经胶原纤维排列规则且致密,脱细胞神经胶原纤维致密性变疏松,但未见胶原纤维的显著损失(见图3)。
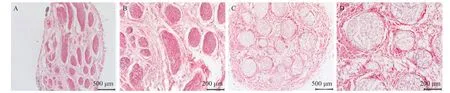
图1 天然神经(A、B)和脱细胞神经(C、D)HE染色
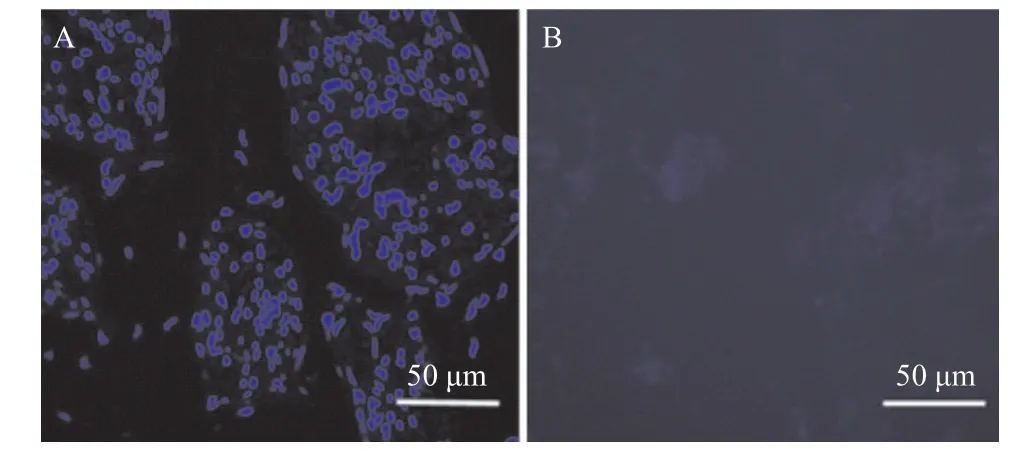
图2 天然神经(A)和脱细胞神经(B)DAPI染色(蓝色荧光代表细胞核)
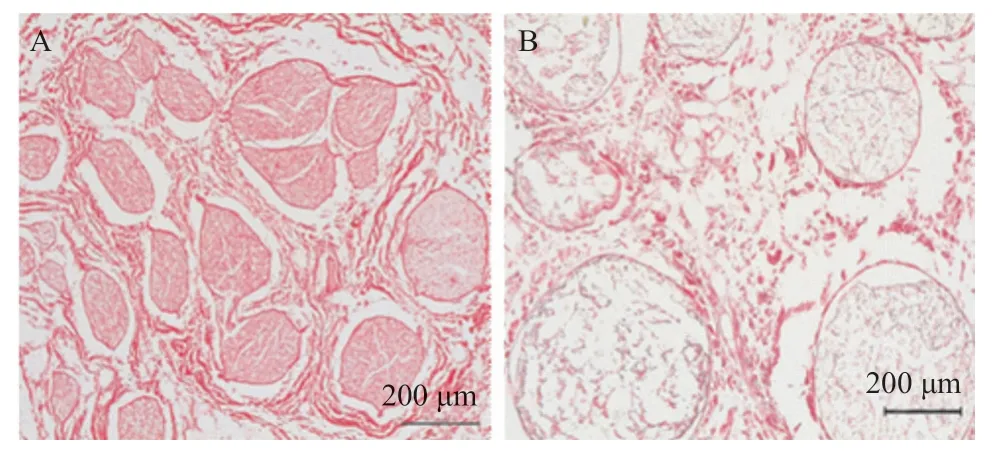
图3 天然神经(A)和脱细胞神经(B)天狼猩红染色(红色代表胶原纤维)
2.3 胶原蛋白定量检测结果 脱细胞神经样品的每毫克组织湿重的胶原蛋白量较天然神经减少 ([709.89±32.13)μg/mg vs(. 828.70±15.13)μg/mg], 差异有统计学意义(P<0.05),表明脱细胞化过程对胶原蛋白含量的轻微损害。
2.4 细胞外基质蛋白保留情况 免疫组织化学染色显示与天然神经相比,细胞外基质的主要蛋白组分I型胶原、层黏连蛋白、纤连蛋白在脱细胞神经内膜、中膜、外膜中保留(见图4)。
2.5 异种抗原残留情况 免疫荧光结果显示,与天然神经相比,脱细胞神经中a-gal抗原几乎无表达(见图5),由此可见脱细胞神经基质具有免疫原性低的特点。
2.6 脱细胞神经基质超微结构 扫描电镜显示脱细胞神经有着与天然神经类似的胶原纤维网格,三维组织结构保存完整,但与天然神经相比,脱细胞神经有着较大的孔隙率,移植后有利于宿主细胞的迁移。见图6。
2.7 脱细胞神经基质细胞毒性检测结果 用脱细胞神经基质制备的浸提液培养细胞3 d后,细胞生长状况良好,其OD450值与天然神经比,差异均无统计学意义(P>0.05)。细胞毒性检测结果证明所制备的脱细胞神经基质对细胞无明显毒性。
3 讨论
外周神经系统(peripheral nervous system,PNS)损伤是一个日益严重的医学和公共卫生问题,常伴随其他身体创伤,在所有入住I级创伤中心的患者中,5%的患者伴随PNS损伤,每年仅在美国就有超20万次的神经修复手术[4]。在中国,周围神经损伤病例每年新增60~90万例,其中需要通过神经移植来修复神经的病例为30~50万例[5]。
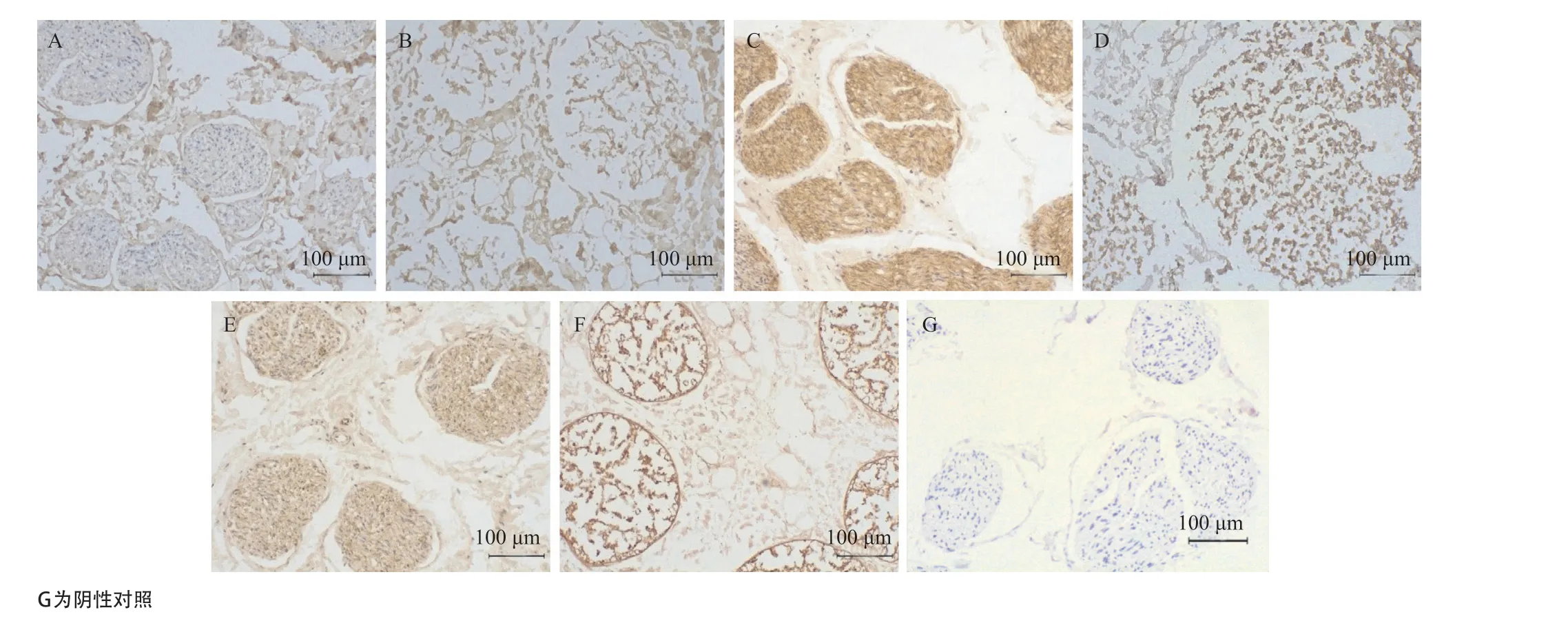
图4 天然神经(A、C、E)和脱细胞神经(B、D、F)I型胶原(A、B)、层黏连蛋白(C、D)、纤连蛋白(E、F)免疫组织化学染色结果
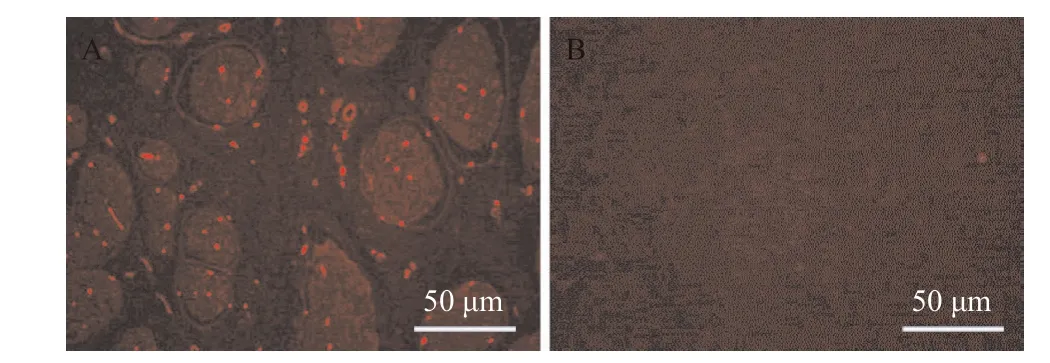
图5 天然神经(A)和脱细胞神经(B)a-gal免疫荧光(红色荧光代表a-gal异种抗原)
较短的外周神经损伤,可以采用神经断端直接缝合方式来修复,但较长神经缺损直接断端缝合会引入缝合张力,缝合张力会抑制神经再生。神经间隙超过1 cm时,神经移植便是外周神经修复的一个重要策略[6],自体神经移植是神经移植术的金标准。自体神经生物相容性较好,提供了刺激性支架,包括可存活的施万细胞和神经营养因子,在支持再生轴突方面发挥重要作用[7]。但可供神经移植的自体神经来源极其有限,且会对患者造成二次损伤,供体部位发病率增加,疼痛,瘢痕形成,神经瘤形成和供体区域的感觉丧失[8-10]。由生物型材料(肌肉、静脉等)和非生物型材料(聚乳酸、胶原、壳聚糖、硅胶管)构建的神经导管,部分材料已被批准进入临床阶段,对部分PNS有较好的修复效果[11]。但因其缺乏类似天然神经的细胞外基质结构,无法成为支持神经元和施万细胞再生的基质。当间隙长度超过3 cm时,神经功能恢复率降低[7]。随着组织工程和再生医学的发展,细胞外基质衍生的生物材料已在临床上用于不同组织和器官的修复,如小肠黏膜下层、心包、肌腱、韧带、血管等[12]。脱细胞神经基质是将天然外周神经脱细胞处理后,清除了施万细胞、神经外膜和神经束膜的细胞,以及神经纤维的髓鞘,形成的以施万细胞基底膜为主,以神经束膜和外膜的基质为外套的完整三维立体支架[13]。 异种脱细胞神经基质不仅作为支持材料,还作为细胞的调节剂,影响细胞存活、增殖、形态发生和分化[14],同时也保留了类似于天然神经的三维组织 结构,表面形貌对神经系统的发育具有深远的影响, 例如神经元分化和形态发生及促进轴突再生[4]。
动物源性材料作为异种材料植入人体后,其细胞表面的a-gal抗原与人体内存在的天然抗a-gal抗体结合,会激活补体系统引起严重的超级性排斥反应,最终导致异种移植失败[15]。因此去除供体猪器官中的α-1,3-半乳糖分子是获得成功异种移植的关键步骤。美国麻省总医院进行了GTKO猪的肾脏或心脏移植到狒狒的临床前实验,成功地克服了超急性免疫排斥反应,移植心脏和肾脏的存活时间显著延长,为异种移植迈出了坚实的第一步[16]。本研究以GTKO猪坐骨神经为实验原料,从根源上降低免疫原性,脱细胞处理后,进一步去除异种抗原,制备低免疫原性脱细胞神经基质。
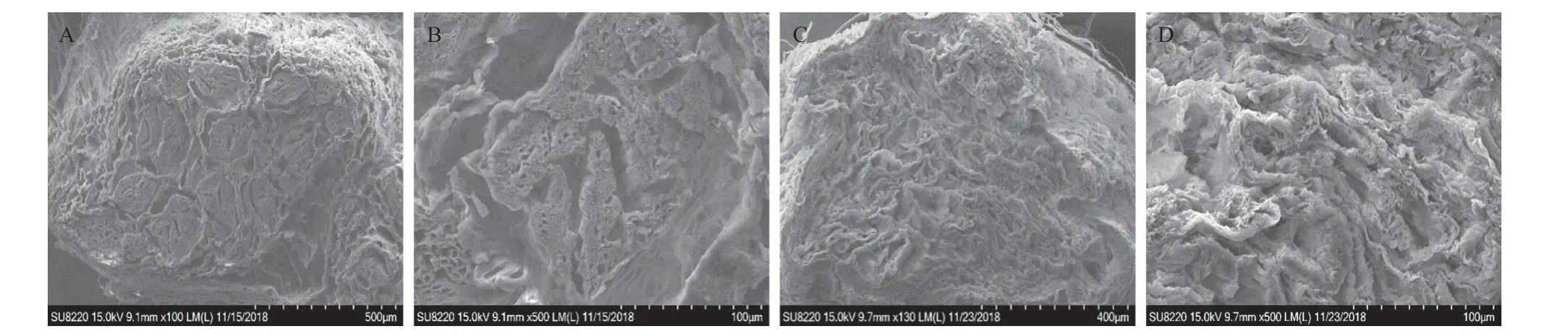
图6 天然神经(A、B)和脱细胞神经(C、D)扫描电镜结果
目前脱细胞神经基质的制备,大都采用单一高浓度去污剂(例如脱氧胆酸钠、Triton等)或高浓度酸碱试剂(例如氢氧化钙、硫化钠和氢氧化钠)来达到去细胞目的[17-21],采用物理化学酶法联合脱细胞方案制备脱细胞神经基质的报道较少,本研究以GTKO猪坐骨神经为实验材料,采用自主设计的低渗溶液、胰蛋白酶、低浓度去垢剂及核酸酶组合的四联脱细胞方案。脱细胞的目的就是在不破坏组织细胞外基质(extracellular matrix,ECM)的同时将引发免疫反应的细胞成分从组织中去除,但在脱细胞过程中对于ECM的破坏是不可避免的[22]。因此在脱细胞过程中,我们应尽可能减少对ECM的破坏。目前主要的脱细胞方法主要分为物理方法、化学方法及酶消化法。常用的物理方法包括反复冻融、机械力学处理,一般而言,物理方法脱细胞效果较差,但对ECM的破坏较小。常用于脱细胞的化学试剂包括酸碱试剂、低渗和高渗溶液、洗涤剂等。常用于脱细胞的酶类包括胰蛋白酶、中性蛋白酶、胶原酶、核酸酶等[23]。有研究表明碱(例如氢氧化钙、硫化钠和氢氧化钠)去细胞效果足够强,然而碱可以完全消除基质中的生长因子,并且比化学和酶促剂更显著地降低ECM机械性能[24]。有研究在制备脱细胞小口径血管支架时,发现Triton具有强烈的毒性并且不容易通过洗涤去除,脱细胞处理后,组织中残留的洗涤剂会渗透到组织中,即使是较低剂量也会导致细胞毒性[25-27]。胰酶能够提高后续去细胞剂的渗透性,因此在去细胞过程尤其是对于致密的组织中首先使用胰酶成为脱细胞过程中的必要步骤[28]。故本研究的四联脱细胞方案先采用简单的渗透作用导致细胞溶解,破坏细胞膜结构,再用胰蛋白酶溶液消化处理(先用胰蛋白酶溶液处理,有利于后续脱细胞溶液的进入),随后使用低浓度离子型洗涤剂(SDS)溶解细胞膜,最后用核酸酶裂解核酸序列并清除细胞裂解后的核酸物质,以达到较好的脱细胞效果。脱细胞处理后,用无菌PBS溶液彻底清洗,去除残留在组织中的脱细胞试剂。
广泛使用异种组织用于生物支架的最大障碍是在所得支架基质中存在残留DNA[29]。有效的去细胞方法应满足以下标准:①HE和DAPI染色看不见残留的细胞核;②干燥组织中DNA含量不超过50 ng/mg; ③DNA片段的大小不超过200 bp[30]。本研究中,HE、DAPI染色结果及DNA定量结果均表明该脱细胞方案脱细胞效果良好,HE及DAPI图像均看不到细胞核,DNA检测显示脱细胞神经DNA含量极低。天狼猩红染色及1型胶原免疫组织化学结果显示脱细胞神经胶原成分保留较好,胶原蛋白是细胞外基质组分的主要成分,主要维持神经的力学性能[31]。免疫组织化学结果显示脱细胞神经层黏连蛋白和纤连蛋白保留较好,层黏连蛋白也是ECM的主要蛋白质,参与细胞分化、迁移和黏附活动。层黏连蛋白是一种黏合剂成分,可在神经损伤后为基底层支架提供再生促进能力,并且已被证明可促进体外神经发生[32]。纤连蛋白具有用于黏附许多细胞类型的配体,促进宿主生物相容性,有利于神经再生[31]。扫描电镜显示脱细胞神经有着与天然神经类似的三维组织结构,研究表明表面形貌对神经系统的发育具有深远的影响,例如神经元分化和形态发生及促进轴突再生。扫描电镜结果显示脱细胞神经与天然神经相 比,有较大的孔隙率,有研究表明,较大的孔隙率促进细胞浸润和迁移[33]。以GTKO猪坐骨神经为实验原料,并且经脱细胞处理后,引起急性免疫排斥反应的异种抗原a-gal基本去除干净,免疫荧光结果显示与天然神经相比,脱细胞神经无a-gal抗原表位的表达,证明其有较低的免疫原性。去污剂有一定的细胞毒性,通过观察脱细胞神经基质浸提液对小鼠成纤维细胞生长状况的影响来评价去污剂的残留情况,CCK-8细胞增殖毒性检测结果显示神经组织脱细胞处理后,经PBS多次清洗,基本可以将去污剂去除干净,用脱细胞神经基质浸提液培养细胞,细胞生长状况良好,结果与对照组差异无统计学意义。证明脱细胞神经基质低细胞毒性。
综上,利用GTKO猪坐骨神经所制备的脱细胞神经基质无细胞组分残留,细胞外基质组分保留较好,并且具有低免疫原性、低细胞毒性的特点。本研究在体外实验基础上探究了低免疫原性异种脱细胞神经基质修复长距离外周神经缺损的可行性,接下来的工作重点为动物体内实验验证低免疫原性异种脱细胞神经基质修复外周神经功能的效果。

