银环蛇蛇毒中具有镇痛活性的多肽成分的生化分离和活性鉴定*
刘金满,卢悟广,陈永根,王明远,王 奇**,曹 鹏
(1.广州中医药大学临床药理研究所 广州 510080;2.南京中医药大学附属中西医结合医院 南京 210028)
全世界的蛇类共有3000多种,据相关统计毒蛇就占其中600多种。而我国大部分地处亚热带气候区,因此蛇类资源也是相当丰富,约有200多各种蛇类,毒蛇种类约占其中的四分之一,而其中剧毒的蛇约有l0多种[1]。蛇毒是从毒蛇的腺体中分泌出来的,属于一种生物毒素液体,毒蛇在其捕获猎物或攻击咬伤我们人类时,毒腺中的毒液经腺体的导管分泌到牙鞘内,再经牙槽挤压到人或其他动物体内,随血液或者淋巴组织扩散而引起猎物出现中毒症状如:凝血功能障碍、部分组织坏死、神经系统紊乱等[1-2]。蛇毒的成分非常复杂,主要包含了一些蛋白质、活性酶类及多肽,这些成分约占毒液干重的90%-95%[3]。同时蛇毒中含有一些碳水化合物、脂肪、核苷、胺类以及游离氨基酸等,其中发挥毒性及药理作用的主要活性物质是蛋白及多肽组分[3]。根据其产生毒性机制不同,蛇毒可分为血液毒性、细胞毒性和神经毒性毒液,其中神经毒素主要是针对外周血神经系统作用并可导致神经肌肉无力和麻痹[4]。
蛇毒蛋白多肽组分也是药物研究和发现的重要资源,具有抗炎,抗肿瘤,抗血栓形成,镇痛等药理活性[4-8]。许多源自蛇毒的药物临床疗效显著,如来自马来西亚红口蝮蛇(Calloselasma rhodostoma)的Ancrod[9],来自矛头蝮(Bothrops atrox)的巴曲酶(Batroxobin)[10]以及来自尖吻蝮(Deinagkistrodon acutus)的去纤维化蛋白酶[11],它们都具有显着的抗血栓形成作用,广泛用于治疗脑梗塞,心肌梗塞,缺血性中风和心绞痛。而蛇毒中膜毒素、去整和素、出血毒素、血管凋亡诱导蛋白、氨基酸氧化酶等成分具有治疗癌症作用。从眼镜蛇毒(Naja naja atra)中分离的Cardiotoxin-3毒素、南美响尾蛇恐怖亚种(Crotalus durissus terrifucus)分离的磷脂酶A2 crotoxin毒素以及我们课题组前期从银环蛇毒中分离的L-氨基酸氧化酶BM-Apotxin都具有显著的抗肿瘤活性。来自于太攀蛇(Oxyuranus Scutellatus)的Taipoxin则具有促进创伤修复的疗效。来自南美铜头 蝮 蛇(Agkistrodon contortrix contortrix)的 解 离 素contortrostatin有显著的抗血小板凝聚的功效。
在20世纪早期,人们就开始运用蛇毒来缓解神经痛、恶性肿瘤疼痛和关节痛等。我国自1950年左右就开展了蛇毒的镇痛作用研究,并研制出蛇毒神经毒素制剂和粗毒制剂,用于疼痛的治疗。蛇毒的镇痛作用具有起效慢、持续时间长、效果好、无耐受性和成瘾性等特点[12]。中科院昆明动物研究所于1976年研制的眼镜蛇毒神经毒索制剂——克痛灵,主要治疗神经血管性头痛、坐骨神经痛、三叉神经痛以及风湿痛等顽固性疼痛,临床疗效显著[13]。但迄今为止其镇痛机理仍不明确。1995年,P.Gopalakrishnakone等人从眼镜王蛇(king cobra,Ophiophagushannah)毒中发现了一种镇痛多肽hannalgesin有显著的镇热痛活性[14]。hannalgesin是一种神经毒素肽,其镇痛活性可被纳洛酮所阻断,提示其可能作用于阿片受体[14]。2009年,Liu等人发现眼镜蛇毒素cobratoxin(CTX)能够显著抑制福尔马林诱导的炎性痛以及弗氏佐剂诱导的慢性炎性痛[15]。CTX是一种三指肽,可作用于乙酰胆碱受体特别是与疼痛密切相关的α7受体。但是CTX的镇痛效果可被被阿托品拮抗,而不是不是纳洛酮。这表明CTX产生独立于阿片受体系统之外的镇痛效果。上述结果表明,眼镜蛇毒中的神经毒素可能是其产生镇痛效果的主要药效成分。
银环蛇(Bungarus multicinctus)俗称金钱白花蛇,为眼镜蛇科剧毒蛇,广泛分布于中国南部地区,如江西,福建,台湾等地。银环蛇中医入药有祛风通络、定惊止痉之功效,主风湿痹痛[16-17]。银环蛇毒素的主要成分为蛋白质和多肽,主要包括三指毒素(3-FTx),磷脂酶A2(PLA2s),凝集素,金属蛋白酶,丝氨酸蛋白酶和蛋白酶抑制剂[18]。其中神经毒素是银环蛇毒液中含量最丰富的成分,占毒素总蛋白的近50%,比眼镜蛇毒中神经毒素含量更高[19-20]。银环蛇神经毒素包括α-银环蛇毒素(α-BGT)、β-银环蛇毒素(β-BGT)、κ-银环蛇毒素(κ-BGT)等[18]。α-BGT属于突触后神经毒素,它们可以竞争性的与处在神经肌肉接头处的乙酰胆碱受体相结合,从而神经递质的传导被阻断[21]。α-BGT由74个氨基酸组成含有10个半胱氨酸形成5对二硫键,其相对分子质量为8 KD左右[21]。α-BGT结构形如三指,致密的内核由4个二硫键聚集在一起形成,3个肽链环由此内核伸展而出仿佛3个手指的形状,所以又称之为三指肽[21]。三指型毒素折叠的可塑性已经历了最佳的进化,短链与长链的蛇毒突触后神经毒素均属于这类结构,nAChR亚型间的细微差别可利用功能基团的不同组合特异性识别出来[22]。β-BGT为突触前神经毒素,其表现出Ca2+的依赖性磷脂酶A2(Phospholipase A2,PLA2)活性,其直接作用于运动神经的突触前膜部位,可以阻断乙酰胆碱的释放,从而导致骨骼肌丧失收缩功能而处于麻痹状态。β-BGT同样属于高碱性多肽,分子量为20-22 KD,等电点为8.8-9.7。β-BGT由中间以一对二硫键相连的A、B两条链构成,A链包含有120个氨基酸残基,分子量为13500 D,具备磷脂酶A2的活性,与哺乳动物胰腺分泌的磷脂酶A2及其它蛇毒中的磷脂酶A2在结构上有同源性[23]。B链含有60个氨基酸,分子量为7 KD左右,与蜗牛毒液及蛇毒中的kunitz型蛋白酶抑制剂、树眼蛇毒素及毒素Ⅰ具有序列同源性[24]。
当前已经从银环蛇毒中分离鉴定了多种神经毒素多肽并解析了序列结构,如BM10-1,BM10-2[25],P15[26],Gamma-bungarotoxin[27],α-bungarotoxin[28]等。但是这些毒素的药效作用及其药理机制尚不明确。本课题组前期工作发现银环蛇蛇毒具有显著的抗肿瘤作用,并且分离鉴定出其中最关键的抗肿瘤活性成分BM-Apotxin[29]。
本研究在前期工作基础上进一步深入挖掘,首次发现银环蛇毒对小鼠热痛、醋酸炎性痛具有显著的镇痛作用,并且与吗啡相比,其镇痛作用更持久。进一步通过分子筛、离子交换、HPLC从银环蛇毒中分离出活性较强的多肽分子,通过肽谱鉴定,氨基酸测序及序列比对我们发现,该镇痛单体为一种含有74个氨基酸、5对二硫键的多肽α-bungarotoxin。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
健康清洁级雌性C57BL∕6小鼠320只,购买自北京维通利华实验动物技术公司,合格证号SYXK(苏)2016-0018。于12小时光∕暗循环无病原体的环境中喂养。根据中华人民共和国评估与认证实验动物护理国际协会指南,所有体内研究都是在经过批准的机构实验动物护理和协议下进行的。
1.1.2 实验材料及试剂
银环蛇粗毒冻干粉(购自江西省景德镇野生特种动物科技开发有限公司,于-20℃保存)、盐酸吗啡注射液、冰醋酸等常规生化试剂均购自国药集团。BCA蛋白浓度测定试剂盒购自于碧云天生物技术研究所。
1.1.3 仪器设备
AKTA Purifier、Sephadex G-50葡 聚 糖 填 料、XK26-1000层析柱购自于美国GE Healthcare Life Sciences公司;台式冷冻离心机(5417R)购自于德国Eppendorf公司;蛋白电泳仪、凝胶成像系统Gel Doc XR购自于BIO-RAD公司;高效液相色谱仪(2695)、HPLCC18反相高效液相色谱柱规格为SinoChrom5μm均购自于美国Waters公司;热板仪(IITCLife Science,Woodland Hills,CA,USA)
1.2 实验方法
1.2.1 银环蛇毒的G50分子筛分离与收集
取1 g冻干的银环蛇粗毒冻干粉溶于5 mL PBS pH7.4中,4℃,12000 rpm离心30 min除去不溶物质。然后将上清液用AKTA(GE Healthcare,Sweden)控制上样到用相同的缓冲液预平衡好的Sephadex G-50凝胶过滤柱上(26 mm×1000 mm),流速为1 mL·min-1。上样后使用相同的磷酸盐缓冲液以1 mL·min-1的流速进行洗脱,在215 nm和280 nm波长下监测洗脱液的出峰。所有的馏分通过AKTA自动收集器收集,每管收集3 mL。将收集的组分取样溶解在5×SDS-PAGE Loading buffer中,15%SDS-PAGE分析蛋白分子量分布。根据215 nm和280 nm吸收峰及电泳结果分别合并各组分样品并编号。
1.2.2 银环蛇镇痛活性组分的HPLC分离与序列鉴定
将银环蛇G50分子筛各组分加入冻干保护剂冻干保存于-80℃。根据各组分的热板镇痛活性,取活性最强的P4组分采用HPLC进一步分离纯化。冻干粉加入去离子水重新溶解至终浓度为5 mg·mL-1。使用Waters E2695 HPLC系统(Waters,USA)将银环蛇G50组分上样到C18反相HPLC柱(SunFireTMC18,5μm,4.6×250 mm,Waters,USA)上。在215 nm波长处监测吸光度。用0.1%TFA水溶液(溶液A)和0.1%TFA的乙腈(溶液B)的流动相分离小肽,流速设定为1.0 mL·min-1,洗脱流程为:0-10 min,95%的A等梯度洗脱;5-60 min,线性梯度洗脱,梯度如下:5-15%B 10 min,15%-40%B 50 min,40%-60%B 60 min。HPLC样品直接冻干后用于后续的活性检测、质谱分析和N末端测序。
1.2.3 银环蛇毒热板镇痛实验
全雌C57BL∕6小鼠20 g±2 g(雄性睾丸接触热板会影响观察结果)3个批次合计220只;所有药物分组均为每组10只。银环蛇粗毒、G50分子筛各组分及G50-P4的HPLC各组分冻干粉用200μl生理盐水溶解后BCA定量,并用生理盐水稀释到所需浓度;采用腹腔注射,注射体积为200μl∕只。采用步阶升温法(37℃-52℃)△T=5℃,即热板到达起点温度后将小鼠放入热板仪静置5 min待小鼠平静,启动升温程序,观察小鼠行为,以小鼠第1次舔后足的温度作为小鼠热痛阈值。给药前1 d进行入排测试,取热痛阈值45℃-50℃之间的小鼠进行正式实验。小鼠经腹腔注射给药后1 h、3 h、5 h、7 h,分别测试各给药组的热痛阈值,以生理盐水作为阴性对照,以吗啡(5 mg·kg-1)作为阳性对照。
1.2.4 银环蛇毒醋酸扭体镇痛实验
实验材料:C57BL∕6小鼠90只(体重20 g±2 g)随机分为30只∕组,共3组(生理盐水、10 mg·mL-1吗啡、YHS-G50-P4-HPLC-P6)。实验开始前小鼠禁食12-16 h(自由进水),90只小鼠全部腹腔注射给药(100μl∕10 g),给药后第1 h、4 h、7 h 3个时间点每个时间点每组各取10只用1%醋酸腹腔注射(100μl∕只),然后记录20 min内总扭体次数。
2 结果与分析
2.1 银环蛇粗毒具有显著的镇热痛效应
如图1所示,小鼠经腹腔注射给药后1 h、4 h、7 h,分别测试各给药组的热痛阈值,以生理盐水作为阴性对照,以吗啡(5 mg·kg-1)作为阳性对照,银环蛇粗毒具有十分显著的镇热痛效应,与生理盐水组相比,银环蛇粗毒在10μg·kg-1作用浓度下提高热痛阈近2℃,作用浓度与吗啡(5 mg·kg-1)相比仅需吗啡的1∕500。此外,吗啡在腹腔注射后半小时起效,大约4 h后已经逐渐失效,而银环蛇毒镇痛效果在我们监测的几个时间点内呈逐渐上升的趋势,且持续时间比吗啡更长,给药7 h后仍然具有显著镇痛效果。
采用ITC-P134热板仪,设置条件为37℃-52℃,上升步阶温度为5℃·min-1,以小鼠第1次舔后足(hinddraw lick)时的温度作为该小鼠痛阈。图中每组10只小鼠,入组标准为热痛阈值在45-47℃之间。统计为其他各组分别与生理盐水组比较*P<0.05,**P<0.01。
2.2 银环蛇粗毒G50分子筛各组分镇痛效应
如图2所示,1 g银环蛇粗毒经Sephadex G-50凝胶过滤分离为4个主要的大峰P1-P4(图2A)。SDSPAGE结果提示,银环蛇粗毒主要由分子量小于25 KD的小蛋白组成,其中P4主要含分子量小于15 KD的多肽(图2B)。进一步对4个峰的热板镇痛活性进行分析,以生理盐水作为阴性对照,以吗啡(5 mg·kg-1)作为阳性对照,吗啡组(5 mg·kg-1)在给药后1 h左右镇痛活性达到峰值,提高了小鼠近2℃的热痛阈值,此后便缓慢降低,给药4 h后,热镇痛活性几乎丧失(图2C)。而银环蛇毒G50分子筛分成的4个组分(10μg·kg-1),在我们给药后监测的1 h、4 h、7 h 3个时间点内,只有P4有显著的镇痛活性且能够将小鼠的热痛阈值提高1-2℃,且P4的热镇痛活性随着给药时间的延长逐渐增强,在给药7 h后仍然有显著的镇痛活性(图2C)。
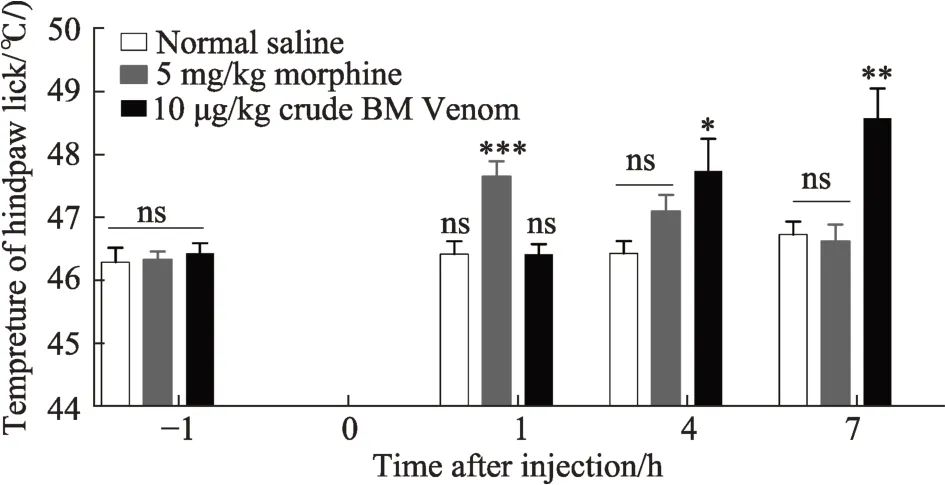
图1 银环蛇蛇毒热板镇痛活性分析
2.3 银环蛇毒镇痛多肽的分离纯化与活性检测
通过对G50分子筛各组分进行热板镇痛活性分析发现,银环蛇毒的镇痛活性组分主要是小分子多肽,因此我们将镇痛活性最高的G50-P4组分进行了HPLC分离。HPLC分离结果提示,G50-P4组分共分成了7个辨识度较高的215∕280 nm吸收峰。其中P1,P2,P3,P6(BGT-6),P7可能为单体(图3A)。而P2,P4,P5较宽可能为混合物(图3A)。进一步对7个峰的热板镇痛活性分析比较发现,P3和P6均表现出一定的镇痛活性,其中P6(BGT-6)具有显著镇痛活性,提高了小鼠近2℃的热痛阈值且镇痛效果持续时间最长,在给药后7 h内我们监测了第1 h、3 h、5 h、7 h各组的镇热痛作用,P6呈现出逐渐递增的镇痛作用(图3B,图3C)。我们进一步检测了P6组分对醋酸扭体小鼠模型的镇痛活性,以生理盐水作为阴性对照,以吗啡(5 mg·kg-1)作为阳性对照,吗啡组(5 mg·kg-1)在给药后1 h左右对醋酸致内脏痛的抑制率达到了100%,并随着时间的延长递减,到给药后7 h,抑制率降到了76.1%。我们发现P6同样具有显著的镇痛活性,而且P6对醋酸致内脏痛的镇痛活性特征与镇热痛特征有显著不同,P6在给药后1 h很大程度上抑制了醋酸导致的小鼠扭体反应,抑制率达到了90.8%,同样随给药时间的延长,其镇痛活性逐渐下降,到给药后7 h,抑制率降到了35.8%(图4),这与其镇热痛的时间依赖性相反。这有可能是这两种疼痛模型的致痛机制差异导致。

图2 银环蛇毒G50分子筛组分热板镇痛活性分析

图3 银环蛇镇痛活性多肽的HPLC纯化及各组分热镇痛活性分析
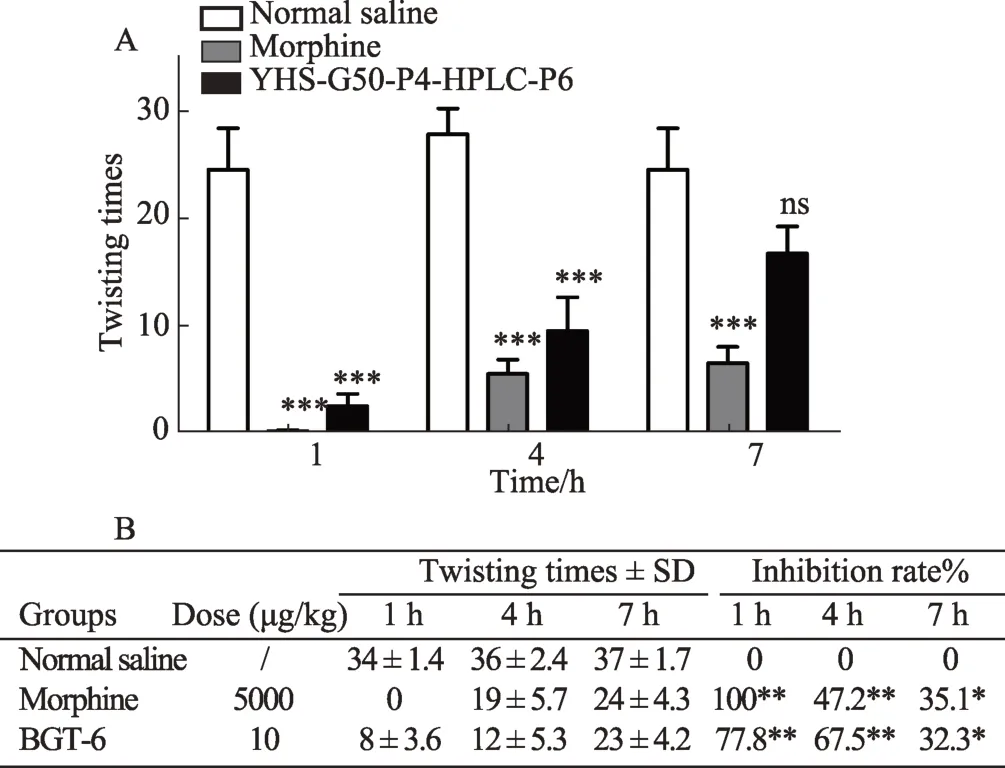
图4 银环蛇镇痛活性多肽对小鼠醋酸扭体疼痛模型的镇痛活性分析
2.4 银环蛇毒镇痛活性多肽的序列鉴定与结构分析
通过多肽指纹图谱和N端氨基酸测序分析发现,银环蛇镇痛活性多肽G50-P4-HPLC-P6的氨基酸序列与α-bungarotoxin(UniProtKB-P60616)相匹配(图6A,图6B),α-bungarotoxin成熟肽由74个氨基酸组成,含有5对二硫键(图6C),PDB构象提示,αbungarotoxin是一种典型的蛇毒三指肽(图5D),αbungarotoxin的分子表面负电荷(蓝色)主要分布于手指构象区域(图5E)。
3 讨论

图5 银环蛇镇痛活性多肽的序列及结构分析
银环蛇用于传统中医药已经有几千年的历史。然而当前围绕银环蛇开展的研究主要集中在毒腺的组学分析和新毒素的发现与鉴定,其传统药用功效的物质基础研究则十分有限。尽管我们的前期研究表明银环蛇毒有显著的广谱抗肿瘤活性,但是其体内抗肿瘤活性仍有待进一步研究。在本研究中,我们首次发现银环蛇毒具有显著的热镇痛活性,并且其镇痛活性与吗啡相比持续时间更长,这与已报道的眼镜蛇科另一种毒蛇眼镜蛇毒镇痛活性特征十分相似。通过比较银环蛇毒G75分子筛和G50分子筛结果发现,银环蛇毒中的蛋白组分主要分布于两个范围:大于35 KD的大分子蛋白如Bm-Apotxin和小于25 KD的小分子多肽,如PLA2级神经毒素。而镇痛活性主要来自于小分子多肽,这与眼镜蛇毒的镇痛活性组分类似[15,30]。通过进一步的HPLC分离及多肽鉴定我们发现,银环蛇镇痛活性最强的组分是一种已发现的毒素α-bungarotoxin。α-bungarotoxin是一种乙酰胆碱受体拮抗剂,能够以相对不可逆的方式与神经肌肉接头处发现的烟碱乙酰胆碱受体结合,导致受害者瘫痪,呼吸衰竭和死亡。它还被证明在脑中拮抗α7烟碱乙酰胆碱受体[31]。其构象是典型的三指肽结构[28],而乙酰胆碱受体拮抗剂通常可作为解痉药用于痉挛和多种疼痛的治疗[32-33]。令人遗憾的是当前围绕α-bungarotoxin的研究主要是其结构与功能的关系且年代久远,其镇痛分子机制及其镇痛作用靶点尚不明确。
本研究首次证实了银环蛇具有显著的镇痛活性,并且分离鉴定了其关键活性组分为一种乙酰胆碱拮抗剂α-bungarotoxin,阐明了银环蛇镇痛的物质基础。在接下来的工作中,我们将建立不同的疼痛模型深入研究α-bungarotoxin的镇痛活性,并进一步通过电生理、计算机模拟等技术深入研究其与靶点的相互作用,从而阐明银环蛇毒的镇痛分子机制。

