生菜和菜薹耐盐性鉴定方法建立及耐盐种质初期筛选 ·
程亚雄 武佩琪 曹晓雪


关键词:盐胁迫;生菜;菜薹;种子萌发;幼苗生长;种质筛选
土壤盐碱化是目前世界各国面临的共同问题,土壤盐碱化会使土壤板结、肥力下降,不利于农作物的生长,已成为设施农业生产中须要克服的重要难题。我国是盐碱地大国,盐碱化的土地面积约有0.27亿hm2[1],主要分布于华北平原、东北平原、西北内陆及滨海地区。当植物暴露于盐渍土壤时,渗透胁迫是其经历的第一个胁迫,会立即影响植物的生长[2]。当盐离子浓度达到某个阈值时,离子毒性会随后发生;超过该阈值,植物将无法维持离子稳态和生长[3]。渗透胁迫和离子毒性可引起氧化应激及一系列次级应激反应,盐胁迫还可导致光合作用降低[4],产量大幅降低[3]。
目前,用于克服土壤盐渍化的2种主要技术分别是用化学或物理方法改造土壤,以及培育耐盐作物品种[5]。化学或物理方法改造土壤成本高昂,且不可避免带来次生盐渍化,从而增加土壤中的化学物。因而耐盐作物材料的选育非常重要。相关研究表明,钠离子和氯离子在盐渍化土壤中占有较高的比例,常采用 NaCl 处理模拟盐胁迫进行植物耐盐性评价,在植物生长发育过程中,最脆弱的时期是萌发期和幼苗期,植物在盐胁迫环境下能否顺利萌发以及幼苗期能否顺利生长,在一定程度上能反映其耐盐性的强弱[6]。因此,本试验通过无菌培养的方法测定不同浓度的NaCl胁迫对生菜、菜薹种子萌发及幼苗生长的影响,筛选出生菜、菜薹的盐胁迫致死浓度,进一步扩大种质筛选范围以获得耐盐性较强的生菜、菜薹材料,以期为抗逆育种研究奠定基础。1 材料与方法
1.1 试验材料
本試验于2018年7—11月,在山西农业大学园艺学院蔬菜种质资源创新与生物技术实验室进行。
供试材料有绿色、紫色2种类型材料,绿生菜材料编号为LG1、LG2、LG9、LG13、LG23,紫生菜编号为LP14、LP15、LP16、LP18、LP24;绿菜薹编号为CG32、CG34、CG35、CG36、CG40、CG42、CG43,紫菜薹编号为CP37、CP38、CP49,生菜、菜薹各10份材料,均由笔者所在实验室保存。
1.2 试验方法
1.2.1 种子处理 挑选健康饱满、大小一致的种子,先用75%的乙醇消毒30~60 s后用无菌水冲洗2次,再用7% NaClO消毒10 min,无菌水冲洗5次以上,期间不断振荡混匀,保证消毒效果。无菌条件下接种于带有不同浓度NaCl的1/2 MS(pH值为5.8)培养基上。置于智能光照培养箱内进行培养。培养环境条件设置为温度25 ℃左右,光照强度 2 000 lx,16/8 h的光/暗周期,湿度保持在70%左右。
1.2.2 种子萌发试验 首先,进行NaCl胁迫致死浓度筛选。其中,生菜种子选用LG1、LP24,NaCl浓度设置为0、20、40、60、80、100 mmol/L等6个浓度;菜薹种子选用CG36、CP49,NaCl浓度设置为0、50、100、150、200、250、300 mmol/L等7个浓度。然后,再进行10个生菜、10个菜薹材料耐盐性比较,氯化钠浓度分别设置为0、50、100 mmol/L等3个浓度;0、200、250、300 mmol/L等4个浓度,每个处理100粒种子,重复3次。
1.3 测定内容与方法
1.3.1 种子萌发指标的测定 种子发芽以胚根突破种皮2 mm为标准[7],从接种后1 d开始至7 d结束,每天记录生菜、菜薹种子的发芽数。
种子发芽势(GE)=前3 d发芽种子数/种子总数×100%;
种子发芽率(GP)=7 d内种子发芽数/种子总数×100%;
发芽指数(GI)=∑(Gt/Dt)。
式中:Gt指发芽天数内总的发芽数,Dt指种子的发芽天数。
活力指数=发芽指数×主根长;
盐害指数[8]=(对照组发芽率-NaCl处理组发芽率)/对照组发芽率×100%。
1.3.2 幼苗上胚轴和主根长的测定 于种子萌发后7 d,取出幼苗,用刻度尺测定其上胚轴长、主根长,每个处理随机测定30株。
1.4 数据分析
利用Microsoft Excel及SAS软件进行数据处理并作图。
2 结果与分析
2.1 盐胁迫浓度筛选
2.1.1 不同浓度盐胁迫对生菜种子萌发的影响 从图1可以看出,随着NaCl胁迫浓度的升高,生菜的发芽率(图1-A)、发芽势(图1-B)、发芽指数(图1-C)总体呈现下降的趋势,除20 mmol/L NaCl胁迫处理组之外,其他浓度处理组均与对照差异明显。其中,100 mmol/L NaCl处理下生菜种子几乎完全不萌发或者萌发率极低(图1-A);40 mmol/L NaCl处理时,种子萌发率为70%左右,与对照差异不明显;而60 mmol/L NaCl处理时种子萌发率为45%左右,明显低于对照组(97%~100%),且发芽势、发芽指数在60 mmol/L NaCl处理时明显下降。LG1种子的发芽势、发芽指数整体要好于LP24。
2.1.2 不同浓度盐胁迫对菜薹种子萌发的影响 从图2可以看出,与生菜表现不同,菜薹种子的发芽率(图2-A)、发芽势(图2-B)、发芽指数(图2-C)随着NaCl处理浓度的升高,总体呈现出先升高后下降的变化趋势。低浓度的NaCl(≤100 mmol/L)处理对菜薹种子萌发具有一定的促进作用,但差异不明显;而高浓度NaCl处理会抑制种子萌发。200 mmol/L NaCl处理时,种子萌发率为60%左右,与对照差异不明显;而250 mmol/L NaCl浓度处理时种子萌发率仅为40%左右,明显低于对照的 78%~80%,发芽势、发芽指数在250 mmol/L NaCl处理时也明显下降;300 mmol/L NaCl处理可以明显抑制种子萌发。CG36种子的发芽率、发芽势、发芽指数整体要好于CP49,且差异明显。
2.1.3 不同浓度盐胁迫对生菜幼苗生长的影响 随着NaCl处理浓度的升高,生菜的主根长、上胚轴长、活力指数等均呈现下降的趋势,且各处理与对照存在明显差异(图3)。其中,40 mmol/L NaCl处理时,主根长为对照的65%左右;60 mmol/L NaCl处理时,主根长为对照的45%左右,明显低于对照;100 mmol/L NaCl处理下生菜幼苗根系几乎完全不生长或者生长量极低(图3-A)。此外,上胚轴长(图3-B)、活力指数(图3-C)等在≥60 mmol/L NaCl处理时也下降明显。LG1的主根长、活力指数在低浓度处理时低于LP24,但当浓度高于 60 mmol/L 时反而相对有利于紫生菜幼苗生长,但品种间差异不明显;LG1的幼苗上胚轴长整体要好于LP24,但差异不明显。
2.1.4 不同浓度盐胁迫对菜薹幼苗生长的影响 由图4可知,菜薹在50 mmol/L NaCl浓度时,主根长为对照的50%左右,与对照差异明显;当NaCl浓度升高至200、250 mmol/L时,主根长仅为对照的6%左右;当NaCl浓度高达300 mmol/L时处理,幼苗根系几乎不生长或者生长量极低(图4-A)。250 mmol/L以上浓度的 NaCl 处理的菜薹上胚轴长、活力指数等也明显下降(图4-B、图4-C)。CG36幼苗的主根长、上胚轴长、活力指数整体要好于CP49。
综上所述,100 mmol/L NaCl处理可以明显抑制生菜种子萌发及幼苗生长,该浓度可能处于生菜盐胁迫的致死浓度范围;40 mmol/L NaCl处理时生菜种子的萌发和幼苗生长整体与对照差异不明显,而60 mmol/L NaCl处理时各项指标与对照差异明显;因此将 0、50、100 mmol/L NaCl作为生菜不同材料抗性筛选的浓度梯度范围。菜薹在 300 mmol/L NaCl处理下种子萌发及幼苗生长被明显抑制,种子几乎未萌发,可能是菜薹NaCl处理的致死浓度范围;而在200、250 mmol/L NaCl浓度下, 菜薹各项指标明显低于对照,因此将0、200、250、300 mmol/L NaCl作为菜薹不同材料抗性筛选的浓度梯度。
2.2 盐胁迫对生菜、菜薹抗性的影响
2.2.1 不同浓度盐胁迫下对不同材料生菜种子萌发的影响 试验进一步在0、50、100 mmol/L等3个NaCl浓度处理下分别对10个生菜材料种子萌发进行比较。从表1可以看出,随着NaCl胁迫浓度的升高,不同生菜材料的发芽率、发芽势、发芽指数均呈现下降的趋势,且不同材料间差异明显。NaCl浓度为50 mmol/L时,绿生菜中LG13的发芽率、发芽势、发芽指数分别为100.00%、91.67%、39.58,均明显高于其他生菜材料;紫生菜中LP14生菜的发芽率、发芽势、发芽指数分别为 91.67%、85.00%、33.11,与其他生菜材料也存在明显差异。当NaCl浓度升高为100 mmol/L时,LG1、LP24的各项发芽指标均降为0,而LG13的发芽率、发芽势、发芽指数分别高达81.67%、70.00%、25.20,LP14的发芽率、发芽势、发芽指数分别为58.33%、33.33%、11.80,与其他材料间差异显著。结果表明,盐胁迫下抗性较强的生菜材料为LG13、LP14,较敏感的材料为LG1、LP24。
2.2.2 不同浓度盐胁迫下对不同材料菜薹种子萌发的影响 不同浓度(0、200、250、300 mmol/L)的NaCl处理对10个菜薹材料的种子萌发试验结果(表2)表明, 不同菜薹材料的发芽率、发芽势、 发芽指数随着NaCl胁迫浓度的升高均呈现下降的趋势,且不同材料间差异明显。NaCl浓度为200 mmol/L时,绿菜薹中CG40的发芽率、发芽势、发芽指数分别为86.67%、78.33%、30.38,明显高于其他材料;紫菜薹中CP38的发芽率、发芽势、发芽指数分别为85.00%、76.67%、22.94,明顯高于其他材料。NaCl浓度为 250 mmol/L 时,绿菜薹中CG34的发芽率、发芽势、发芽指数均降为0,明显低于其他材料;CG40的发芽率、发芽势、发芽指数分别为76.67%、68.33%、14.69,显著高于其他材料;紫菜薹中CP38的发芽率、发芽势、发芽指数分别为75.00%、5667%、15.50,显著高于其他材料。当NaCl浓度升高为 300 mmol/L 时,绿菜薹中CG42的发芽率、发芽指数较高,分别为30.00%、4.17,CG40的发芽势显著高于其他材料;紫菜薹中CP38的发芽率、发芽势、发芽指数分别为61.67%、26.67%、10.11,显著高于其他材料。绿菜薹在盐胁迫下抗性较强的材料为CG40、CG42,较敏感的材料为CG34;紫菜薹在盐胁迫下抗性较强的材料是CP38。盐胁迫对紫菜薹的种子萌发影响较小, 紫菜薹比绿菜薹的耐盐性相对较强。
2.2.3 不同浓度盐胁迫对不同生菜材料幼苗生长的影响 不同生菜材料的主根长在NaCl胁迫下变化趋势有所差异(表3),绿生菜的LG9、LG13和紫生菜的LP14、LP18在低盐浓度下,可以促进主根生长,随着盐浓度的升高,主根生长表现出被抑制的现象,而其他几个材料的主根长在盐胁迫下均呈现下降的趋势。NaCl浓度为50 mmol/L时,绿生菜中LG13主根长较对照增长23%,显著高于其他材料;紫生菜中LP14主根长较对照增长22%。NaCl浓度为100 mmol/L时,LG1、LP24的主根长已降为0,而绿生菜中LG13主根长为 1.86 cm,显著高于其他材料;紫生菜中LP14主根长高达1.33 cm,与其他材料差异明显。
随着NaCl浓度的升高,生菜的上胚轴长、活力指数整体呈现下降的趋势(表3)。50 mmol/L NaCl处理时,绿生菜中LG13的上胚轴长较对照仅下降2.2%,活力指数较对照升高19.0%,且与其他材料间差异显著;紫生菜中LP14的上胚轴长较对照升高 37.5%,活力指数较对照下降4.4%,与其他材料间差异显著。NaCl浓度为100 mmol/L时,LG1、LP24的上胚轴长、活力指数已降为0,而LG13的上胚轴长、活力指数分别较对照下降42.0%、71.3%,LP14的上胚轴长、活力指数分别较对照下降 40.0%、82.6%,其他材料的上胚轴长、活力指数几乎都降为0。
试验结果表明,就幼苗生长情况而言,LG13、LP14的耐盐性较强,LG1、LP24较为敏感;整体而言,绿生菜与紫生菜的幼苗对盐胁迫的耐受性差异不明显。
2.2.4 不同浓度盐胁迫对不同菜薹材料幼苗生长的影响 从表4可以看出,菜薹的主根长、上胚轴长、活力指数随着NaCl胁迫浓度的升高均呈现下降的趋势。NaCl浓度为0 mmol/L时,绿菜薹中CG40主根长、上胚轴长、活力指数均明显高于其他材料。
NaCl 浓度为 200 mmol/L 时,绿菜薹中 CG40 主根长、上胚轴长较对照分别降低93.6%、78.0%,各项指标明显高于其他材料;紫菜薹中CP38主根长、上胚轴长较对照分别降低94.0%、81.8%,各项指标明显高于其他材料。NaCl浓度为250 mmol/L时,绿菜薹中CG40主根长、上胚轴长最长,分别为 0.28、0.64 cm,但与其他材料间差异不显著,活力指数明显高于其他材料;紫菜薹中CP38主根长与其他材料间差异不明显,但上胚轴长、活力指数明显高于其他材料;而CG34的主根长、上胚轴长、活力指数均已降为0。当NaCl浓度为300 mmol/L时,绿菜薹的CG40、CG42的主根长、上胚轴长、活力指数均明显高于其他材料;紫菜薹的CP38各项指标显著高于其他材料。试验结果表明,就幼苗生长情况而言,绿菜薹中CG40、CG42的耐盐性较强,CG34较为敏感;紫菜薹中CP38的耐盐性较强。整体而言,紫菜薹幼苗的对盐胁迫的耐受性比绿菜薹强。
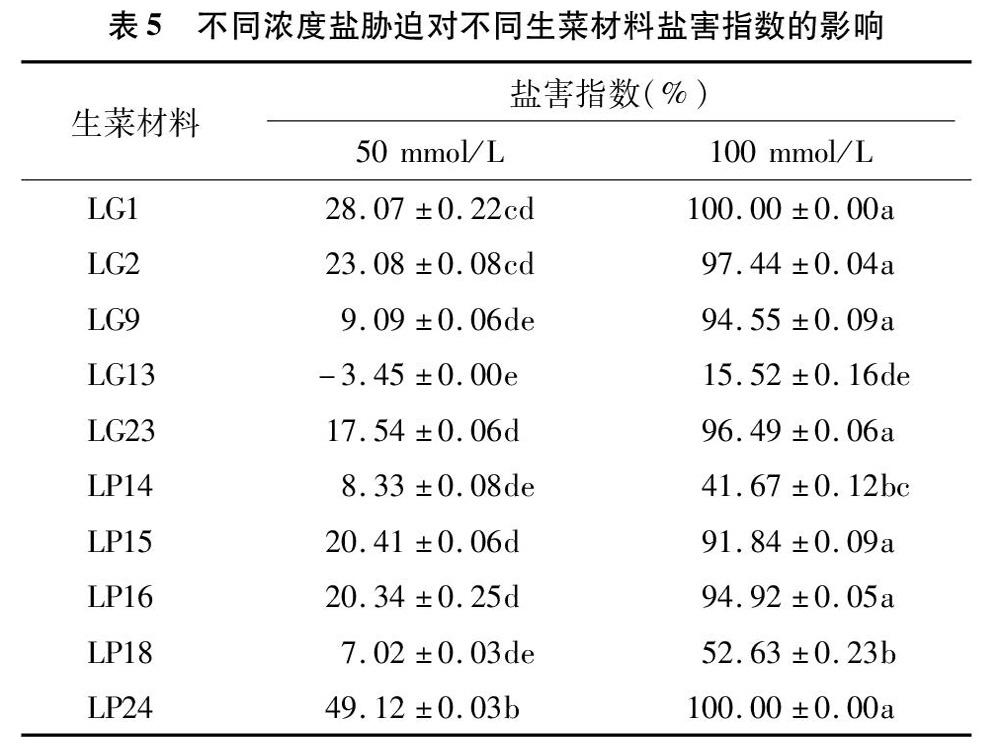
2.2.5 不同浓度盐胁迫对不同生菜材料耐盐指数的影响 试验结果(表5、表6)表明,不同物种对盐胁迫反应差异较大,同一物种不同材料间耐盐性也存在显著性差异。当NaCl浓度为50 mmol/L时,生菜材料LG13、LP18盐害指数明显低于其他材料,LP14次之,当NaCl浓度升高至100 mmol/L时,生菜材料LG13、LP14的盐害指数分别为15.52%、4167%,明显低于其他材料,而LG1、LP24的盐害指数高达100.00%。
2.2.6 不同浓度盐胁迫对不同菜薹材料盐害指数的影响 从表6可以看出,当NaCl浓度为200、250 mmol/L 时,菜薹材料CG40、CP38的盐害指数均明显低于其他材料,而CG34在NaCl浓度为 250 mmol/L 时盐害指数已达到100.00%;当NaCl浓度升高至300 mmol/L时,CP38的盐害指数最低,为15.91%,与其他材料间差异显著,CG42次之,盐害指数为58.14%,明显低于其他材料。大部分生菜材料在NaCl浓度为100 mmol/L时,盐害指数大于90%,而大部分菜薹材料在NaCl浓度为 300 mmol/L 时仍有一定的抗盐性,因此,菜薹的整体耐盐程度要明显高于生菜。
3 讨论与结论
植物生长发育评价指标主要有种子萌发指标,包括发芽率、发芽势、发芽指数、活力指数等以及苗期指标包括根长、苗高等[9],其中,发芽率、发芽势都是反映种子质量和活力的重要指标。发芽率反映种子发芽的数量,而发芽势反映种子发芽的快慢和整齐度[10-11]。发芽率在一定程度上能反映植物在发芽初期耐盐性的强弱[12]。生长抑制是植物对盐渍响应最敏感的过程[13]。上胚轴生长量是植物受害程度的一个常用外在表现指标,根系生长量与植物的抗逆性关系密切,可以衡量植物的生长状况[14]。
盐离子对种子萌发的影响分为离子效应及渗透效应,当盐离子浓度较低时,可满足植物自身的离子需求,促进种子萌发,而当盐离子浓度较高时,高浓度的NaCl胁迫会破坏细胞的内部系统,使细胞离子失衡、代谢紊乱、水势降低、种子吸水困难,引起种子毒害,种子活力下降[15]。相关研究发现,高粱、拟南芥在低浓度盐处理下,对种子的萌发抑制现象不明显,高浓度盐处理抑制现象显著[10,16]。而白菜、小白菜、蘿卜在低浓度盐处理下,可以促进种子萌发,高浓度盐处理下抑制种子萌发[17-19]。本试验结果表明,0~100 mmol/L NaCl可以促进菜薹的种子萌发,随着盐浓度升高,菜薹的种子萌发呈现出下降的趋势,当浓度达300 mmol/L时,菜薹种子基本无生长趋势,这与前人研究结果[17-19]基本一致。刘慧颖等研究发现,不同浓度的NaCl均能抑制冰菜种子萌发和植株的生长,且浓度越大,抑制效果越显著[20];李天星等的研究结果表明,花椰菜种子随着NaCl浓度的增大种子萌发率呈下降趋势,且不同浓度的NaCl对花椰菜幼苗的苗高、根的生长均具有显著的抑制效应[21]。本试验结果表明,随着NaCl浓度的不断提高,生菜种子的发芽势、发芽率、发芽指数、活力指数,幼苗的主根长与上胚轴长均呈下降趋势;菜薹幼苗的主根长、上胚轴长及种子的活力指数也呈下降趋势,这与刘慧颖等关于盐胁迫对种子发芽特性影响的研究结果[20-21]基本一致。
盐胁迫会对植物生长发育带来不利影响,植物对过量盐分的反应取决于不同的物种、基因型和暴露时间[22]。傅宗正等在盐胁迫下对5种紫色生菜进行研究发现,随着NaCl浓度的不断提高,不同品种紫色生菜种子对盐胁迫的反应结果有所不同,筛选出紫晶F1和特红皱2个耐盐性品种[15]。邱清华等的试验结果表明,供试的7个紫菜薹品种均有一定的耐盐性,其中早丰红菜薹及十月红紫菜薹的耐盐性较强,比较适合在新疆这种高盐的环境下引种栽培[23]。本试验筛选到耐盐性相对较强的2个生菜材料为LG13、LP14,较敏感的材料为LG1、LP24;耐盐性较强的菜薹材料有CP38、CG40、CG42,较敏感的材料为CG34。且生菜、菜薹对盐离子的耐受性有较大差异,同一物种不同基因型材料耐盐性也存在较大差异。
本研究发现,生菜、菜薹均表现出一定的耐盐性但也有一定差异,生菜在NaCl胁迫后,种子萌发、幼苗生长均呈现下降的趋势,耐盐性较弱;菜薹表现出低盐浓度促进生长,随着盐浓度的提高,表现出抑制生长的现象,具有一定的耐盐性。且紫菜薹比绿菜薹抗盐性强一些,紫生菜、绿生菜在盐胁迫下差异不大,本研究结果可以为生菜、菜薹耐盐种质创制和新品种遗传选育提供参考。由于本试验是在实验室采用培养基培养条件下进行的,与田间环境有一定的差异,试验结果仍须要继续进行田间验证。
参考文献:
[1]邵金彩,刘玉霞,杨佳鑫,等. 盐胁迫对蜡梅种子萌发及幼苗生长的影响[J]. 浙江农业学报,2017,29(7):1139-1143.
[2]Horie T,Kaneko T,Sugimoto G,et al. Mechanisms of water transport mediated by PIP aquaporins and their regulation via phosphorylation events under salinity stress in barley roots[J]. Plant and Cell Physiology,2011,52(4):663-675.
[3]Rengasamy P. Soil processes affecting crop production in salt-affected soils[J]. Functional Plant Biology,2010,37(7):613-620.
[4]Munns R,Richard A J,Luchli A. Approaches to increasing the salt tolerance of wheat and other cereals[J]. Journal of Experimental Botany,2006,57(5):1025-1043.
[5]Edward P G,Brown J J,Blumwald E. Salt tolerance and crop potential of halophytes[J]. Critical Reviews in Plant Sciences,1999,18(2):227-255.
[6]王 洁,孟秋峰,任锡亮,等. 十字花科作物耐盐种质研究现状及展望[J]. 现代农业科技,2019(12):60-61,63.
[7]肖明月,安 婧,纪占华,等. 六种常见抗生素对小白菜种子萌发及生理特性的影响[J]. 生态学杂志,2014,33(10):2775-2781.
[8]李娅娜. NaCl胁迫对不同品种黄瓜种子萌发的影响研究[J]. 种子科技,2017,35(12):152-153.
[9]张相锋,杨晓绒,焦子伟. 植物耐盐性评价研究进展及评价策略[J]. 生物学杂志,2018,35(6):91-94.
[10]杨 彬,张一中,柳青山. NaCl胁迫对高粱种子萌发特性的影响[J]. 山西农业科学,2012,40(7):709-711,715.
[11]郭春蕊,王广印,原让花. NaCl胁迫对辣椒种子发芽特性的影响[J]. 河南农业科学,2010,39(3):86-89.
[12]陈小梅,任 崴,马 林. 13个小麦品种(系)的耐盐性研究[J]. 新疆农业科学,2011,48(12):2211-2216.
[13]肖 雯,贾恢先,蒲陆梅. 几种盐生植物抗盐生理指标的研究[J]. 西北植物学报,2000,20(5):818-825.
[14]周 琦,祝遵凌,施 曼. 盐胁迫对鹅耳枥生长及生理生化特性的影响[J]. 南京林业大学学报(自然科学版),2015,39(6):56-60.
[15]傅宗正,张卫华. 盐胁迫对五种紫色生菜种子萌发特性的影响[J]. 黑龙江农业科学,2017(9):64-68.
[16]陆玉建,高春明,郑香峰,等. 盐胁迫对拟南芥种子萌发的影响[J]. 湖北农业科学,2012,51(22):5099-5104.
[17]杨 飞,郭海波,吴 菊,等. NaCl胁迫对白菜种子萌发及幼苗生长的影响[J]. 北方园艺,2014(1):26-29.
[18]王爱斌,徐芬芬,刘华伟. NaCl处理对不同品种小白菜种子萌发和根毛形态的影响[J]. 种子,2019,38(5):107-109.
[19]徐芬芬,徐秀芳. NaCl胁迫对萝卜种子萌发的影响[J]. 吉林农业科学,2012,37(4):48-50.
[20]刘慧颖,韩玉燕,蒋润枝,等. NaCl对冰菜生长发育及重要品质的影响[J]. 江苏农业科学,2019,47(15):184-188.
[21]李天星,梁建华. 盐胁迫对花椰菜种子萌发及幼苗生长的影响[J]. 江苏农业科学,2013,41(3):118-120.
[22]Munns R,Tester M. Mechanisms of salinity tolerance[J]. Annual Review of Plant Biology,2008,59:651-681.
[23]邱清华,邓绍云. 盐胁迫对七个品种紫菜薹种子萌发及幼苗生长的影响[J]. 北方园艺,2013(18):27-29.谢晓燕,吴芳芳,鄧肖任,等. 基于DEM数据对桂林市砂糖橘寒冻害分布规律的研究[J].

