潮间带大型海藻小珊瑚藻蛋白质提取方法及双向电泳体系优化
王小蓓 王秀静 李丽霞


关键词:小珊瑚藻;双向电泳;蛋白质;提取方法
蛋白质组学是以细胞内存在的全部蛋白质及其活动规律为研究对象,是继基因组学之后在分子水平上了解生命过程逻辑性的第2步,是后基因组时代生命科学研究的核心内容之一。蛋白质组学研究技术主要包括双向电泳技术、质谱分析技术和生物信息学技术等,其中,双向电泳技术是目前蛋白质组学研究的有效技术[1-2]。与陆地高等植物相比,有关海洋藻类的蛋白质组学研究相对滞后,但近年来该方面的研究日益兴起。程华民等探讨了2种不同方法提取珊瑚总蛋白质的差异[3];王会芳等研究了龙须菜的蛋白质提取条件及双向电泳的优化方案[4];Zou等研究了羊栖菜在重金属铜胁迫条件下差异蛋白的变化特征等[5]。小珊瑚藻(Corallina pilulifera),隶属于红藻门小珊瑚藻科,藻体直立丛生,具钙化特征,生活于中潮带岩礁上或石沼内,全藻可供药用。目前对其作用于赤潮微藻克生效应影响[6]、化学组成成分鉴定[7]、光合及钙化作用等已有一些研究报道[8],但迄今对于小珊瑚藻的蛋白质组学研究尚未见到相关报道。小珊瑚藻因其属钙化藻类,对海洋酸化有高敏感度,对小珊瑚藻蛋白质的研究必将会为海藻蛋白质的综合开发利用提供更多的选择[9]。
海藻蛋白有多种不同提取方式,不同的藻类所适合的蛋白提取方式不同。本研究以具有代表性的潮间带钙化海藻小珊瑚藻为试验材料,对常用的蛋白质提取方法,包括飽和酚抽提法、三氯乙酸(TCA)-丙酮沉淀法、Trizol提取蛋白法、Biozol提取蛋白法、饱和硫酸铵沉淀法进行全面比较及探索优化,筛选出蛋白质提取的最优方法,并从胶条pH值和分离胶浓度研究探讨双向电泳系统的优化方案,以期为潮间带大型海藻小珊瑚藻逆境蛋白质组学分析提供技术支撑,并为研究海洋红藻门其他海藻尤其是珊瑚藻目海藻的蛋白质组学研究提供重要参考。
1 材料与方法
1.1 试验材料
小珊瑚藻采集于山东省烟台市月亮湾潮间带,采样后立刻用消毒海水反复冲洗以去除可见的附生物及沉积物。约30 g小珊瑚藻(鲜质量)作为1个处理,培养于盛有3.5 L灭菌海水的玻璃缸中,玻璃缸直径为20 cm。海水持续充气并每日更换。经过3 d的预培养后,取材进行蛋白质的提取试验。
1.2 蛋白提取方法
取小珊瑚藻适量,加入液氮研磨成粉状,-80 ℃ 保存备用。采用如下5种方法来提取蛋白质。
1.2.1 饱和酚抽提法 饱和酚法基本参照Wang等的方法[10]并进行部分改进。
向适宜小珊瑚藻细粉中加入8 mL 10% TCA丙酮提取液,4 ℃,15 000 r/min离心20 min,去除上清液;加入10 mL预冷丙酮重复上一步骤1次;冰上干燥。加入4 mL酚抽提液[30%蔗糖,0.25 mol/L 三羟甲基氨基甲烷(Tris-HCl),pH值为8.0,0.05 mol/L 乙二胺四乙酸二钠,0.10 mol/L KCl,2%十二烷基硫酸钠(SDS),0.02 mol/L二硫苏糖醇(DTT)],混匀;加入4 mL Tris-丙酮-酚,在4 ℃条件下混匀1 h;4 ℃条件下,15 000 r/min离心 20 min,取上层酚层溶液于另一支15 mL离心管中,加入3倍体积的0.1 mol/L醋酸铵甲醇溶液,-20 ℃ 沉淀1 h;4 ℃ 下,15 000 r/min离心20 min取沉淀,加入 1 mL 丙酮(含0.02 mol/L DTT),4 ℃条件下,15 000 r/min 离心10 min,重复2次,收集沉淀;冷冻干燥,-20 ℃或-80 ℃保存备用。
1.2.2 TCA-丙酮沉淀法提取蛋白质 TCA-丙酮沉淀法基本参照Giavalisco等的方法[11]进行。
取适量海藻细粉在15 mL离心管中,加入3~4倍预先配好的提取液A(10% TCA 5 g+0.07%巯基乙醇35 μL+丙酮50 mL),摇匀后,放入-20 ℃冰箱中静置2 h,中间摇匀1次;4 ℃,12 000 r/min 离心30 min;弃上清液,加入提取液B(0.07% 巯基乙醇35 μL+丙酮50 mL),混匀,置于 -20 ℃ 冰箱中静置2 h,中间摇匀1次,4 ℃,12 000 r/min离心,30 min;重复1~2次;弃上清,冷冻干燥,置于 -20 ℃ 或-80 ℃保存备用。
1.2.3 Trizol提取蛋白法 Trizol法参照Lee等的方法[12]并进行部分改进。
向小珊瑚藻细粉中加入3 mL Trizol试剂,充分振荡使其反应完全,超声破碎5 min;在细胞匀浆中加入0.6 mL三氯甲烷,充分混匀;室温放置2~3 min;4 ℃条件下,12 000 r/min离心10 min;小心吸取并丢弃上层液体,保留中间层及有机相,加入0.9 mL无水乙醇,颠倒充分混匀;4 ℃条件下,3 200 r/min 离心5 min;小心吸取上层有机相,加入4.5 mL异丙醇,轻轻振荡后室温放置10 min;4 ℃条件下,12 000 r/min离心10 min;弃上清液,取沉淀,用清洗液(乙醇)清洗沉淀2~3次,4 ℃ 条件下,7 500 r/min 离心5 min;冷冻干燥,置于 -20 ℃ 或-80 ℃保存备用。
1.2.4 Biozol提取蛋白法 将Trizol提取蛋白法中的Trizol试剂替换成Biozol试剂,其他步骤同Trizol提取蛋白法。
1.2.5 饱和硫酸铵沉淀法 饱和硫酸铵沉淀法基本参照叶翠芳等的方法[13]进行。
取适量海藻细粉至4.5 mL离心管中,加入 2 mL 蛋白提取液(8 mol/L尿素,50 mmol/L维生素C,0.1 mol/L Tris,1 mmol/L乙二胺四乙酸(EDTA),1% β-巯基乙醇,0.5 mmol/L苯甲基磺酰氟,pH值为7.8),混合均匀后在4 ℃条件下存放过夜。4 ℃条件下,10 000 r/min离心20 min,去除沉淀,在冰浴条件下少量多次加入硫酸铵至饱和,4 ℃ 条件下存放12 h;4 ℃条件下,10 000 r/min离心20 min,弃上清液,取沉淀。向沉淀中加入 1.5 mL 裂解液,裂解液包含8 mol/L尿素、0.06 mol/L DTT、4% 3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS)、0.04 mol/L Tris-HCl,pH值为8.8,并且使沉淀悬浮。4 ℃条件下,10 000 r/min 离心 20 min,去除沉淀,保留上清液。
1.3 蛋白质裂解及浓度测定
将干燥的蛋白质干粉溶于样品裂解液[8 mol/L尿素、60 mmol/L DTT、4% CHAPS、40 mmol/L Tris-HCl、0.1%固相pH值梯度(IPG)缓冲液)],充分溶解蛋白质;室温下12 000 r/min離心15 min,取上清液,并再次离心,充分去除杂质。蛋白质浓度的测定采用Bradford法[14]。
1.4 双向电泳(two-dimensional electrophoresis,简称2-DE)
等电聚焦电泳(IEF)过程采用预制IPG胶条(17 cm、pH值为4~7),按照等电聚焦仪器IPGphor等电聚焦系统设定程序进行;蛋白质样品取100 μL左右(根据浓度及染色方法而定),取220 μL左右制备好的水化上样缓冲液(取出冷冻保存的水化液,室温解冻后,加入DTT 0.5 mg/100 μL 及固相pH值梯度缓冲液 0.5 μL/100 μL),吹吸混匀。取出聚焦槽,均匀加入混有样品的水化液,将胶条胶面朝下放入,被动吸收1 h;在胶条上覆盖1.5 mL矿物油,将胶条槽转移至IPGphor上,按表1中的参数进行聚焦。
等电聚焦电泳过程结束后, 将胶条分别置于含1% DTT和2.5%碘乙酰胺的平衡液(6 mol/L尿素,0.5 mol/L Tris-HCl,pH值为8.8,2% SDS,20%甘油)中分别平衡15 min;转移至分离胶浓度为 12.5%,厚度为1 mm的聚丙烯酰胺凝胶电泳(SDS-PAGE)胶上端,进行垂直板电泳;电泳完成后,取下凝胶,采用硝酸银染色法对凝胶进行染色。
1.5 图像扫描及分析
凝胶脱色后立即用Image Scanner扫描仪进行扫描,分辨率为300 dpi。图像采用PDQuest Advanced 8.0.1分析软件进行分析。
2 结果与分析
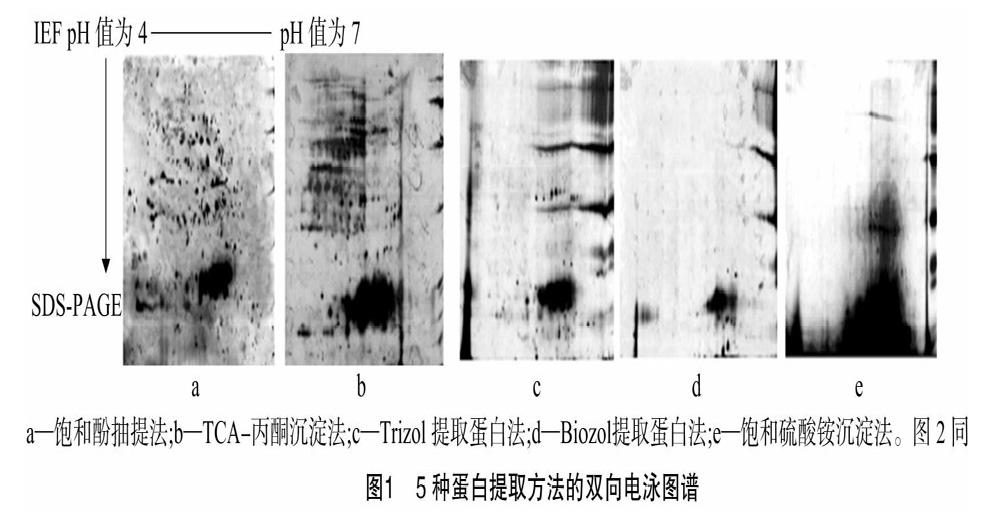
2.1 5种提取方法提取小珊瑚藻藻体总蛋白质的电泳图谱质量比较
本研究对常用的5种蛋白质提取方法的双向电泳图谱效果进行横向比较及质量分析。由图1可知,饱和硫酸铵沉淀法提取的小珊瑚藻蛋白质双向电泳图谱极不理想,有片状蛋白阴影出现,分离非常不彻底,双向电泳效果极差(图1-e)。Biozol提取蛋白法所得图谱在酸性区出现大片空白,几乎无蛋白质点出现,碱性区也只检测到数量十分有限的蛋白点(图1-d)。Trizol提取蛋白法可分离出标志性蛋白斑点,但蛋白质点数较少,在碱性区有较多横向条纹,影响蛋白质的分布及观察(图1-c)。TCA-丙酮沉淀法所得到的图谱分离效果较好,pH值分布范围较为合理,较饱和硫酸铵沉淀法、Trizol及Biozol提取蛋白法等3种方法酸性区蛋白质点明显增多且清晰,但仍有较多纵向、横向条纹(图1-b)。饱和酚抽提法图谱质量最高,蛋白纯度得到有效提升,在酸性区及碱性区聚焦均较好,能检测到的蛋白质点最多,且形状规则,无明显纵向、横向条纹,可以达到理想的分离效果(图1-a)。
2.2 5种提取方法所得图谱蛋白质点数量差异比较
5种提取方法所得小珊瑚藻电泳图谱蛋白质点数量见图2-A。由图可知,饱和硫酸铵沉淀法及Biozol提取蛋白法中损失了大量蛋白质,且杂质干扰过多,分离出的蛋白质点数量较少;Trizol提取蛋白法略好;TCA-丙酮沉淀法除杂效果较好,能检测到482个蛋白质点;相比上述方法,饱和酚抽提法使蛋白质得到最为有效的分离,且蛋白质中的杂质去除效果较理想,检测到的蛋白点数量为458。
2.3 5种提取方法提取小珊瑚藻总蛋白质浓度比较
研究表明,用不同的提取蛋白质方法所获得的小珊瑚藻蛋白质浓度不同(图2-B),TCA-丙酮沉淀法提取的蛋白质浓度最大,其次为饱和酚抽提法,但其差异并未达到显著水平(P>0.05),Trizol提取蛋白法、饱和硫酸铵沉淀法提取的蛋白质浓度与TCA-丙酮沉淀法、饱和酚抽提法相比均达显著水平(P<0.05),Biozol提取蛋白法提取的蛋白质浓度与TCA-丙酮沉淀法、饱和酚抽提法相比,蛋白质浓度差异达极显著水平(P<0.01)。
2.4 不同胶条pH值对蛋白质双向电泳结果的影响
试验设置2种不同pH值的胶条进行2-DE比对分析。胶条pH值为4~7时,蛋白点在图谱上分布均匀,分离情况良好,结果见图3-a;当胶条pH值为5~8时,由于酸性端pH值不足导致等电点较低的部分蛋白质并未得到有效分离,蛋白质点主要集中在左侧,且存在多点重叠现象,分离效果较差,仅得到189个蛋白质点(图3-b)。
2.5 不同分离胶浓度对蛋白质双向电泳结果的影响
研究2种不同的分离胶浓度对蛋白质分离效果的影响,结果见图4。当分离胶浓度为12.5%时,得到289个蛋白质点,蛋白质点形状规则且分布情况良好(图4-a);当分离胶浓度为10.5%时,仅得到93个蛋白质点,蛋白质点分布靠近图谱边缘,低分子量蛋白质无法分离得到(图4-b)。
3 讨论与结论
蛋白质是构成生命的四大基本物质之一,海藻蛋白质的开发利用是学者们研究的热点领域。蛋白质样品的制备是双向电泳成功的前提[15-17],采用不同方法提取的蛋白质电泳效果会有显著不同,尤其对于富含色素、多酚、多糖等次生代谢产物的海洋材料来说,其蛋白质样品的高效、高质量制备显得尤为困难。不同种类的海藻,其蛋白质含量也有所不同。通常绿藻和红藻蛋白含量高于褐藻,一般情况下红藻的蛋白质含量范围为10%~47%[18-19]。
海藻蛋白质有多种提取方式,不同的藻类所适合的蛋白质提取方式不尽相同,由于本研究的试验材料小珊瑚藻具有明显的钙化特征[20],且藻红素色素含量较高等特殊性质,因此,不能简单借鉴其他海藻材料的某一种蛋白质提取方法,有必要对常见的几种蛋白质提取方式同时进行综合比较及改良优化。赵宇鹏等比较了硫酸铵沉淀法、TCA/丙酮法及酚提取法对条斑紫菜叶状体总蛋白的提取效果,发现酚提取法能有效去除杂质,得到最理想的电泳图谱[21],本研究的试验结果与之相似。
Trizol法和Biozol法是提取植物中RNA的常用方法,也有学者将其创新性地用于蛋白质的提取中[4,12]。苯酚、异硫氰酸胍是Trizol的主要成分,可使细胞裂解,蛋白质、核酸等物质快速从细胞释放。加入三氯甲烷后并离心后,溶液分为含有RNA的水相、含有DNA和蛋白質的中间层和有机相。取出水相,用异丙醇可沉淀回收RNA,用乙醇沉淀可回收中间层DNA,用异丙醇沉淀可回收有机相中的蛋白质并能够去除蛋白质中的水分。本研究中,Trizol提取蛋白法与Biozol提取蛋白法也可获得小珊瑚藻蛋白质,但所提取的小珊瑚藻蛋白质浓度及纯度均不理想,且由于Trizol试剂与Biozol试剂价格因素,因此这2种提取方式不提倡使用。
饱和硫酸铵沉淀法提取的小珊瑚藻蛋白质测得的浓度虽然较高,但电泳图谱出现大量蛋白阴影,只能得到个别蛋白斑点,说明所提取的蛋白质纯度很低,其原因可能是饱和硫酸铵沉淀法提取的小珊瑚藻蛋白质所含盐分及钙质过多,透析无法清除,因此对双向电泳影响较大,该法不适合提取小珊瑚藻蛋白质。
由Bradford法测定的小珊瑚藻蛋白质浓度和双向电泳图谱可知,饱和酚抽提法提取小珊瑚藻蛋白质为最优方法,蛋白质分离良好,图谱背景较为清晰,无明显纵横条纹,说明此方法提取的蛋白质浓度高且纯度较高。相比之下,TCA-丙酮沉淀法提取的蛋白质图谱中纵横条纹稍多,但其具备简单方便的优点,亦可作为小珊瑚藻蛋白质提取方法的选择之一。
胶条pH值及SDS-PAGE分离胶的浓度是影响双向电泳的结果的重要因素。胶条pH值范围对蛋白质的双向电泳的分离效果会产生显著影响,pH值范围不合适导致蛋白质有部分重叠,甚至会丢失某些蛋白质。本研究结果表明,胶条pH值为4~7时,蛋白质点在凝胶上分离情况较好,蛋白质点分布均匀,蛋白质点之间重叠较少且彼此之间界限明显,从而可以分离得到更多的蛋白质点,电泳分辨率得到较好提升,此结论与梁文裕等学者的研究结果[22-23]基本一致。
不同的分离胶浓度使蛋白质的分离效果亦有一定差异,须要根据实际情况选择较为合适的分离胶浓度。本研究结果表明,分离胶浓度为12.5%时对小珊瑚藻的蛋白质点分离效果优于分离胶浓度为 10.5% 时。当分离胶浓度较低时,蛋白质点的电泳位置靠近凝胶底端,较多低分子量的蛋白质被丢失,从而在凝胶上不能显示,这与王会芳等的研究结果[4]较为一致。因此,分离胶浓度为12.5%时更适合小珊瑚藻总蛋白双向电泳的分离。
综上所述,本研究对小珊瑚藻总蛋白提取及 2-DE电泳条件进行了一系列优化,建立了一套适合小珊瑚藻总蛋白的2-DE体系,为小珊瑚藻蛋白质组的研究奠定了有效基础,同时亦可为其他红藻门大型海藻蛋白质组学研究提供重要的参考依据。
参考文献:
[1]Cuder B,Bell D J,Birrell H C,et al. An integrated proteomic approach to studying glomerular nephrotoxicity[J]. Electrophoresis,1999,20(18):3647-3658.
[2]Grg A,Obermaier C,Boguth G,et al. The current state of two-dimensional electrophoresis with immobilized pH gradients[J]. Electrophoresis,2000,21(6):1037-1053.
[3]程华民,杨婷寒,项 楠,等. 不同方法提取珊瑚总蛋白质的比较[J]. 热带生物学报,2017,8(2):225-231.
[4]王会芳,颜海波,杜 虹. 大型海藻龙须菜蛋白提取及双向电泳体系的优化[J]. 汕头大学学报(自然科学版),2013,28(4):34-39,80.
[5]Zou H X,Pang Q Y,Zhang A Q,et al. Excess copper induced proteomic changes in the marine brown algae Sargassum fusiforme[J]. Ecotoxicology and Environmental Safety,2015,111:271-280.
[6]王仁君,唐学玺,孙俊华. 小珊瑚藻对赤潮异弯藻的化感效应[J]. 应用生态学报,2008,19(10):2322-2326.
[7]刘广发,林均民,林 枫. 小珊瑚藻藻红蛋白提取及其稳定性研究[J]. 海洋科学,2006,30(11):23-27.
[8]徐智广,李美真,霍传林,等. 高浓度CO2引起的海水酸化对小珊瑚藻光合作用和钙化作用的影响[J]. 生态学报,2012,32(3):699-705.
[9]郑仰桥. CO2浓度和阳光紫外辐射变化对珊瑚藻生理生化的影响[D]. 汕头:汕头大学,2009.
[10]Wang W,Scali M,Vignani R,et al. Protein extraction for two-dimensional electrophoresis from olive leaf,a plant tissue containing high levels of interfering compounds[J]. Electrophoresis,2003,24(14):2369-2375.
[11]Giavalisco P,Nobrdhoff E,Lehrdc H. Extration of proteins from plant tissues for two-dimensional electrophoresis analysis[J]. Electrophoresis,2003,24(1/2):207-216.
[12]Lee F F,Lo S L. The use of Trizol reagent(phenol/guanidine isothiocyanate for producing high quality two-dimensional gel electrophoretograms(2-DE)of dinoflagellates[J]. Journal of Microbiological Methods,2008,73(1):26-32.
[13]叶翠芳,杨 珂,张美英,等. 藻胆蛋白的提取、纯化及其体外抗紫外活性[J]. 暨南大学学报(自然科学与医学版),2013,34(5):522-526.
[14]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1):248-254.
[15]Xie C J,Wang D,Yang X Y. Protein extraction methods compatible with proteomic analysis for thecotton seedling[J]. Crop Science,2009,49(2):395-402.
[16]Wang D Z,Lin L,Leo L C,et al. Comparative studies of four protein preparation methods for proteomic study of the dinoagellate Alexandrium sp. using two-dimensional electrophoresis[J]. Harmful Algae,2009,8(5):685-691.
[17]Wang W,Vignani R,Scali M,et al. A universal and rapid protocol for protein extraction from recalcitrant plant tissues for proteomic analysis[J]. Electrophoresis,2006,27(13):2782-2786.
[18]Morgan K C,Wright J C,Simpson F J. Review of chemical constituents of the red alga Palmaria palmate(dulse)[J]. Economic Botany,1980,34(1):27-50.
[19]閏秋丽,郭兴凤. 海藻蛋白研究及应用进展[J]. 食品研究与开发,2008,29(1):179-1812.
[20]高坤山. 珊瑚藻类钙化的研究[J]. 海洋与湖沼,1999,30(3):290-294.
[21]赵宇鹏,周 伟,赵佩佩,等. 适用于条斑紫菜的双向电泳样品制备方法[J]. 海洋科学,2013,37(5):19-24.
[22]梁文裕,王 星,焦广飞,等. 发菜蛋白质组双向电泳技术的建立及优化[J]. 西北植物学报,2009,9(8):1550-1556.
[23]杨德明,张娅欣,沈少炎,等. 福建柏叶片蛋白质双向电泳技术优化[J]. 森林与环境学报,2017,37(1):54-59.李 平,李潇蒙,龙清孟,等. 贵州黑山羊BMP15基因多态性及生物信息学分析[J]. 江苏农业科学,2020,48(9):77-81.

