健脾合剂对脾虚腹泻型肠易激综合征小鼠肠道菌群的干预研究*
连秋华,朱惠萍,梁国强,张 川,丁姮月,孙宏文**
(1.南京中医药大学 南京 210000;2.南京中医药大学附属苏州市中医医院苏州 215000;3.苏州市中医医院吴门医派研究院 苏州 215000)
肠易激综合征(Irritable bowel syndrome,IBS)作为一种功能性肠病,以腹痛、腹胀不适伴有排便习惯、大便性状改变为特征。该病发病率较高,对患者的生活质量及社交活动有明显的负面影响,关于该疾病的发病机制尚未完全明确,当前认为该疾病的发病因素主要以遗传因素、胃肠道功能异常、内脏高敏性、肠道炎症与免疫功能障碍、脑-肠轴反馈异常为主[1]。既往传统的观念认为,IBS是一种功能性肠病,但越来越多的研究发现IBS的发病模式是一种免疫-炎症模式,其病理状态是微生物导致的肠道局部、持续、低级别的炎症反应。在我国医学中,根据IBS-D的临床表现可归属为“泄泻”、“腹痛”等范围。中医认为,泄泻的基本病机为脾虚湿盛,其病位在肠,主病之脏属脾。其中,脾虚型是IBS-D的主要证型,健脾在IBS-D的中医治疗中占有重要的地位。近年的研究显示对IBS尤其是IBS-D用药以健脾化湿药物为主[2]。有文献报道,加味四君子汤可改善脾虚型IBS-D患者的主要症状,作用慢但效果优,且效率稳定,值得临床推荐[3]。四君子汤能显著提高脾虚小鼠肠道内的菌群多样性,尤其有助于双岐杆菌和乳杆菌的恢复[4]。
目前,对肠道微生态与疾病关系的研究方法主要包括:传统的粪便细菌培养计数、变性梯度凝胶电泳(DGGE)、温度变性梯度凝胶电泳(TGGE)、实时定量荧光PCR,以及灵敏度很高的高通量测序和全基因组测序等。本文运用四君子汤加味制成的健脾合剂治疗脾虚腹泻型肠易激综合征(IBS-D)小鼠,而后采用16SrDNA高通量基因测序法观察、分析健脾合剂对小鼠肠道菌群结构的干预作用。
1 实验材料及方法
1.1 实验动物
1.1.1 分组
选择清洁级幼龄ICR雄性小鼠48只,体重(20±2)g,适应性喂养3天后,随机分为四组(n=12):空白组、模型组、西药组、中药组。
1.1.2 造模
造模前每日定时观察记录小鼠大便性状改变,饮食情况,测量体重,记录一般情况。对空白组以外的三组小鼠予以100%番泻叶冰水浸液以10 ml/kg小鼠体积灌胃,每天2次,连续10天,期间喂食不定时,制定脾虚型IBS-D模型。
1.1.3 IBS-D动物模型标准[5]
主症:①泄泻严重,甚至脱肛;②食少,纳呆。次症:①消瘦、体重减轻;②神态萎靡,四肢不收,毛色枯槁;③蜷缩聚堆;④易疲劳。当具备其中两项主症,两项次症即可确认脾虚型IBS-D造模成功。
1.2 实验用药
本实验用药具体如下:
健脾合剂:苏州市中医医院自制制剂(组方党参、白术、茯苓、炙甘草、陈皮、山药),批号:171205。
复合乳酸菌胶囊:江苏美通制药有限公司,批号:180106。
戊巴比妥钠:上海化学试剂采购供应站分装厂提供(sigma公司生产),批号:20089104。
番泻叶(统货,广东):苏州市春辉堂药业有限公司,批号:170909。
1.3 给药方法
模型复制评价成功后,空白组、模型组两组以双蒸水10 ml·kg-1的体积灌胃。西药组以10 ml·kg-1的体积灌胃复合乳酸菌(0.026 g·ml-1的混悬液),即0.26 g·kg-1小鼠;中药组以16 ml·kg-1体积灌胃健脾合剂药液,给药周期均为14天。
1.4 观察及检测指标
1.4.1 大便性状、体重、饮食的记录
在实验期间,每天定时记录造模前后小鼠的大便性状、饮食及体重。
1.4.2 小鼠肠道菌群的检测
标本的采集:无菌操作置于干冻管中,放置于-80°的冰箱保存。
样本的标记:空白组、模型组、西药组及中药组治疗后粪便分别标记为B1、B2、B3、B4。
标本的处理:取出冷藏的样本,常温复溶。称取样本重量;匀浆的比例为10%(即1 g粪便加9 ml匀浆液);匀浆液选取PBS(PH=7.2-7.4,浓度为0.01 mol/L);采用组织匀浆器,冰浴上匀浆;离心转速选用5000转/分,时间为15 min,取上清液待检。
1.5 实验方法
对所有样本进行miseq文库制备(基因组DNA提取,PCR扩增,AxyPrepDNA凝胶回收试剂盒回收,及FTC-3000 TM real-time PCR仪进行实时荧光定量),然后进行16SrDNA高通量测序,根据测序结果进行生物信息学分析。
1.6 数据的统计及处理
采用R3.4.1语言作图软件剖析肠道菌群;SPSS 22进行统计分析,数据在图中以均值±标准误(SE)的形式绘制。采用wilcox、Ttest分析比较各组之间的差异。当P<0.05时可判断为具有差异显著性。
2 实验结果
2.1 大便性状、体重、进食量的记录
每天监测并记录小鼠大便性状、进食量,可知中药组、西药组在给药后,泄泻情况都有所好转,模型组小鼠粪便依然偏稀、不成形,毛发灰暗,性情躁动。中药组、西药组毛发相对模型组毛发、行为状态有所改善。西药组粪便在7天后开始正常,中药组的粪便成形但是水分较多。监测并记录小鼠体重后经统计后得出表1:在给药第7天、第14天中药组、西药组体重均高于模型组,中药组、模型组比较具有显著性差异(P<0.05);给药第7天、第14天中药组、西药组体重在均低于空白组且具有显著性差异(P<0.05)。
表1 各组实验过程中各阶段的体重变化比较n=12
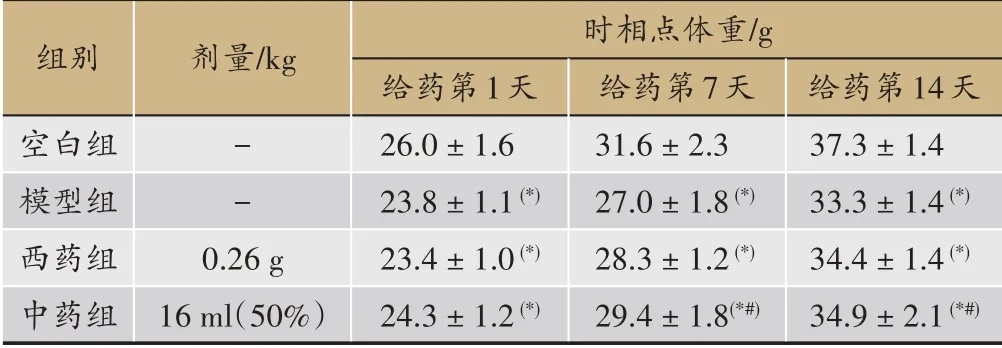
表1 各组实验过程中各阶段的体重变化比较n=12
注:与空白组比较*P<0.05,与模型组比较#P<0.05。
组别空白组模型组西药组中药组剂量/kg 时相点体重/g给药第1天26.0±1.6 23.8±1.1(*)23.4±1.0(*)24.3±1.2(*)--0.26 g 16 ml(50%)给药第14天37.3±1.4 33.3±1.4(*)34.4±1.4(*)34.9±2.1(*#)给药第7天31.6±2.3 27.0±1.8(*)28.3±1.2(*)29.4±1.8(*#)

图1 20例样本细菌DNA电泳图
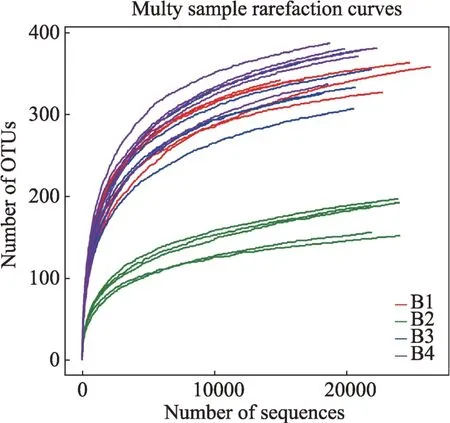
图2 20例样本的稀释性曲线

图3 20例样本的丰度等级图
2.2 样本的基因DNA质控
采用QIAamp DNA Stool Mini Ki方法对样本进行基因组DNA提取,然后分别取3µL进行1.2%琼脂糖凝胶电泳检测,结果图1,成像后得到的条带,清晰单一,片段长度与预期片段一致,且浓度适中,负对照无污染,表明提取的样品DNA完整度良好。
2.3 四组小鼠的DNA测序序列结果分析
2.3.1 四组小鼠肠道菌群多样性的分析
本次测序是对≥97%水平的OTU进行生物信息统计分析,为了验证测序数据量是否充分以反映样品物种多样性,使用mothur软件进行稀释性曲线(Rarefaction curve)的绘制(见图2)。
稀释曲线是用来评价测序量是否合理。曲线越平缓,表明测序深度越充分;反之,则表明仍存在较多未被测序检测到的物种。从图2可以看出,所有测序量在1000左右出现了明显的转折点,而后进入平台期,表明测序已趋于饱和,增加测序数据无法再找到更多的OTU,本次测序深度充分,样品均具有较好的丰富度。
为了验证本次样品细菌的多样性达到本次实验的要求,进行了丰度等级图(Rank-Abundanc)的绘制(见图3),丰度等级图主要反映样品多样性的两个方面:样品所含物种的丰富程度、均匀程度。曲线越宽,则物种丰富程度越高;曲线越平缓,则物种均匀程度越高。从图3可以看出,大部分样品的曲线水平方向较宽,下降趋势较平缓,说明20例样本中细菌的丰度和均匀度都较为合理。
2.3.2 各组小鼠肠道生物多样性的对比
生物多样性主要采用基于OTU聚类结果进行Alpha多样性分析的方法,Alpha多样性包括chao指数(见图4)、ace指数(见图5),shannon指数(见图6)以及simpson指数(见图7)等。其中,chao指数、ace指数主要解释样品中群落的丰富度,而shannon指数、simpson指数解释群落的多样性。使用单因素方差分析方法从chao指数、ace指数、shannon指数、simpson指数四个方面比较。结合图4、图5、图6、图7可以看出这20例样本中生物物种丰富度及多样性均较高。
根据四组小鼠之间的差异,分别绘制了柱状图(见图8),从图8中可以看出B1、B3、B4组物种的丰富度及多样性比B2组高(P<0.05);B1、B3、B4相比,物种的丰富度及多样性差异无统计学意义(P>0.05)。

图4 20例样本的chao指数曲线

图5 20例样本的ace指数曲线

图6 20例样本的shannon指数曲线
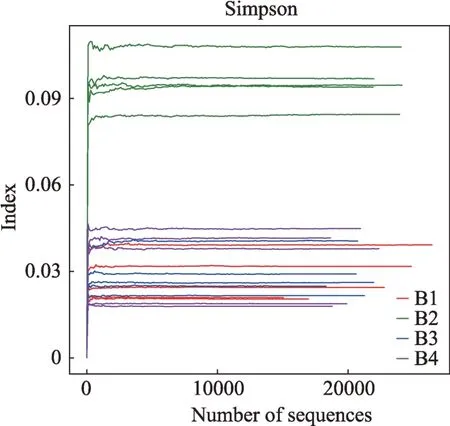
图7 20例样本的simpson指数曲线
2.3.3 四组小鼠肠道菌群的物种信息及差异分析
根据物种信息分类学分析结果可知,一个或数个样品在不同生物学分类水平上的对比情况。采用统计学方法,观测并分析样品在门、纲、目、科、属、种这6个不同生物种类水平上的群落结构。
2.3.3.1 四组小鼠肠道菌群门水平上的分布及差异根据检测结果,除了未分类的菌门,治疗后小鼠门水平上相对丰度最大的前九个门分别是:Bacteroidetes、Firmicutes、Proteobacteria、Verrucomicrobia、Saccharibacteria、Deferribacteres、Actinobacteria、Tenericutes、Cyanobacteria。经物种差异分析后统计得出表2。观察表2可知,B1、B2相比,B2组Proteobacteria、Verrucomicrobia丰度上调(P<0.05);Firmicutes、Saccharibacteria、Tenericutes、Cyanobacteria丰度下调(P<0.05)。B2、B3相比,B3组Bacteroidetes、Saccharibacteria、Tenericutes、Actinobacteria丰度上调(P<0.05);Proteobacteria、Verrucomicrobia丰度下调(P<0.05)。B2、B4相比,B4组Tenericutes、Actinobacteria、Saccharibacteria丰度上调(P<0.05);Proteobacteria丰度下调(P<0.05)。B3、B4组相比,各优势菌门均无明显差异(P>0.05)。
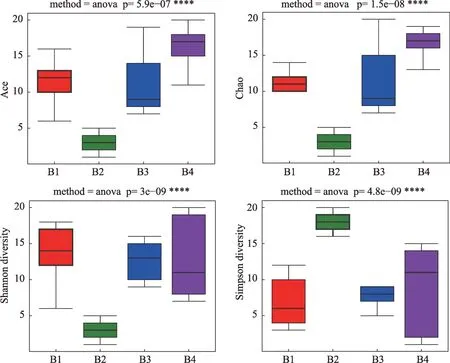
图8 四组间样本Alpha多样性指数差异分析
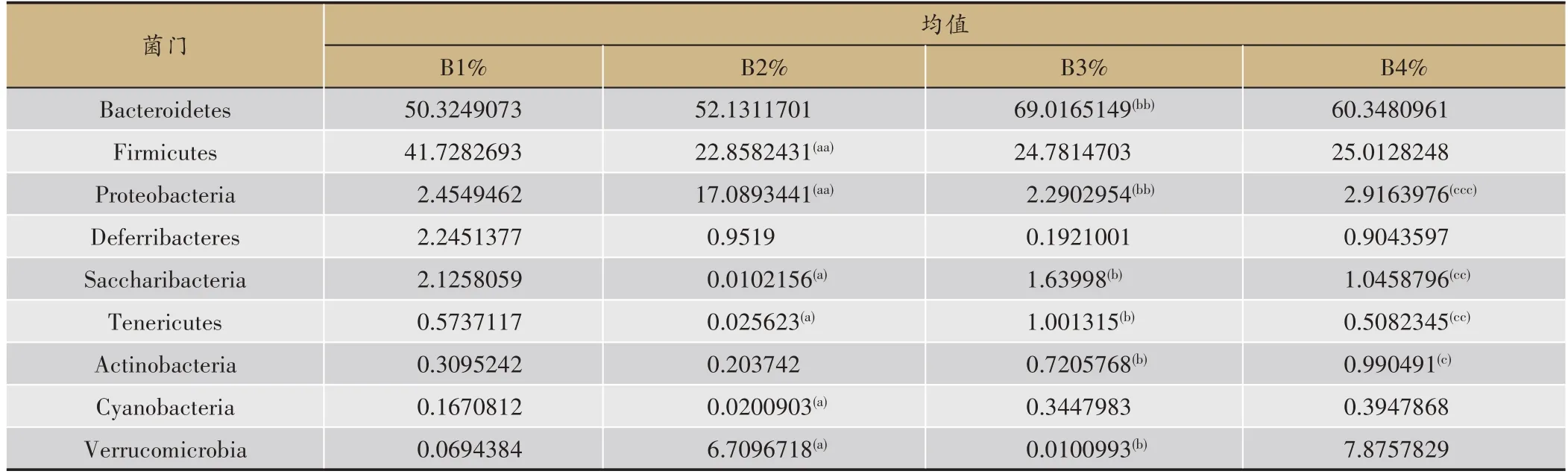
表2 四组小鼠样本在门水平的物种差异分析
2.3.3.2 各组小鼠肠道菌群在属水平上的分布及差异 在属水平上进行四组小鼠肠道菌群的比较,一共获得126种菌属。其中拥有较高丰度的菌属是:Unclassified、Bacteroides、Helicobacter、Akkermansia、Alistipes、Lactobacillus、Escherichia、Anaerotruncus、Parasutterella、Mucispirillum、Erysipelatoclostridium等。通过组间群落显著性差异分析(Metastats),选择P<0.05的物种进行三线表的绘制(见表3)。由表3可知,B1、B2相比,B2组Bacteroides、Parasutterella、Escherichia、Erysipelatoclostridium、Akkermansia、Parabacteroides、Candidatus-Stoquefichus、Anaerofustis丰 度 上 调(P <0.05);Alistipes、Ruminiclostridium、Candidatus-Saccharimonas、Rikenella、Desulfovibrio、Intestinimonas、Roseburia、Lachnoclostridium、Oscillibacter、Ruminococcus、Coprococcus、Peptococcus丰度下调(P<0.05)。B2、B3相比,B3组Alistipes、Ruminiclostridium、Candidatus-Saccharimonas、Rikenella、Desulfovibrio、Intestinimonas、Roseburia、Lachnoclostridium、Oscillibacter、Blautia、Ruminococcus、Coprococcus、Enterorhabdus、Parvibacter、Peptococcus、Syreptococcus、Papillibacter丰度上调(P<0.05);Lactobacillus、Bacteroides、Parasutterella、Escherichia、Erysipelatoclostridium、Akkermansia、Caproiciproducens、Parabacteroides、Candidatus_Stoquefichus丰度下调(P<0.05)。B2、B4相比,B4组Alistipes、Ruminiclostridium、Candidatus-Saccharimonas、Rikenella、Intestinimonas、Lachnoclostridium、Oscillibacter、Coprococcus、Faecalibaculum、Enterorhabdus、Peptococcus、Romboutsia、Papillibacter丰度上调(P<0.05);Lactobacillus、Bacteroides、Parasutterella、Escherichia、Erysipelatoclostridium、Parabacteroides、Candidatus-Stoquefichus丰度下调(P<0.05)。B3、B4相比,B4组Helicobacter、Faecalibaculum丰度上调(P<0.05);Candidatus-Arthromitus丰度下调(P<0.05)。

表3 四组小鼠样本在属水平的物种差异分析
为了更进一步的分析各组间肠道菌群的组成及其各个物种的分布差异的大小,同时找出各组的优势菌群,采用了组间群落差异分析(多组间差异物种差异比较,LDA Effectt Size),该分析方法可实现多个分组之间的比较,并且能够进行分组内部进行亚组比较分析,从而找到各组样本中发挥主要作用的菌属以及组间在丰度上有显著差异的物种(即Biomarker)。使用LEfSE软件进行LEfSE树形图绘制,见图9。可以发现B1组中发挥主要作用且与其他组具有差异的是:Rikenellaceae、Uncultured-organism、Lactobacillaceae、Lactobacillales、Bacilli、Lachnospiraceae、Peptococcaceae、Clostridiales、Clostridia、Firmicutes。B2组中发挥主要作用且与其他组具有差异的是:Bacteroidaceae、Porphyromonadaceae、Enterococcaceae、Erysipelotrichaceae、Erysipelotrichales、Erysipelotrichia、Alcaligenaceae、Burkholderiales、Betaproteobacteria。B3组中发挥主要作用且与其他组具有差异的是:Coriobacteriaceae、Coriobacteriales、Coriobacterii、Bacteroidales、Bacteroidetes、Christensenellaceae、Desulfovibrionales、Desulfovibrionaceae。B4组中发挥主要作用且与其他组具有差异的是:Bifidobacteriaceae、Bifidobacteriales、Actinobacteria、Prevotellaceae、Cyanobacteria、Peptostreptococcaceae、Clostridiales、 Rhodospirillaceae、 Rhodospirillales、Alphaproteobacteria。
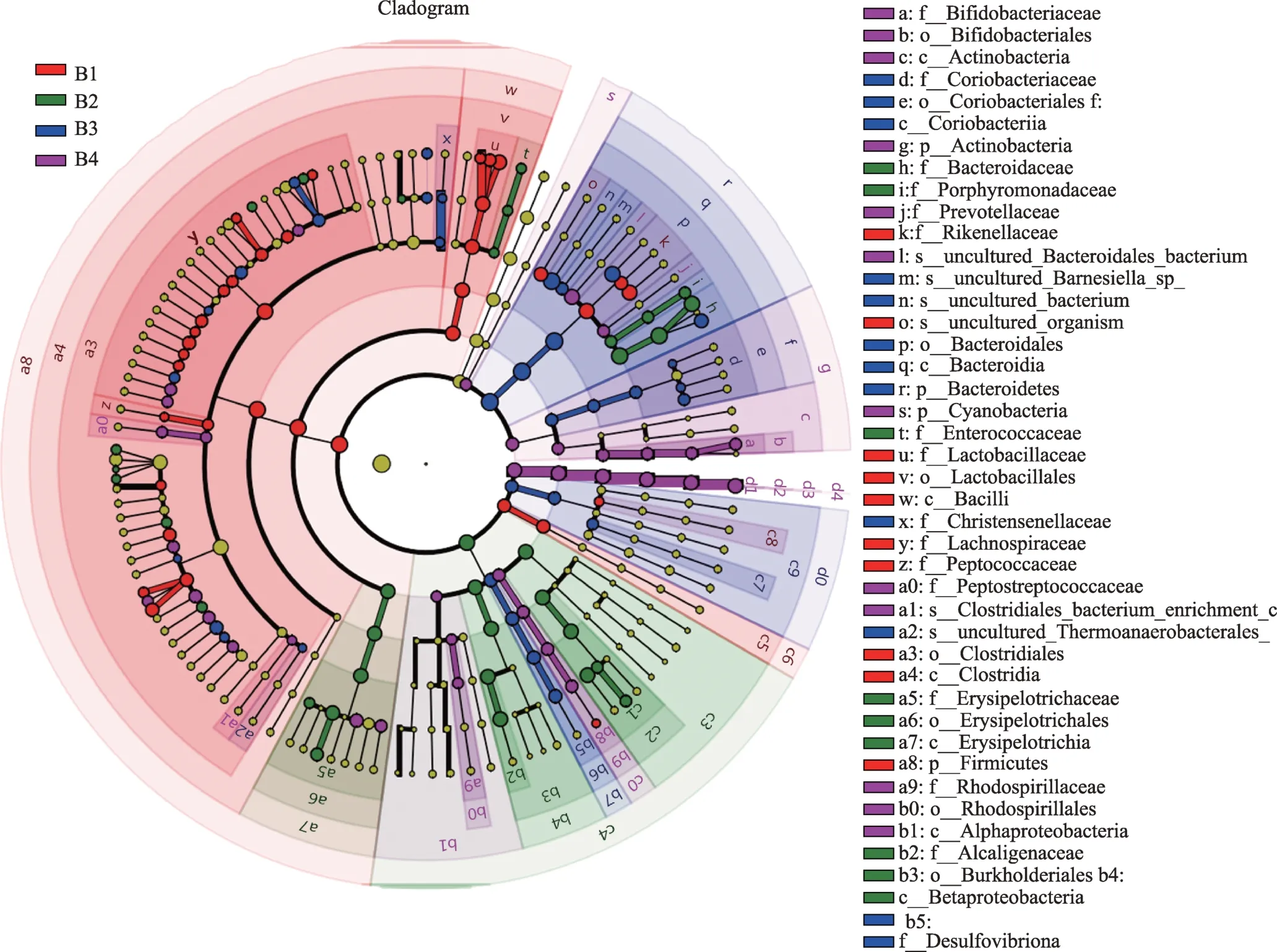
图9 B组间肠道结构存在的差异性
3 讨论
肠易激综合征(Irritable bowel syndrome,IBS)作为功能性肠病,内脏髙敏感、胃肠道动力异常、食物不耐受和肠道菌群紊乱、精神心理异常、肠道感染、脑-肠轴功能异常、遗传因素等多种因素参与IBS的发病[6]。目前,肠道微生态失衡是研究的一大热点,也是目前治疗胃肠道疾病的新靶点。
人体体表和体内分布的共生微生物有80%生活在消化道内,其种类超过1000种,重量可达2 kg,细胞总数超过1014个,约为人体自身细胞数量的1.3倍[7]。这些微生物的数量与基因总数如此庞大,必定会影响人体的身体健康状况。肠道中的微生物可构筑肠道生物屏障,帮助人体消化吸收,合成各种营养物质及维持肠道免疫功能,从而维持生态系统的平衡。当肠道菌群发生紊乱,从而使这种平衡被打破,人体就可能患上各种疾病。
随着当代中医药工作者的深入研究,中医中药与微生态的本质联系将逐步被揭示出来,如中医的整体观、阴阳学说、天人相应、正邪交争、阴阳失调及脏腑学说等诸多方面均涵盖着与肠道微生态学相关的内容[8]。
健脾合剂是苏州市中医医院的自制品种,名老中医黄一峰的经验方,由四君子汤加味而成,主要药物为党参、白术、茯苓、甘草、陈皮、山药,具有健脾养胃,助运化滞的作用,适用于脾胃虚弱、胃纳不香,临床发现其治疗IBS-D也有不错的疗效。党参具有补脾肺气、生津补血的作用。有研究发现,党参多糖和党参皂苷能促进肠道中益生菌属的生长,抑制病原菌的定植,下调Firmicutes与Bacteroidetes比值(F/B),从而恢复了肠道内稳态[9]。白术具有健脾益气的作用。叶清清等[10]研究发现白术能显著促进嗜酸乳杆菌的增殖,并抑制大肠埃希菌的增殖。茯苓具有淡渗利湿、健脾宁心的功效。现代药理研究发现,茯苓对常见的大肠杆菌、金黄色葡萄球菌和绿脓杆菌等均有很好的抑制作用[11]。甘草具有补中益气、缓急止痛、调和诸药的作用。有研究发现,高剂量的甘草水提物可以下调拟杆菌门、变形菌门和脱硫弧菌的比例,上调厚壁菌门的比例[12]。陈皮以理气为专长,兼有燥湿化痰,开胃消食的作用。现代研究表明,陈皮对胃肠道自发活动有一定的抑制作用,且能明显拮抗组胺或乙酰胆碱引起的肠道的收缩痉挛,还具有一定的抗过敏作用,这些作用是陈皮理气健脾、燥湿化痰的药理学基础之一[13]。山药具有补脾养胃、益气止泻的作用。山药多糖可以调节肠道菌群,长期灌胃山药多糖可以抑制肠杆菌与肠球菌的菌群数量,促进益生菌双歧杆菌和乳杆菌的增殖[14]。综上所述,健脾合剂具有益气健脾、渗湿止泻的作用,其机制可能与其调节肠道微生态的作用相关。
通过不同分类学水平的菌群分析,查找健脾合剂和复合乳酸菌干预后脾虚型IBS-D小鼠肠道菌群结构、多样性的具体差异。实验结果表明,通过稀释曲线比较样品的物种多样性,发现造模后肠道菌群多样性减少。Carroll等通过调查IBS-D患者的粪便和结肠黏膜,发现其微生物群落明显和正常对照组不同,且粪便样本中微生物多样性明显减少[15],本研究结果与文献报道一致。王卓等[16]通过ERIC-PCR指纹图谱作为脾虚证肠道菌群评价的分子指标,研究四君子汤对番泻叶和大黄致脾虚模型大鼠肠道菌群紊乱的影响;结果显示番泻叶和大黄造模后大鼠肠道菌群多样性显著下降,四君子汤干预后,大鼠肠道菌群的多样性显著提高。在本研究中,健脾合剂干预后小鼠肠道菌群多样性恢复,该研究结果也与文献报道一致。
在门水平上,研究发现:健脾合剂干预增加了Firmicutes、Bacteroidetes、Saccharibacteria、Tenericutes、Actinobacteria、Cyanobacteria、Verrucomicrobia的比例,减少了Proteobacteria、Deferribacteres的比例;而复合乳 酸 菌 增 加 了Bacteroidetes、Firmicutes、Saccharibacteria、Tenericutes、Actinobacteria、Cyanobacteria的比例,减少了Proteobacteria、Deferribacteres、Verrucomicrobia的比例。有研究发现,Firmicutes与Bacteroidetes比值(F/B)升高会引起肠道免疫活性的改变,从而导致IBS-D的发生[17],同时IBS患者粪便的F/B有所增加[18]。但在本研究中,我们发现造模后14天的脾虚型IBS-D小鼠肠道中F/B比值较健康小鼠降低了0.39%,B3、B4两组治疗后F/B比值进一步降低。Opdahl LJ等[19]指出,Saccharibacteria具有分解纤维素的作用;在本研究中,造模后小鼠肠道内Saccharibacteria减少,健脾合剂和复合乳酸菌干预后促进了该菌门的生长,考虑Saccharibacteria或能通过分解肠道内纤维素使其被肠道吸收、利用从而减少排便次数来缓解疾病的症状。Actinobacteria能产生丰富的生物活性物质,其代谢活性物质具有抗菌、抗肿瘤、抗病毒等活性,至今发现的天然抗生素中有三分之二是由放线菌产生,放线菌已被认为是新抗生素产生的主要来源[20]。越来越多的证据表明,IBS是一种免疫-炎症模式的胃肠道疾病,持续、低级别的炎症反应是该病的病理基础。本研究发现,健脾合剂和复合乳酸菌均能够通过增加放线菌门的占比,一方面调节肠道菌群的平衡,另一方面缓解了肠道的炎症反应。Jeffery IB等[21]指出,IBS-D患者肠道菌群中的Cyanobacteria比例增加。而在本实验中造模后的脾虚型IBS-D小鼠肠道内Cyanobacteria反而减少,药物干预后Cyanobacteria增加,这与文献报道不一致。张浩[22]研究发现,腹泻羔羊粪便中Verrucomicrobia较健康羔羊而言丰度较高;结合实验造模后小鼠肠道内Verrucomicrobia丰度增加,复合乳酸菌干预后其丰度降低,该结果与文献报道相一致;有报道称,四君子汤治疗脾虚证大鼠能够降低其Verrucomicrobia的丰度[4];而本研究中健脾合剂干预后Verrucomicrobia变化不明显,这与文献报道不一致。Proteobacteria是细菌中最大的一门,包括许多病原菌。研究发现,肠道微生物群落的失衡通常源于Proteobacteria丰度的变化,同时肠道微生态失衡的过程中伴随着变形菌门的增加[23]。在实验中造模后,小鼠肠道中的Proteobacteria显著增加,而药物干预后抑制了该菌门的生长,说明脾虚型IBS-D小鼠的肠道菌群处于失衡状态,药物干预后使其恢复稳态。
在属水平,健脾合剂干预后刺激了Alistipes、Ruminiclostridium、Candidatus-Saccharimonas、Rikenella、Intestinimonas、Lachnoclostridium、Oscillibacter、Coprococcus、Faecalibaculum、Enterorhabdus、Peptococcus、Romboutsia、Papillibacter的生长,抑制了Lactobacillus、Bacteroides、Parasutterella、Escherichia、Erysipelatoclostridium、Parabacteroides、Candidatus-Stoquefichus的生长。复合乳酸菌干预后刺激了Alistipes、Ruminiclostridium、Candidatus_Saccharimonas、Rikenella、Desulfovibrio、Intestinimonas、Roseburia、Lachnoclostridium、Oscillibacter、Blautia、Ruminococcus、Coprococcus、Faecalibaculum、Enterorhabdus、Parvibacter、Peptococcus、Syreptococcus、Papillibacter的 生 长 ;抑 制 了Lactobacillus、Bacteroides、Parasutterella、Escherichia、Erysipelatoclostridium、Akkermansia、Caproiciproducens、Parabacteroides、Candidatus-Stoquefichus的 生 长。Alistipes产生的磺胺脂(Sulfonamide,SLs)是一类不寻常的鞘脂,具有诱导免疫系统或维持哺乳动物肠道中的细菌存活和应激抗性作用[24]。免疫功能障碍是IBS的发病机制之一,我们推测Alistipes可能是通过影响肠道免疫功能而发挥作用。Huang Chunlan等[25]指出,急性坏死性胰腺炎大鼠肠道菌群中Candidatus-Saccharimonas减少,该菌属的减少能够加重肠屏障功能障碍并促进TNF-α、IL-1β和IL-17A表达,导致胰腺和回肠末端更严重的组织病理学损伤;本研究中,造模后Candidatus-Saccharimonas比例降低,药物干预后促进了该菌的生长,我们推测Candidatus-Saccharimonas可能会通过抑制肠道炎症因子的表达从而缓解脾虚型IBS-D的进展。张亮等[26]报道,Desulfovibrio会破坏肠黏膜上皮细胞,损伤肠黏膜的屏障功能,参与IBS的肠道症状。但在本研究中,造模后小鼠肠道内Desulfovibrio减少,复合乳酸菌干预后增加到与正常小鼠相似的水平,而健脾合剂对其无明显影响。短链脂肪酸(Short-chain fatty acids,SCFAs)可被肠细胞直接利用,从而调节宿主的能量平衡、改善肠道通透性和内稳态、调节能量稳态、代谢以及免疫细胞趋化性[27],同时还具有抗炎、抗癌和抗菌活性[28]。Oscillibacter可以促进SCFAs的产生[9],且在本研究中B3、B4组该菌的丰度均明显提高,考虑Oscillibacter可通过SCFAs对肠道的作用缓解小鼠肠道症状。有研究表明,Akkermansia定殖丰度过高的小鼠更容易导致过敏性腹泻[29]。在本研究中,造模后的小鼠Akkermansia丰度提高,该结果与报道相一致。Lactobacillus是益生菌的重要组成部分,对宿主具有促进消化、提升免疫力和抑制病原菌生长的益生特性[30],但在本实验中药物干预后反而抑制了该菌的生长,这与文献报道不一致。Parasutterella可能与IBS的发生和发展有关,也与IBS患者的慢性肠道炎症有关[31]。造模后小鼠肠道中的Parasutterella明显增加,药物干预后抑制其生长,这与文献报道相一致。Escherichia的代表菌是大肠杆菌,是与人类疾病密切相关的细菌,如菌血症,尿路感染和腹泻[32]。而腹泻性大肠杆菌(DEC)菌株是腹泻最常见的病原体之一,在本研究中B3、B4组该菌的丰度均明显降低,可见通过抑制该菌的生长对改善脾虚型IBS-D的腹泻症状有一定意义。
LEfSe分析进一步说明健脾合剂和复合乳酸菌干预不同程度增加了脾虚型IBS-D小鼠中优势菌的多样性。具体来看,本研究发现B2组小鼠肠道中优势菌仅限于Bacteroidetes、Firmicutes、Proteobacteria的9株菌,而B3组 则 是 分 属 于Bacteroidetes、Firmicutes、Proteo-bacteria、Actinobacteria的8株菌;B4组中发挥关键作用的是属于Bacteroidetes、Firmicutes、Proteobacteria、Actinobacteria、Cyanobacteria 的 10株菌。
在本研究中,B3、B4组与B1组之间小鼠肠道菌群均无明显差异,说明健脾合剂和复合乳酸菌干预后均可调节肠道菌群使之达到或者接近正常的水平。健脾合剂和复合乳酸菌对脾虚型IBS-D小鼠肠道菌群的干预作用基本一致,在门水平均是通过调节优势菌门Actinobacteria、Tenericutes、saccharibacteria、Firmicutes、Cyanobacteria、Bacteroidetes的丰度,减少Proteobacteria、Deferribacteres的丰度,从而调节肠道菌群使之接近正常,且B3、B4组的优势菌门的差异性分析均无统计学意义;在属水平,B3、B4组有显著性差异的有Faecalibaculum、Helicobacter、Candidatus-Arthromitus。在本研究中,造模成功的小鼠肠道Helicobacter占比降低,健脾合剂干预可促进了该菌的生长,使之接近健康小鼠的水平,说明健脾合剂可以从多方面调节肠道菌群使之接近或达到平衡状态。
总之,健脾合剂对肠道菌群的干预作用可以归结为两方面:一方面,健脾合剂灌胃可以通过增加脾虚型IBS-D小鼠的肠道菌群多样性、调节肠道微生态的平衡,从而使其达到与健康小鼠相似的肠道菌群稳态;另一方面,健脾合剂灌胃和复合乳酸菌灌胃后对脾虚型IBS-D小鼠肠道菌群的干预作用基本一致,推测健脾合剂可能有益生元样作用。

