胃癌患者常见舌苔类型与肠道菌群的相关性分析*
孙 娴,向春婕,徐 硕,吴 娟,王瑞平,詹 瑧,张军峰**
(1.南京中医药大学医学院 南京 210023;2.江苏省中医院肿瘤内科 南京 210029)
舌苔乃胃蒸脾湿上潮而生,《辨舌指南》[1]周序:“四诊以望居先,望者何?察面色,观目神,辨舌苔,验齿垢四者而已。四者之中,尤以辨舌为最重要。”恽铁櫵在《病理杂谈》论及舌苔与病候时,提出“舌苔乃胃肠消化工作强弱与正常、反常之标帜”[2]。这些中医临床理论表明,舌苔变化可以反映脾胃功能,反映消化道病理生理变化,即舌为脾胃之外候、舌为脾胃之镜[3]。近年来,肠道菌群在健康和疾病中的特征和变化受到广泛关注。临床研究发现,肠道菌群失调是脾虚证的重要特征[4],健脾方剂的药理作用与调节肠道菌群相关[5];前期研究发现,健脾养胃治法可以显著改善化疗胃癌患者生活质量,与肠道菌群改变相关[6],这些研究提示肠道菌群是中医脾藏象的功能执行者。
中医认为,胃主受纳,脾主运化,“脾为胃行其津液”,脾胃协同完成消化吸收和精微物质的全身输布功能,参与整体的生理代谢调节,故脾胃为后天之本。在消化道中存在大量微生物,消化道微生物是不仅参与消化吸收功能,而且通过短链脂肪酸(乙酸、丙酸、丁酸等)、氨基酸(色氨酸、酪氨酸等)代谢参与机体的整体生理调节[7]。随着微生物非培养依赖的高通量测序技术发展,大量研究发现,在消化系统恶性肿瘤(胃癌、结肠癌、肝癌、胰腺癌等)、代谢性疾病(糖尿病、高血压、冠心病等)、退行性疾病(帕金森病、骨质疏松等)等疾病发生时,肠道菌群也发生显著的变化,因此,肠道菌群是反映机体内环境稳定的“一面镜子”[8-9]。最新的荟萃分析显示,从口腔到肠道微生物群落结构具有显著的部位特征,当疾病(类风湿关节炎、糖尿病、结直肠癌)发生时,更多的口腔菌群进入肠道而成为疾病风险标志菌群[10]。舌苔菌群是口腔菌群的重要聚集地,有学者推测常见舌苔对应的口腔菌群变化可能与肠道菌群存在特征性对应关系[11],而且前期研究发现胃癌患者舌苔菌群参与舌苔变化[12-14]。因此,本研究以胃癌为基础,分析常见舌苔对应的肠道菌群结构特征,以期为理解舌苔与脾胃功能的功能联系提供微生态学依据。
1 材料和方法
1.1 临床资料
本研究经江苏省中医院临床伦理委员会批准(2015NL-016-01),遵守临床伦理学规范,知情同意并签字,2015年1月至2016年12月,在江苏省中医院和扬中市人民医院招募病理确诊的102例原发性胃癌患者作为病例组,根据舌苔类型共分为4组:薄白苔组34例(平均年龄59.4±7.6岁,男性25例,女性9例),白厚苔组31例(平均年龄61.9±10.0岁,男性23例,女性8例),黄薄苔组20例(平均年龄66.8±7.6岁,男性14例,女性6例),黄厚苔组17例(平均年龄70.6±7.0岁,男性14例,女性3例)。同期,在江苏省中医院体检中心收集招募体检无重大器质性病变的薄白苔体检者24例作为对照组,男16例,女8例,平均年龄62.7±6.5岁。5组人群的年龄、性别均无显著性差异(P>0.05)。
1.2 舌苔类型判定
参照中医舌诊规范[15],晨起空腹,无菌水漱口2-3次后,用DS01-B舌象仪采集图像(上海道生医疗科技有限公司,上海)采集舌象并判断苔色和苔质,排除染苔,并由两位中医师对舌苔的苔色和苔质进行辨识。
1.3 粪便菌群检测与分析
收集胃癌患者和对照组粪便,-80℃保存。菌群检测参照文献[12]。简述如下:利用DNA提取试剂盒(Omega Bio-tek,Norcross,GA,USA)提取粪便DNA,1%琼脂糖凝胶电泳检测DNA质量符合要求。细菌16SrRNA基因可变区V3-V4的通用引物为338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3'),真菌18SrRNA基因ITS1-2区的通用引物为ITS1F 5'-barcode-CTTGGTCATTTAGAGGAAGTAA-3'和ITS2R 5'-GCTGCGTTCTTCATCGATGC-3'。然后利用PCR仪(ABI GeneAmp®9700型)进行扩增,2%琼脂糖凝胶电泳检测PCR产物,AxyPrepDNA试剂盒(AXYGEN公司)回收PCR产物,QuantiFluor™-ST蓝色荧光定量系统(Promega公司)进行DNA定量分析,构建Illumina PE250文库,利用Illumina Miseq平台进行高通量测序。测序数据采用QIIME(version 1.17)进行数据优化处理,采用UPARSE35(version 7.1 http://drive5.com/uparse/)软件按照97%相似性建立菌群可操作单元(operational taxonomic unit,OTU),并 分 别 在 门(phylum)、纲(class)、目(order)、科(family)、属(genus)等分类水平分析菌群结构。采用在线软件(http://www.i-sanger.com)和Visual Genomics(Release 1,上海盈飞生物)进行微生态学生物信息分析,包括α多样性、菌群结构分析、LEfSe分析等。
1.4 统计学分析
数据资料采用平均值±标准差表示,统计学方法包括卡方检验、非参数检验、受试者工作特征(receiver operating characteristic,ROC)分析和Spearman相关性分析,所有统计分析在SPSS 21.0软件(SPSS Inc.,Chicago,USA)进行,R软件包(pheatmap,https://www.rproject.org/)绘制相关性热图,采用双侧检验,P<0.05为显著统计学意义。
2 结果
2.1 常见胃癌患者对应肠道菌群的Alpha多样性
Alpha主要关注肠道菌群的物种数目和多样性,Ace和Chao反映物种的丰富度,Shannon和Simpson反映物种的多样性。采用Mann-Whitney U非参数检验肠道菌群的alpha多样性指数差异,结果(见表1)显示,与对照组相比,肠道细菌多样性指数均无统计学差异(P>0.05),黄薄苔胃癌患者肠道真菌多样性(Shannon指数)显著降低(P<0.05),而黄厚苔胃癌患者真菌丰富度(Ace指数)显著降低(P<0.05)。在胃癌患者内部,四种舌苔对应的肠道细菌多样性均无显著统计学差异(P>0.05);与其他3种舌苔相比,白厚苔胃癌患者肠道真菌丰富度显著升高(P<0.05),而黄厚苔胃癌患者肠道真菌丰富度显著降低(P<0.05)。
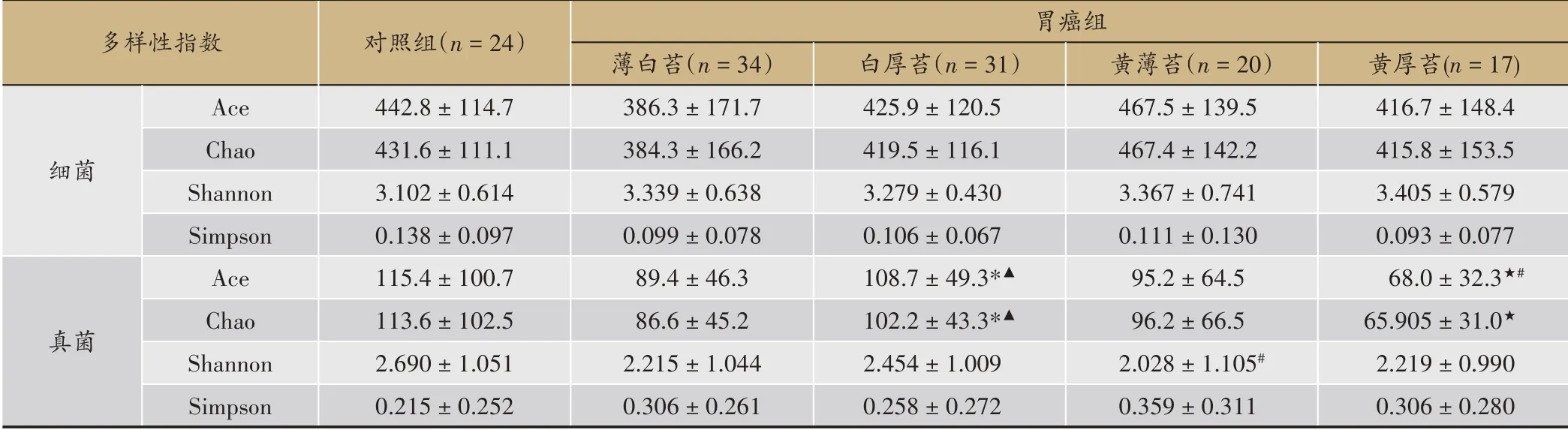
表1 胃癌患者常见舌苔对应肠道菌群Alpha多样性分析
2.2 常见舌苔胃癌患者对应肠道菌群的结构分析
本研究人群肠道观察到已知细菌有17个门、25个纲、53个目、94个科和325个属。4个优势菌门总计占96%,从高到低依次为厚壁菌门(Firmicutes,60.3±18.9%)、拟杆菌门(Bacteroidetes,16.5±15.8%)、变形菌 门(Proteobacteria,16.0±16.1%)、放 线 菌 门(Actinobacteria、3.6±4.2%)。相对丰度大于1%的优势菌属有5个,从高到低依次为拟杆菌属(Bacillus,8.6±10.3%)、乳杆菌属(Lactobacillus,8.3±14.6%)、大肠杆菌-志贺菌属(Escherichia-Shigella,6.9±11.7%)、粪杆菌属(Faecalibacterium、5.5±7.7%)和链球菌属(Streptococcus,5.3±6.2%)。
本研究人群肠道观察到已知真菌有7个门、26个纲、79个目、179个科和387个属。3个优势菌门总计占98%以上,依次为子囊菌门(Ascomycota,75.9±25.9%)、担子菌门(Basidiomycota,19.4±26.6%)和接合菌门(Zygomycota,2.8±5.6%);相对丰度大于1%的优势菌属有5个,从高到低依次为念珠菌属(Candida,21.2±31.7%)、曲霉属(Aspergillus,16.0±17.4%)、灵芝菌属(Ganoderma,4.9±20.0%)、青霉属(Penicillium,3.6±6.8%)和顶生菌属(Acremonium,3.2±7.7%)。
在门和属水平采用Mann-Whitney U非参数检验分析4种舌苔胃癌患者对应肠道菌群差异,展示至少1种舌苔胃癌患者与对照组存在显著差异的肠道菌群(P<0.05)。与对照组相比,不同舌苔的胃癌患者肠道细菌6个门和25个属存在显著统计学差异(表2),拟杆菌门(Bacteroidetes)和互养菌门(Synergistetes)的相对丰度在4种舌苔的胃癌患者肠道中均显著升高(P<0.05),乳酸杆菌属(Lactobacillus)、韦荣菌属(Veillonella)、金字塔杆菌属(Pyramidobacter)的相对丰度在4种舌苔的胃癌患者肠道中均显著升高(P<0.05),而罗布西亚菌属(Romboutsia)的相对丰度在4种舌苔的胃癌患者肠道中均显著降低(P<0.05)。然而,与对照组相比,不同舌苔的胃癌患者有1个门和8个属存在显著统计学差异(P<0.05)(表3),未发现4种舌苔的胃癌患者肠道中均显著差异的菌群。
可以看出,与对照组相比,胃癌患者肠道菌群变化不仅与胃癌相关,而且与舌苔类型相关,提示不同舌苔类型可能对应特定肠道菌群。
2.3 胃癌患者常见舌苔对应肠道菌群的判别分析
为了排除胃癌对舌苔对应肠道菌群的影响,本研究将胃癌患者分为目标舌苔组和其他3种舌苔合并组,采用LEfSe判别分析,目标舌苔组对应菌群是相对丰度升高的肠道菌群,其他3种舌苔组对应的标志菌群是目标舌苔组相对丰度降低的肠道菌群(图1)。譬如,与其他3种舌苔相比,薄白苔胃癌患者肠道中α-变形菌纲(Alphaproteobacteria)、产碱杆菌科(Alcaligenaceae)、巨单胞菌属(Megamonas)、嗜粪拟杆菌(Bacteroidescoprophilus)等20个细菌分类单元相对丰度显著升高(图1A),薄白苔胃癌患者肠道中子囊球菌纲(Ascosphaerales)、节担菌目(Wallemiales)、囊球菌目(Ascosphaeraceae)、囊球菌属(Ascosphaera)、蜜蜂球囊菌种(Ascosphaera apis)等28个真菌分类单元相对丰度显著升高(图1E)。

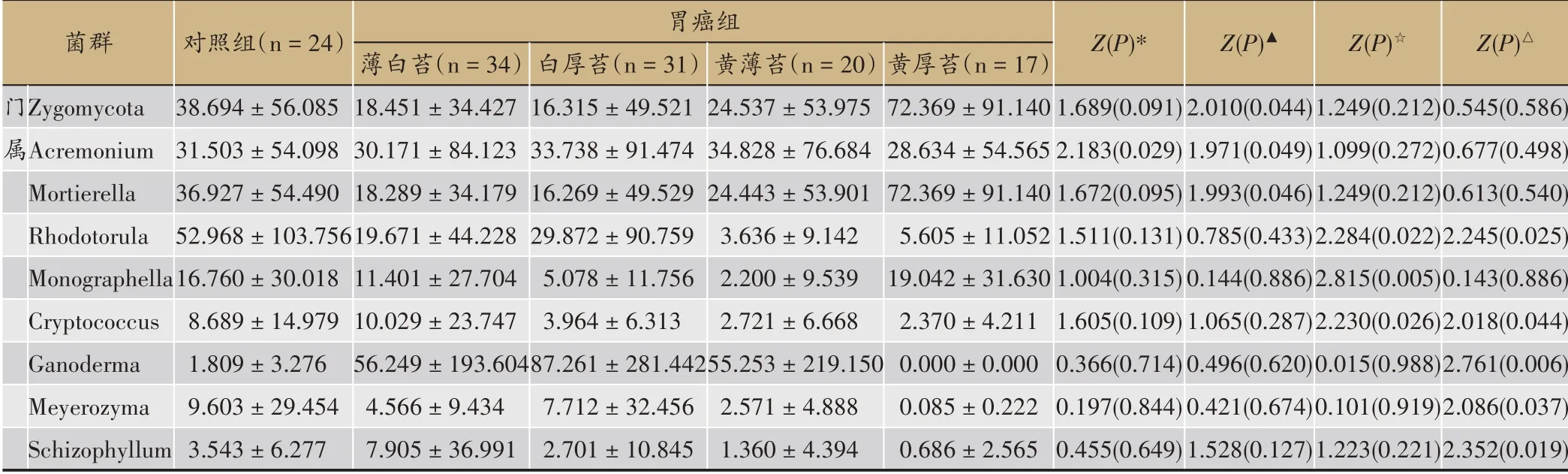
表3 常见舌苔胃癌患者肠道真菌比较分析(相对丰度‰,均值±标准差)
为了进一步探索胃癌患者常见舌苔对应肠道菌群的诊断价值,采用ROC分析不同舌苔对应肠道标志菌群,曲线下面积(Area under curve,AUC)大于0.7可以作为标志菌群,结果显示,奇异菌属(Atopobium)显著升高与胃癌患者白厚苔相关,AUC(95%CI)为0.708(0.601-0.815);Ruminococcaceae UCG-004菌 属 和Lachnospiraceae UCG-006菌属显著升高与胃癌黄厚苔相关,AUC(95%CI)分别为0.740(0.597-0.883)、0.715(0.574-0.856);然而,未发现与胃癌患者薄白苔、黄薄苔相关的标志肠道菌群。
2.4 胃癌患者常见舌苔相关血清炎症因子比较分析
前期研究发现,黄苔胃癌患者血清IL-17α水平显著高于白苔患者,而且在对照人群也具有同样结果,提示血清IL-17α是区分白苔和黄苔的潜在指标[16]。最新研究发现,肠道菌群与机体炎症因子的产生能力相关,TNF-α和IFN-γ与肠道菌群的棕榈酸和色氨酸代谢途径相关[17]。因此,本研究对前期血清炎症因子数据进行了再次分析,结果显示,与薄白苔对照组相比,薄白苔胃癌患者血清IL-1α、IL-5、TNF-β、IL-1β、IL-2、IL-4、IL-8和IL-13水平均显著降低(P<0.05),胃癌患者白厚苔患者血清IL-5、IL-17α水平显著升高(P<0.05),而血清IL-4、IL-8、IL-13水平显著降低(P<0.05),黄薄苔胃癌患者血清IL-12/IL-23P40、IL-17α水平均显著升高(P<0.05),黄厚苔胃癌患者血清IL-15、IL-17α水平均显著升高、TNF-β、VEGF、IL-4水平均显著降低(P<0.05)(表4)。
2.5 胃癌患者常见舌苔对应肠道菌属与血清炎症相关性分析
为了进一步探讨常见舌苔胃癌患者差异肠道菌群与血清炎症因子的相关性,本研究结合胃癌患者常见舌苔相关肠道细菌(表2)、肠道真菌(表3)和血清炎症因子(表4),在每种舌苔胃癌患者和对照组人群中,对相关差异菌属和炎症因子进行Spearman相关分析。结果显示,血清炎症因子的变化趋势与肠道菌属相对丰度的变化趋势存在一致性,即血清水平显著升高的炎症因子与相对丰度升高的肠道菌群显著正相关,而血清水平显著降低的炎症因子与相对丰度升高的肠道菌群显著负相关,反之亦然(图2)。
对于薄白苔胃癌患者,血清水平下降的IL-5与相对丰度升高的韦荣球菌属(Veillonella)显著负相关(相关系数r=-0.364),血清水平下降的IL-2与相对丰度降低的粪杆菌属(Faecalibacterium)显著正相关(r=0.370),血清水平下降的IL-13与相对丰度升高的副杆菌属(Parabacteroides)、链球菌属(Streptococcus)均显著负相关(r=-0.390,-0.385)(图2A)。对于白厚苔胃癌患者,血清水平升高的IL-17α与相对丰度升高的乳杆菌属(Lactobacillus)、链球菌属、金字塔杆菌属(Pyramidobacter)均显著正相关(r=0.461,0.385和0.385),而血清水平降低的IL-8与相对丰度降低的[Eubacterium]hallii group显著正相关(r=0.408)(图2B)。对于黄薄苔胃癌患者,血清水平升高的IL-17α与相对丰度升高的乳杆菌属、链球菌属、韦荣球菌属、巨球菌属(Megasphaera)、拟杆菌属(Bacteroides)、梭杆菌属(Fusobacterium)均显著正相关(r=0.525,0.410,0.387,0.362,0.387,0.402),与相对丰度降低的支原体属(Romboutsia)显著负相关(r=-0.496),血清水平升高的IL-12/IL-23P40与相对丰度升高的乳杆菌属显著正相关(r=0.605)(图2C)。对于黄厚苔胃癌患者,血清水平升高的IL-17α与相对丰度升高的乳杆菌属、异普雷沃菌(Alloprevotella)显著正相关(r=0.403,0.375),与相对丰度降低的Romboutsia显著负相关(r=-0.432),血清水平降低的VEGF与相对丰度升高的韦荣球菌属、异普雷沃菌显著负相关(r=-0.414,-0.397)(图2D)。
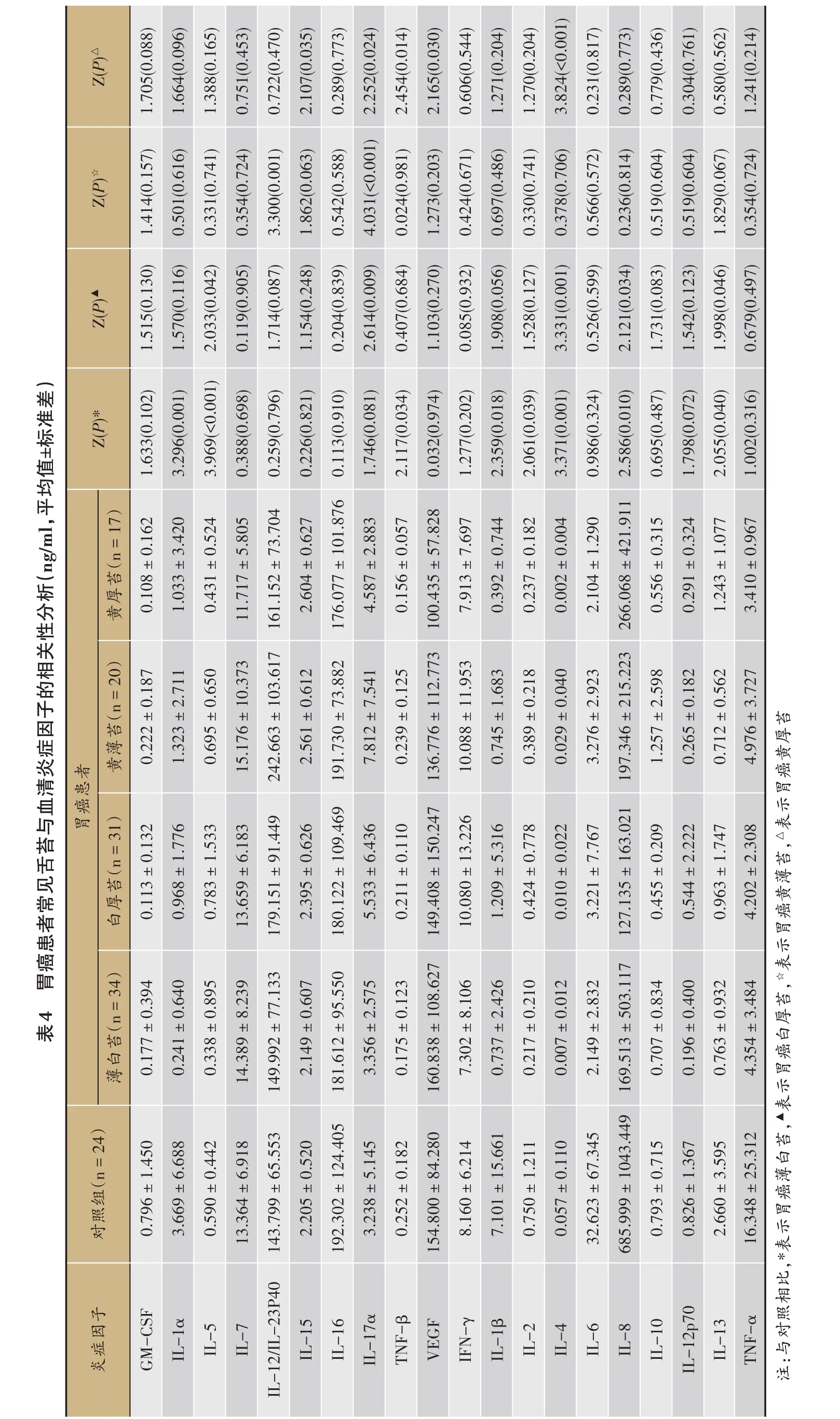
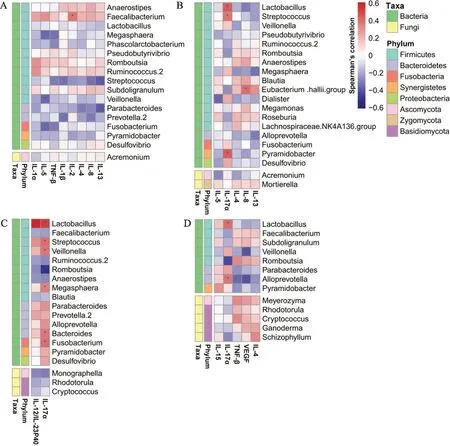
图2 胃癌常见舌苔对应肠道差异菌属与血清炎症因子的相关性分析
可以看出,不同舌苔的胃癌患者具有不同的肠道菌群-炎症因子互作模式,其中,IL-17α在白厚苔、黄薄苔和黄厚苔胃癌患者血清中均显著升高,均与肠道乳杆菌属的相对丰度正相关。
3 讨论
胃癌是我国常见的恶性肿瘤,2015年我国胃癌新发67.9万例,死亡49.8万例,发病率居恶性肿瘤第2位,死亡率居第3位,严重威胁国人健康[18]。中医药辨证论治辅助胃癌治疗可以显著提高胃癌患者生活质量,而舌苔是辨证论治的重要内容[19]。因此,揭示不同舌苔对应的肠道菌群结构特征,对理解舌苔形成的生物学机制及临床诊断价值提供新的视角。本研究发现,与对照组相比,不同舌苔的胃癌患者均表现为拟杆菌门、梭杆菌门相对丰度显著升高,放线菌门、厚壁菌门、变形菌门相对丰度显著降低,类似于胰腺癌和结直肠癌患者肠道菌群结果[20-21],不同舌苔的胃癌患者肠道乳杆菌属、链球菌属的相对丰度显著升高,而粪杆菌属的相对丰度显著降低,与结直肠癌患者肠道菌群特征类似[22-23]。然而,不同舌苔的胃癌患者肠道真菌均表现为顶生菌属相对丰度显著升高,作为一类腐败真菌,顶生菌属在免疫功能低下时可导致感染[24],提示胃癌患者免疫功能低下。同时,本研究也发现对于不同舌苔的胃癌患者的差异肠道菌群不完全相同,表明不同舌苔对应的肠道差异菌群不仅与胃癌相关,也与舌苔类型相关。
为了探讨胃癌患者常见舌苔对应的标志菌群,对4种常见舌苔的胃癌患者肠道菌群进行LEfSe判别联合ROC诊断曲线分析。结果发现,与其他3种舌苔胃癌患者相比,白厚苔胃癌患者肠道奇异菌属相对丰度显著升高,黄厚苔胃癌患者的肠道反刍球菌科(Ruminococcaceae)UCG-004菌属、毛螺菌科UCG-006菌属、Anaerotruncus colihominis DSM 17241菌种和Halomonasstevensii菌种相对丰度显著升高,而薄白苔和黄薄苔胃癌患者未发现具有诊断价值的标志菌群,提示白厚苔和黄厚苔胃癌患者具有独特的肠道菌群。
奇异菌属革兰染色阳性,临床研究发现,结直肠癌患者肠道奇异菌属的相对丰度显著升高[25],缺血性中风患者肠道奇异菌群(Atopobium cluster)和乳酸杆菌(Lactobacillusruminis)显著升高,而日本2型糖尿病患者肠道奇异菌属丰度显著降低[26],提示肠道奇异菌属相关炎症代谢通路是胃癌患者白厚苔形成重要因素。
毛螺菌科是人类肠道的优势菌群,革兰染色阴性,严格厌氧[27],毛螺菌科可以产生丁酸盐参与机体的新陈代谢,如毛螺菌科的肠道定植可以诱导小鼠糖尿病[28],而且丁酸可以显著促进脂肪代谢和蓄积[29],而黄厚苔胃癌患者肠道毛螺菌科UCG-006菌属显著高于其他舌苔患者,提示黄厚苔胃癌患者可能存在脂肪代谢紊乱。另外,临床研究发现,终末期肾病患者肠道盐单胞菌科(Halomonadaceae)相对丰度显著升高[30],而本研究中发现黄厚苔胃癌患者肠道盐单胞菌科的Halomonasstevensii相对丰度显著升高,提示黄厚苔胃癌患者可能与肾脏水盐代谢功能异常相关。
众所周知,微生物是感染的重要因素,血清炎症因子水平可以反映机体的炎症免疫状态,本研究结合前期研究结果[16],发现白厚苔、黄薄苔和黄厚苔胃癌患者血清IL-17α水平均显著升高,而且与肠道乳杆菌属的相对丰度显著正相关。IL-17α具有募集中性粒细胞、促进抗体生成、活化T细胞等活性,是黏膜免疫的重要调节分子[31],血清IL-17α在结肠结扎和穿刺诱导的大鼠败血症模型中显著升高,与活性氧(reactive oxygen species)介导的信号转导通路相关[32],也参是调控肠道菌群抵抗肺真菌感染的关键细胞因子[33],这些研究结果提示IL-17α是消化道黏膜菌群参与炎症免疫的重要分子。乳杆菌属于人类肠道正常微生物群,革兰阳性菌,微需氧,过氧化氢酶阴性,广泛存在于粪便、尿道、血液、呼吸道、创口、分泌物等样本,与机会感染相关[34],结果提示血清IL-17α升高可能与肠道乳杆菌的机会感染相关。
综上所述,本研究发现胃癌患者常见舌苔类型与肠道菌群相关,不同舌苔对应了特定的肠道菌群结构,为理解舌苔反映肠道病理生理功能提供了微生态学视角,特别是发现白厚苔和黄厚苔具有特定的标志肠道菌群,为深入研究胃癌患者舌苔形成分子机制提供了新的思路。本研究也存在一定局限:舌苔形成受到许多复杂因素的影响,是机体病理生理的综合外在表现,胃癌患者的病理类型、药物治疗和饮食习惯也会对本研究结果产生干扰,因此,需要更大的人群或其他消化道疾病人群进行验证,才能获得具有更可靠的结果。无论如何,本研究为开展中医舌诊特别是舌苔的生物学原理研究提供了新的思路和方法,有助于促进中医舌诊的客体化和标准化。

