基于网络药理学和分子对接法筛选藏药五味沙棘散治疗新型冠状病毒肺炎(COVID-19)活性成分的研究*
刘 川,苏锦松,李轩豪,唐 策,刘 悦,张 艺
(1.成都中医药大学 民族医药学术传承创新研究中心 成都 611137;2.成都中医药大学 民族医药学院 成都 611137;3.成都中医药大学 中医药创新研究院 成都 611137;4.成都大学 四川抗菌素工业研究所 成都 610037)
2019年12月以来,一种新型冠状病毒(SARSCoV-2)引起的COVID-19侵袭我国,成为人类严重呼吸道感染的原因[1],截至2020年3月19日,我国确诊病例约80967例,累计死亡病例近3132例[2]。此外,感染疫情仍在迅速蔓延,并波及全球20多个国家和地区,这对全球健康、公共卫生安全构成了巨大威胁[3]。目前还未发现治疗该病毒的特效药物,发现新的防治药物迫在眉睫。
藏医学是祖国传统医学的重要组成部分,在防治疫病领域积累了丰富的经验,藏医认为新型冠状病毒肺炎(COVID-19)可纳入藏医“年仍奈(即疫病)范畴,属热性病,表现出发病迅速而猛烈、病势危急、传染性极强、普遍流行等特点[4]。“年仍奈”在发病早期,会呈现初期热性症状,体外时令、邪气变化,使体内三因(隆、赤巴、培根)失调,出现与温热病邪激烈相争的过程,可通过远离邪气,热之寒者,最终调和三因平衡而使热病趋向治愈[5]。《藏医临床札记》记载[6]:复方五味沙棘散(藏文名:སྟར་བུ་ལྔ་པ་)由沙棘、余甘子、木香、葡萄、甘草配伍组成,具清热祛痰,润肺排脓,止咳定喘之效,善于防治因肺热(血或赤巴偏盛导致培根湿热偏盛)引起的多种肺部疾病[7]。研究表明,五味沙棘散在临床上对肺病有良好的治疗效果[8],具有抗感染和免疫调节作用[9],能有效达到止咳祛痰平喘的效果[10]。
新型冠状病毒(SARS-CoV-2)属β属的新型冠状病毒,通过冠状病毒的刺突蛋白(Spike Protein)和人血管紧张素转换酶Ⅱ(ACE2)受体相互作用附着于宿主细胞,导致病毒入侵机体而致病[11],细胞丝氨酸蛋白酶(TMPRSS2)能够激活SARS-CoV-2入侵细胞[12]。上海科技大学饶子和/杨海涛课题[13]组报道了冠状病毒COVID-19的主蛋白酶3CL水解酶(Mpro,PDB:6LU7),其主要作用是水解病毒复制过程中的两个多聚蛋白pp1a和pp1ab,抑制病毒的主蛋白酶对于阻止病毒复制可能具有重要作用。
网络药理学利用生物分子网络分析方法,在中药/民族药的活性成分的筛选、药效机理分析、新药设计和靶点分析中,与藏药方剂整体性及系统性作用特点高度一致。分子对接技术是研究分子间(如配体和受体)相互作用,并预测其结合模式和亲合力的一种理论模拟方法。网络药理学与分子对接技术的单一或结合应用,在探索中药/民族药效物质基础、药物作用机制及阐释配伍规律的相关研究中被广泛应用[14-17]。
因此,本文从藏医药理论出发,整合网络药理学和分子对接技术对藏药五味沙棘散治疗(COVID-19)活性成分进行筛选,为后期抗新型冠状病毒深入研究及新药开发提供参考。
1 材料
中药系统药理学分析平台(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php);Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/);Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/);String数据库(https://string-db.org/);DAVID数据库(https://david.ncifcrf.gov/);Cytoscape3.7.2软件(http://www.cytoscape.org/);Maestro version 11.5软件(https://www.schrodinger.com/Maestro/)。
2 方法
2.1 五味沙棘散活性成分筛选
通过TCMSP数据库和文献查询对藏药五味沙棘散(沙棘、余甘子、木香、甘草、葡萄)的化学成分进行搜集,构建五味沙棘散化学成分数据集。口服利用度(Oral availability,OB)、药物相似性(Drug likeness,DL)和“类药五原则”在药物筛选过程中的为重要参数。设定满足“OB>30%”和“DL>0.18”的成分作为潜在的活性成分,构建五味沙棘散潜在活性成分数据集。
2.2 五味沙棘散活性成分靶点预测
PubChem数据库是一种包含有机小分子生物活性数据的化学模组数据库,是NCBI数据库的子数据库。Swiss Target Prediction数据库是用于生物活性小分子靶点蛋白的预测。结合PubChem和Swiss Target Prediction数据库,获取五味沙棘散活性成分潜在的作用靶点信息,同时利用String数据库对靶点进行分析,获取蛋白相互作用关系,筛选出核心靶点。
2.3 靶点GO功能富集分析和KEGG通路富集分析
获得的五味沙棘散活性成分潜在作用靶点导入DAVID 6.8功能注释(Functional Annotation)工具,选择Gene Ontology(以下简称GO)下的分子功能(molecular function,MF)、生物过程(biological process,BP)和细胞组成(cellular component,CC)3个部分进行GO功能富集分析,选择KEGGPathway,进一步寻找活性成分作用靶点显著富集的主要功能注释与体内通路,最后利用Cytoscape3.7.2软件对富集结果进行可视化。
2.4 药物-化合物-靶点网络构建与分析
以化合物、筛选获得的活性成分和预测得到的靶点为目标,利用Cytoscape 3.7.2软件绘制靶点相互作用网络图和“药物-化合物-靶点”网络图。
2.5 分子对接验证
采用Maestro version 11.5软件,将活性成分作为配体与受体血管紧张素转换酶IIACE2(PDB:1R4L)、细胞丝氨酸蛋白酶TMPRSS2(PDB:6N4T)和COVID-19 3CLpro水解酶(PDB:6LU7)进行分子对接验证,并对其Docking Score进行分析,用以评价活性成分与靶点之间的结合活性。Docking Score值是评价靶点和化合物结合能力大小的参数,Docking Score的计算负绝对值越大,表明配体与受体的对接亲和力就越大,值大于5.0表明有较好的结合活性,大于7.0则说明具有极好的结合活性。
表1 五味沙棘散中潜在活性成分
3 结果
3.1 五味沙棘散活性成分的筛选
分别将沙棘、余甘子、木香、甘草、葡萄干作为关键词,输入TCMSP数据库进行检索并结合文献对比,通过筛选原则“OB>30%”、“DL>0.18”和“类药五原则”筛选获得29个潜在活性成分,分别编号为:N1-N29。其中,13个来自甘草、10个来自沙棘、8个来自余甘子、4个来自木香、3个来自葡萄。主要包括黄酮类化合物、酚类化合物和萜类化合物等(见表1、图1)。
3.2 五味沙棘散活性化合物的靶点预测
通过Swiss Target Prediction数据库对活性成分进行检索,共获得346个潜在作用靶点,合并重复后共获得147个潜在作用靶点信息。其中,甘草对应100个、沙棘对应79个来自、余甘子对应78个、木香对应19个、葡萄对应7个。进一步通过String数据库对147个潜在作用靶点进行分析,获取蛋白相互作用关系,得到的关系文件导入Cytoscape 3.7.2,筛选Degree≥2倍中位数的靶点作为核心靶点,得到32个核心靶点。将获得32个核心靶点信息,再次通过String数据库,分析其相互作用关系,利用Cytoscape 3.7.2对分析结果进行可视化展示(图2)
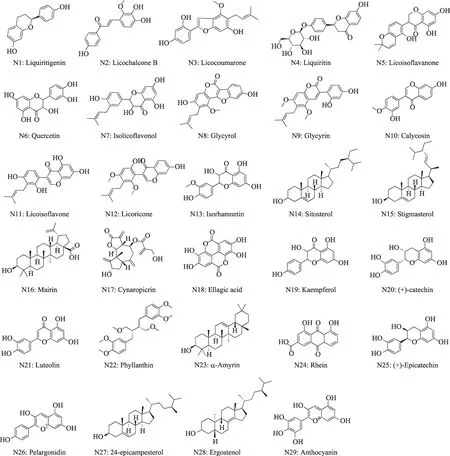
图1 五味沙棘散中29个潜在活性化合物的分子式。
3.3 靶点GO功能富集分析和KEGG通路富集分析
通过将32个核心靶点导入DAVID数据库进行GO生物学功能注释和KEGG Pathway分析,得到GO功能富集条目225条(p<0.05),其中生物过程(BP)条目158条,细胞组成(CC)条目20条,分子功能(MF)条目47条,部分条目(靶点数≥10)见图3。KEGG通路富集筛选得到35条信号通路(p<0.05),部分条目(靶点数≥7)见图4。
3.4 药物-活性成分-靶点网络构建与分析

图2 靶点蛋白相互作用网络。节点的大小与节点的度值呈正比例关系;绿色到红色代表度值由小到大

图3 五味沙棘散靶标的GO富集分析。A:细胞组成;B:分子功能;C:生物过程
药物-活性成分-靶点网络共68个节点(5个药物节点、29个活性成分节点、32个靶点节点)和280条边(见图5)。根据网络的拓扑学性质筛选中心度值(Betweenness Centrality)、亲 中 心 度 值(Closeness Centrality)、等级值(degree)较大的节点进行分析,在整个网络中,相应节点连接数值越大,起到枢纽的作用越强,可能是筛选的核心化合物或者靶点。
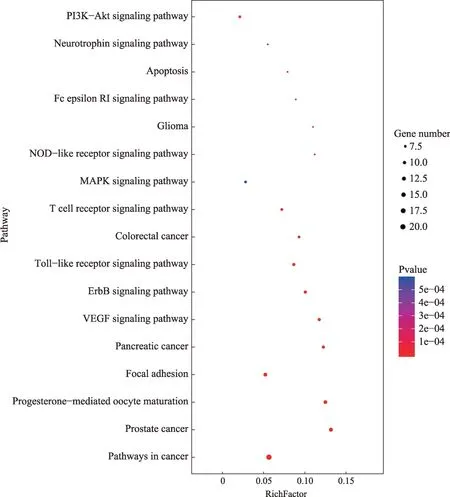
图4 KEGGPathway富集分析气泡图
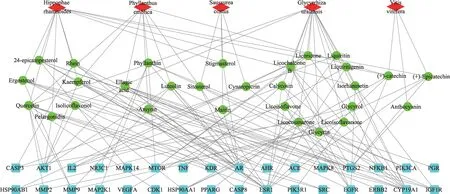
图5 药物-活性成分-作用靶点网络图。红色菱形代表药物,绿色圆形代表活性成分,蓝色矩形代表靶点
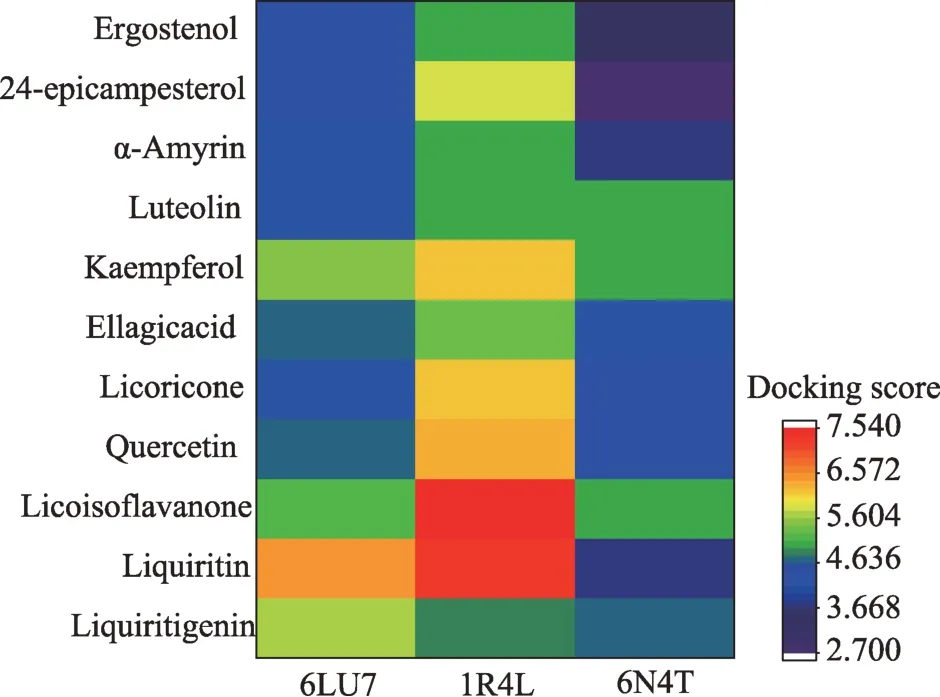
图6 成分与关键靶点对接得分热图
“药物-活性成分-作用靶点”网络图设置degree大于中位数为核心成分,筛选到12个活性成分,分别为:槲皮素、山奈酚、木犀草素、花葵素、24-epicampesterol、麦角甾醇、鞣花酸、α-香树脂醇、甘草素、甘草苷、甘草异黄烷酮、甘草利酮。
3.5 分子对接验证
为明确靶点蛋白与所对应的成分之间的结合活性,本研究选取12个核心活性成分为作为配体,以ACE2(PDB:1R4L)、TMPRSS2(PDB:6N4T)和COVID-19 3CLpro水解酶(PDB:6LU7)作为受体,进行分子对接验证,结果以热图形式展示(见图6)。结果表明,12个活性成分中,花葵素未能成功结合,其余11个活性成分与受体具有较好的结合能力。11个活性成分与ACE2对接打分大于7.0的活性成分2个,介于4.25-7.0之间的活性成分9个,小于4.25的活性成分0个;与TMPRSS2对接打分大于7.0的活性成分0个,介于4.25-7.0之间的活性成分7个,小于4.25的活性成分4个;与COVID-19 3CLpro水解酶对接打分大于7.0的活性成分0个,介于4.25-7.0之间的活性成分10个,小于4.25的活性成分1个。综合评价12个活性成分与两个受体结合能力,甘草异黄烷酮、甘草苷、槲皮素、山奈酚等4个成分与受体结合能力最强,提示其可能是五味沙棘散治疗新型冠状病毒肺炎的潜在活性成分。进一步分析了4个潜在活性成分与配体相互作用模式,受体与配体主要以氢键和π-π键形式结合,结合口袋完全处于受体肽连以内,保证了配体与其的对接结构完整性和稳定性(见图7)。
4 讨论

图7 甘草异黄烷酮、甘草苷、槲皮素和山奈酚分别与ACE2(PDB:1R4L)、TMPRSS2(PDB:6N4T)和3CLpro(PDB:6LU7)相互作用的分子对接图
本文整合网络药理学和分子对接技术筛选了藏药五味沙棘散治疗新型冠状病毒肺炎潜在活性成分。通过获取成分、靶标预测、蛋白互作分析、GO注释、KEGG通路富集分析和分子对接验证,最终获得32个核心靶点、4个核心成分。
通过String数据库进行蛋白互作分析,得到对32个核心靶点,排名靠前的靶点AKT1、VEGFA、SRC、EGFR、TNF、ESR1、mTOR、IL2等与炎症和免疫相关。COVID-19感染导致强烈的免疫反应和炎症风暴,此过程中大量细胞因子被激活[18]。实验证明,可通过调节IL-6、IL-1和TNF-α等炎性细胞因子而发挥明显的抗炎作用,纠正机体的“过度免疫”,从而保护肺脏功能和组织结构,以减轻肺损伤[19],从SARS和MERS的研究发现,免疫反应策略是COVID-19潜在药物发现的一个重要方向[20]。同时,对这些靶标的功能富集分析发现,它们富集在MAPK signaling pathway、JAKSTAT signaling pathway、TNF signaling pathway、PI3K/Akt signaling pathway免疫和炎症相关通路,癌症相关通路,体内代谢信号转导等生物学过程的一系列信号通路上。以上通路在肺炎治疗有着重要作用,Dai等[21]表明可通过TLR4、MAPK和NF-κB等途径抑制甲型流感病毒复制和流感病毒性肺炎;LEE等[22]表明在264.7巨噬细胞中通过NF-κB、JAK-STAT通路抑制LPS诱导的促炎症介质的表达。Wu等[23]对COVID-19血浆/血清蛋白磁共振结果分析,富集到Cytokine-cytokine receptor interaction、VEGF signaling, JAK-STAT signaling Pathway等信号通路。吴昊等[24]通过网络药理学探讨清肺排毒汤治疗新型冠状病毒肺炎机制,表明免疫相关通路T细胞、B细胞通路,以及细胞因子作用相关通路如MAPK信号通路、VEGF信号通路,起到抑制细胞因子、免疫反应、消除炎症的作用。
通过分子对接,筛选出来综合评分最高的4个黄酮类活性成分。其中甘草苷、甘草异黄烷酮来自甘草,槲皮素、山柰酚来自沙棘、余甘子和甘草,并且为主要药效成分。在藏医药理论指导下,按照药味、性效、化味、功能主治配伍原则,以整体观来阐述药效物质基础,体现了藏药五味沙棘散“多成分-多靶点-多途径”的作用特点。方中沙棘为君药,具有清肺、止咳化痰、活血化瘀、治培根等功效;余甘子清热凉血,甘草、葡萄清热润肺、止咳化痰,可助沙棘发挥药效;佐药木香健脾和胃。诸药配伍,共奏清热、润肺、排脓、化痰、止咳、平喘之功,达到治疗肺炎的作用。该类化合物具有抗氧化、清除自由基、抗肿瘤、抗癌、抗菌、抗病毒、抗炎免疫、抗衰老等药理学作用,在冠状病毒引起的疾病预防与治疗药物筛选和开发中起到了重要作用[25],特别是与的冠状病毒COVID-19极为类似的SARS-CoV和MERS-CoV。Chiow等[26]评估黄酮类成分抗病毒活性在小鼠冠状病毒和登革病毒感染中,发现槲皮素表现出相对较强的抗病毒活性,可以抑制冠状病毒和登革病毒,Indra等[27]通过体内外实验表明槲皮素可通过诱导的人脐静脉内皮细胞(HUVECs)中的ERK1/2磷酸化和NF-κB活化来抑制炎症。Chiang等[28]在体外抗病毒活性实验中发现,槲皮素与上呼吸道感染的靶细胞和病原体(SARS-CoV)共培养时,表现出较强的抗病毒活性。Schwarz等[29]发现山奈酚及其衍生物在SARS冠状病毒治疗中,通过抑制抗冠状病毒的3a离子通道,抑制病毒的释放,可能成为开发新型治疗性抗病毒药物的来源。Sun等[30]通过体外和体内实验表明山奈酚通过抑制炎性细胞因子TNF-α、IL-6、IL-1β、PGE2的表达,并通过MAPK和NF-κB通路抑制炎症反应,从而改善肺部水肿。甘草通过控制病毒基因表达,诱导细胞融合等抑制病毒的复制,在抗艾滋病病毒(HIV)、SARS病毒(SARS-CoV)中广泛作用[31]。甘草中成分甘草异黄烷酮、甘草苷是抗病毒,炎症的有效成分,能减轻炎症因子风暴、预防ARDS和多脏器损伤而减少炎症性疾病重症化,而且还具有抗病毒潜能[32-33]。
藏医理论认为是当机体受季节、饮食、起居等外因外干扰时,体内隆、赤巴、培根三因素平衡便失调,功能发生偏盛或偏衰,导致COVID-19引起的肺炎发病。由此,可根据疫情的发展阶段,采用防治结合的手段进一步控制疾病发展与转归。首先进行起居、饮食、药物预防,进一步通过药物治疗,根据藏医药经典文献《莲花生医著汇集·甘露宝瓶》记载[34],年仍奈(即疫病)热性病以调节平衡三因,特别针对“隆”的偏胜纠正治疗。常规治疗方法有三种:第一“洁静环境、通风杀菌”,其次“躯体散热,运动发汗,药物下泻”为治疗方法,最后以补益性藏药平和”隆”滋补身体”为主。
综上所述,本研究在藏医药理论指导下,应用网络药理学和分子对接技术对藏药五味沙棘散中活性成分、作用靶点、信号通路进行分析。体现了藏药五味沙棘散“多成分-多靶点-多途径”的作用特点,五味沙棘散的核心活性成分(甘草异黄烷酮、甘草苷、槲皮素、山奈酚)能通过与血管紧张素转换酶II(ACE2)、细胞丝氨酸蛋白酶TMPRSS2和COVID-19 3CL水解酶结合作用于AKT1、PTGS2、EGFR等靶点,调节多条信号通路,从而可能达到对COVID-19的治疗作用。藏医理论与化学、分子手段相结合,可能为藏药治疗COVID-19以及后期的药物开发提供一种新的思路。本课题组后续将采用动物体内外实验,进一步探索藏药五味沙棘散治疗COVID-19的药效作用及其机制,为其进一步开发利用提供更多的依据。

