蜗牛黏液多糖的提取、表征及抗氧化性和免疫活性
王慧阳,秦 靖,庄 丹,刘春尧,张 艺,张立慧,吕广萍,3
(1.南京工业大学 生物与制药工程学院,江苏 南京 211800; 2.南京工业大学 药学院,江苏 南京 211800; 3.中国中医科学院 中药资源中心,北京 100700)
蜗牛(Achatinafulica),属软体动物腹足纲,爬行时足腺可以分泌大量黏液[1]。蜗牛黏液是一种独特而复杂的保护性分泌物,呈黏稠状态[2]。药理学研究表明:其具有抗菌、镇痛、抗癌[3]和许多其他生物活性[4],已被用于护肤、愈合切割及划痕,还有治疗牙龈炎的作用[5]。蜗牛黏液包含多种生物活性物质如肽[4]、天然尿囊素、维生素[6]、钙[5]、多糖[7]及其配合物[8]。其中,多糖及其配合物包括凝集素(糖蛋白)[9]和硫酸肝素(糖胺聚糖),已被证明有镇痛、抗癌、促进伤口愈合和抗菌的生物活性[1,3-4,10]。实际上,多糖已被认为是其生物活性的新型功能组分,而多糖的生物活性与其理化性质密切相关[11]。迄今为止,蜗牛黏液的化学研究主要集中在肽和糖蛋白上,特别是对抗菌肽的纯化和表征方面[3,10,12-13]。目前,蜗牛软体多糖已有被分离、纯化和表征的报道[14-15],但据了解,蜗牛黏液多糖尚未被分离,其结构和活性也尚未被研究。
本研究中,笔者从蜗牛黏液中提取水溶性多糖。通过高效凝胶色谱串联紫外、示差和多角度激光散射检测器(HPSEC-UV-RI-MALLS)、红外光谱(FT-IR)和气相色谱串联质谱(GC-MS)表征蜗牛多糖的化学结构。通过2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐自由基(ABTS·+)清除实验和羟基自由基(·OH)清除实验来评价蜗牛多糖抗氧化活性,并研究了蜗牛黏液多糖对小鼠巨噬细胞的作用,以评估其免疫调节活性。本研究旨在进一步开发应用蜗牛黏液的多糖,为更深入研究蜗牛黏液多糖的生理活性及其构效关系提供数据支持,以期对蜗牛黏液多糖在药品及食品领域中的开发利用提供实验及理论依据。
1 材料与方法
1.1 材料
1.1.1 实验材料
蜗牛黏液,浙江嘉兴潜福食品有限公司。小鼠巨噬细胞(RAW264.7),中国科学院上海生命科学研究院细胞资源中心。
1.1.2 实验仪器
纯水仪,美国Aquapro公司;台式离心机,湖南湘仪离心机仪器有限公司;Micro21型高速冷冻离心机、1510型酶标仪、傅里叶红外光谱仪,美国Thermo公司;冷冻干燥机,美国LABCONCO公司;KH-500DE型超声清洗仪,江苏昆山超声仪器有限公司;氮吹仪,杭州奥盛仪器有限公司;AKTA蛋白纯化系统,美国GE公司;DAWN HELEOS多角度激光散射仪,美国怀亚特公司;RefractoMax 520型示差检测器,美国ERC公司;7890气相色谱仪连用5975C型质谱检测器,美国Aglient公司;NovoCyte 2060R型流式细胞仪,美国ACEA公司。
1.1.3 实验药品
D-核糖(D-Rib)、L-鼠李糖(L-Rha)、D-阿拉伯糖(D-Ara)、D-木糖(D-Xyl)、D-岩藻糖(D-Fuc)、D-甘露糖(D-Man)、D-葡萄糖(D-Glc)、D-半乳糖(D-Gal)、D-甘露醇(D-Ma-ol),异硫氰酸荧光素缀合的葡聚糖(FITC-葡聚糖40000),Sigma公司;普通高糖培养基DMEM 培养基、胎牛血清、双抗,美国Gibco公司;格里斯试剂,上海碧云天生物技术有限公司;IL-6、TNF-α酶联免疫吸附实验(ELISA)试剂盒,南京迪兆生物科技有限公司;其他化学试剂均为分析纯,上海国药集团化学试剂有限公司。
1.2 实验方法
1.2.1 蜗牛黏液多糖的提取
量取蜗牛黏液10 mL,3 000 r/min离心10 min以除去杂质,然后加入4倍体积的95%乙醇,在4 ℃下静置12 h。再次3 000 r/min离心10 min,收集沉淀,并用正丁醇和丙酮洗涤沉淀物以脱脂,然后用N2吹干。将干燥的样品加入10 mL水中充分溶解并用Sevag试剂(正丁醇和氯仿体积比为1∶ 4,)处理以除去蛋白质[16]。收集上清液冷冻干燥,最后得到蜗牛黏液多糖的干燥粉末。
1.2.2 蜗牛黏液多糖的化学结构表征
1)蜗牛黏液多糖的红外光谱分析。称取1 mg干燥样品,直接在傅里叶红外光谱仪400~4 000 cm-1的范围内检测。
2)蜗牛黏液多糖中糖醛酸含量的测定。称取蜗牛黏液多糖样品5 mg,置于密封小玻璃样品瓶中,用2 mol/L三氟乙酸(1 mL)在90 ℃下水解6 h,然后用N2吹至干燥以除去残余的三氟乙酸。采用硫酸咔唑法测定糖醛酸的含量[12,17]。将250 μL多糖样品(1.77 mg/mL)和1.5 mL四硼酸钠溶液混合,在100 ℃下加热10 min,然后快速冷却。再向反应物中加入50 μL质量分数为0.12%咔唑溶液,混合后在100 ℃下加热15 min,然后立即在冰水中冷却,1 h后于535 nm下测量其吸光度。以标准半乳糖醛酸溶液绘制标准曲线(0.1~0.5 mg/mL),根据标准曲线测定糖醛酸含量。以上所有测量重复3次。
3)蜗牛黏液多糖中单糖组成的分析。参照文献[18]的方法进行组成单糖分析。将多糖样品(5 mg)置于密封小玻璃样品瓶中,用2 mol/L三氟乙酸(1 mL)在95 ℃下水解6 h。加甲醇去除多余的三氟乙酸溶液,重复3次,N2吹干。随后,加入0.5 mL吡啶和10 mg盐酸羟胺,90 ℃孵育30 min,然后加入0.5 mL乙酸酐,90 ℃孵育30 min。将衍生物用N2吹干,加甲醇,再吹干,重复3次后用甲醇溶解,过0.22 μm微孔滤膜,用GC-MS进行分析。
GC-MS工作条件:色谱柱为Agilent HP-5MS(30 m×0.25 mm,0.25 μm);载气(He)流速为1 mL/min;升温程序为初始柱温170 ℃,保持5 min,以5 ℃/min的升温速度将柱温升至185 ℃并保持5 min,然后以4 ℃/min升至200 ℃,最后20 ℃/min升至280 ℃保持2 min。进样口温度为250 ℃;进样量为2 μL;分流比为10∶ 1。
4)蜗牛黏液多糖的甲基化分析。在文献[19]的基础上做了少量修改后,对蜗牛黏液多糖进行甲基化分析。取5 mg蜗牛黏液多糖,加2 mL二甲亚砜溶液充分溶解,再加10 mg NaOH干燥粉末,超声20 min;然后加入0.1 mL CH3I,超声60 min;取出样品,冷却至室温,并加入0.1 mL CH3I,然后再超声60 min;最后加1 mL去离子水终止反应。将反应混合物用去离子水透析过夜至无色透明,用N2吹干。随后,将干燥后的反应物重新溶解在1 mL 2 mol/L三氟乙酸(TFA)中,并在95 ℃下水解3 h。最后,将部分甲基化的单糖在室温下用20 mg/mL NaBH4还原2 h,并用4 mol/L乙酸中和。N2吹干后,将样品用1 mL吡啶/乙酸酐体积比为(1∶ 1)在95 ℃下乙酰化30 min。乙酰化产物吹干,加甲醇,再吹干,重复3次后用甲醇溶解,过0.22 μm微孔滤膜,进样用GC-MS分析。
GC-MS分析条件:色谱柱为Agilent HP-5MS (30 m×0.25 mm,0.25 μm);升温程序为初始柱温140 ℃,保持1 min,以8 ℃/min升温速度升至250 ℃,最后以20 ℃/min的升温速度升至280 ℃,保持4 min;载气 (He) 流速为1.0 mL/min;进样口温度为250 ℃;进样量为1 μL;分流比为10∶ 1。
5)蜗牛黏液多糖的分子量分布测定。采用HPSEC-UV-RI-MALLS系统对蜗牛黏液多糖进行分子量分布的测定[20]。采用SHODEXO HpaK-SB-G-000保护柱串联SHODEXO HpaK-SB-803HQ凝胶渗透色谱柱,流动相为质量分数0.9% NaCl 溶液,流速为0.5 mL/min。多糖样品溶液(3 mg,溶于1 mL去离子水)经0.22 μm滤膜过滤后进样100 μL测定。示差折光指数增量(dn/dc)设定为0.138 mL/g。紫外吸收波长设置为260 nm。ASTRA 6.0软件收集及处理数据。
1.2.3 蜗牛黏液多糖的抗氧化活性分析
1)蜗牛黏液多糖的ABTS·+清除能力测定。ABTS·+清除试验参照文献[21]的方法进行测定。以去离子水将ABTS和过硫酸钾分别溶解为7、4.95 mmol/L,等体积混合,在室温避光条件下静置。测定时,将ABTS·+储备液用0.2 mol/L PBS溶液(pH 7.4) 稀释,使其在734 nm处吸光度达(0.7±0.02),形成ABTS·+测定液。测定时将200 μL ABTS·+测定液和20 μL不同质量浓度样品待测液(10.0、5.00、2.50、1.25、0.625、0.313和0.156 mg/mL)加入到96孔板中,振荡30 s,反应6 min后于734 nm处测吸光值A1,以去离子水为空白对照吸光值为A0,样品吸光值为A2(PBS代替ABTS·+),不同质量浓度Vc(5.00、2.50、1.25、0.625、0.313、0.156和0.078 mg/mL)为阳性对照,每个样本重复测定3次,取平均值。ABTS·+清除率按式(1)计算。
ABTS·+清除率=[1-(A1-A2)/A0]×100%
(1)


(2)
1.2.4 蜗牛黏液多糖的免疫活性测定
1)细胞培养。巨噬细胞细胞培养在含有10%(体积分数)胎牛血清和100 IU双抗(青、链霉素)的DMEM培养基中,在体积分数为5%的CO2、饱和湿度、37 ℃环境下生长,取处于生长对数期的细胞进行实验。
2)蜗牛黏液多糖对巨噬细胞NO释放的影响。参照文献[19]的方法,选取对数生长期巨噬细胞,以每孔200 μL、5×104种植于96孔培养板中,将培养板置37 ℃、体积分数为5%的CO2培养箱中孵育12 h。实验分为正常对照组、蜗牛黏液多糖组和阳性对照组。正常对照组每孔加入200 μL DMEM培养基,蜗牛黏液多糖组加不同质量浓度(1、10、50、100、200和500 μg/mL)的多糖溶液,阳性对照组加1.0 μg/mL脂多糖(LPS),作用巨噬细胞24 h后用格里斯试剂与上清液1∶ 1(体积比)反应10 min后于540 nm波长下检测吸光值。NO释放量用实验组和空白组之间的比率来表示。
3)蜗牛黏液多糖对巨噬细胞吞噬活性的影响。参照文献[19]的方法,选取对数生长期巨噬细胞,以每孔300 μL、2×105种植于24孔培养板中,将培养板置37 ℃、体积分数为5%的CO2培养箱中孵育12 h。实验分为正常对照组、蜗牛黏液多糖组、阳性对照组。正常对照组每孔加入300 μL DMEM培养基,蜗牛黏液多糖组加不同质量浓度 (0.1、1、10、 50、100和200 μg/mL)的多糖溶液,阳性对照组加1.0 μg/mL LPS,作用巨噬细胞24 h后,用0.1 mg/mL的FITC-葡聚糖孵育细胞60 min,随后用含体积分数为0.2%胎牛血清(FBS)的PBS清洗3次,将细胞转移出来后用流式细胞仪分析。吞噬活性用实验组和空白组之间的比率来表示。
4)蜗牛黏液多糖对巨噬细胞释放细胞因子的影响。参照文献[19]的方法,选取对数生长期巨噬细胞,以每孔200 μL、5×104种植于96孔培养板中,将培养板置37 ℃、体积分数为5%CO2培养箱中孵育12 h。实验分为正常对照组、蜗牛黏液多糖组和阳性对照组。正常对照组每孔加入200 μL DMEM培养液,蜗牛黏液多糖组加不同质量浓度(50和100 μg/mL)多糖溶液,阳性对照组加1.0 μg/mL LPS,作用巨噬细胞24 h后收集细胞上清,于4 ℃下1 000 r/min离心10 min。取上清,采用ExCell Elisa试剂盒,按照生产说明书检测培养上清中细胞因子的水平(pg/mL)。
1.3 统计学分析
数据处理采用Microsoft Excel 2016 software统计软件,所有数据以平均值±标准差(Mean±SD)表示,用t-test检验差异的显著性,对比显著以*表示(P<0.05),极显著以**表示(P<0.01)。
2 结果与讨论
2.1 蜗牛黏液多糖的化学结构表征结果
2.1.1 蜗牛黏液多糖的红外光谱分析结果

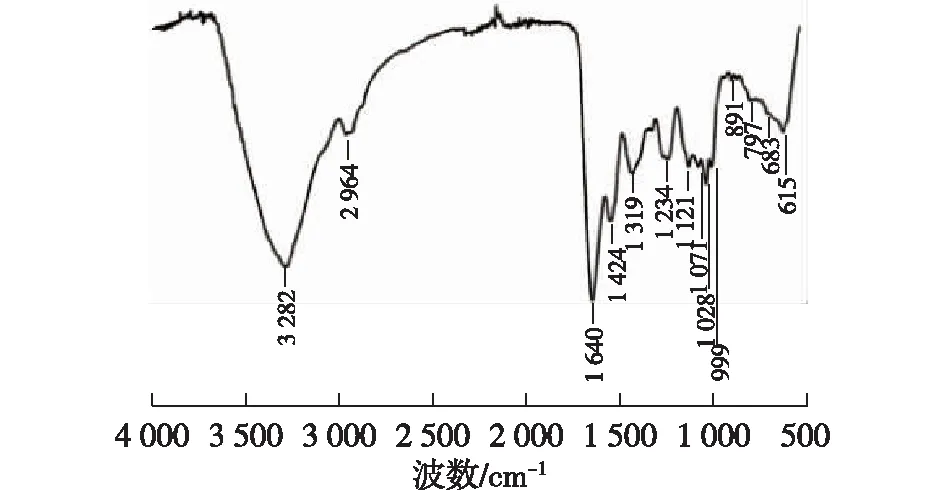
图1 蜗牛黏液多糖的红外光谱图Fig.1 Infrared spectra of A. fulica mucus polysaccharides
2.1.2 蜗牛黏液多糖的单糖组成分析结果
用咔唑硫酸法对蜗牛黏液多糖的糖醛酸含量进行测定,标准曲线见图2。由图2可知,回归方程为Y=6.449 83X+0.050 75,R2=0.999 4。通过标准曲线计算,得蜗牛黏液多糖含质量分数为9.1%的糖醛酸。
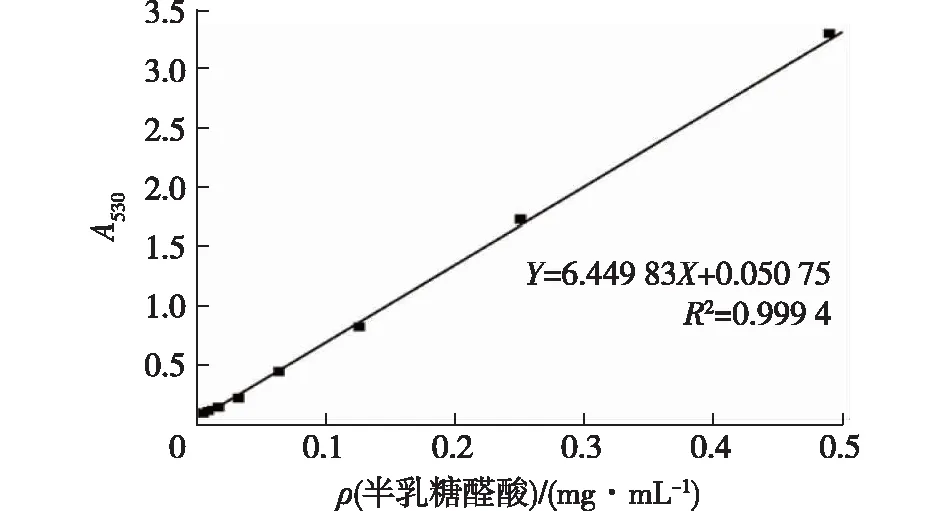
图2 半乳糖醛酸的标准曲线Fig.2 Standard curve of galacturonic acid
蜗牛黏液多糖单糖组成的结果见图3。由图3可知:蜗牛黏液中含有Fuc、Man、Glc和Gal,其摩尔比(MR)分别为1.69∶ 2.46∶ 0.12∶ 1。Liao等[15]已经从蜗牛软体中分离出来葡聚糖,但是本实验结果表明了蜗牛黏液多糖中还含有Fuc、Man和Gal,这说明蜗牛黏液中含有其他种类的多糖。事实上,多糖的活性与它们的单糖组成密切相关[11,24]。多糖中半乳糖的含量与亚铁离子的还原能力呈正相关性[24]。 Fuc和Man是蜗牛黏液多糖中主要的单糖,已经被证明与多种药理活性相关,包括抗肿瘤、抗氧化和抗炎等[11]。这些研究结果都表明蜗牛黏液多糖具有潜在的药理活性。

图3 蜗牛黏液多糖的单糖组成分析Fig.3 Analysis of compositional monosaccharide ofA. fulica mucus polysaccharides
2.1.3 蜗牛黏液多糖的糖苷键分析结果
采用GC-MS方法对蜗牛黏液多糖进行甲基化分析,以确定多糖中的糖苷键。表1总结了蜗牛黏液多糖的甲基化分析结果。由表1可知,多糖包括以下单元,Fucp(2,3,4-Me3-Fuc;MR 1.17)、Galp(2,3,4,6-Me4-Gal;MR 1.91)、Fucp(2,4-Me2-Fuc;MR 3.50)、Manp(3,4,6-Me3-Man;MR 9.20)、Manp(2,4,6-Me3-Man;MR 2.26)、Manp(4,6-Me2-Man;MR 1.00)和Glcp(2,4-Me2-Glc;MR 0.77)。从每部分的比例来看,蜗牛黏液多糖骨架可能由→2) Manp-(1→组成,此外也会有较大比例的→3) Fucp-(1→。

表1 蜗牛黏液多糖的GC-MS甲基化分析结果
2.1.4 蜗牛黏液多糖的分子量分布测定结果
使用HPSEC-UV-RI-MALLS系统测定蜗牛黏液多糖的分子量分布。图4显示蜗牛黏液中有5种具有不同分子量的组分。由图4可知,峰1分子量为4.549×106,没有紫外吸收,表明该部分是多糖。虽然其他4个峰都具有紫外吸收,而且随着示差(RI)吸收的减少,紫外吸收增加,这表明这4个峰可能是糖蛋白,分子量分别为1.392×105、6.291×104、5.262×104和4.153×104,并且随着分子量的减少,糖蛋白中蛋白的相对含量增加。Kubota等[25]发现蜗牛黏液中有一种抗菌作用的糖蛋白,其分子量约为1.6×105。Mitra等[2]发现了蜗牛黏液里的凝集素,是一种分子量为7×104的糖蛋白,同时还有研究发现蜗牛黏液含有分子量3.5×105的凝集素[9]。这些研究都表明:蜗牛黏液中糖蛋白的分子量与本研究结果相似。此外,最后强烈的紫外吸收可能来自蜗牛黏液中分子量较小的糖蛋白,因为太小而不能被MALLS检测器很好地检测到,并且计算出分子量。

红色线为MALLS吸收,蓝色线为RI吸收,绿色线为UV吸收图4 蜗牛黏液多糖的HPSEC-UV-RI-MALLS 色谱图及其分子量分布Fig.4 HPSEC-UV-RI-MALLS chromatographic profiles and the molecular weight distribution of A. fulica mucus polysaccharides
2.2 蜗牛黏液多糖的抗氧化活性结果
2.2.1 蜗牛黏液多糖对ABTS·+的清除能力测定结果
ABTS·+脱色实验已被广泛用于评估亲水性和亲脂性抗氧化剂的抗氧化活性,如:多糖、血浆、类胡萝卜素、羟基肉桂酸酯和黄酮类抗氧化剂[21]。因此,ABTS·+也可用于本研究中以评价蜗牛黏液多糖的抗氧化活性,结果如图5(a)所示。由图5(a)可知,蜗牛黏液多糖的ABTS·+清除能力与浓度呈正相关性,在10 mg/mL质量浓度下其清除能力为73%,并且清除ABTS·+的半抑制浓度(IC50值)为2.35 mg/mL。有研究发现,具有β构型的吡喃糖结构的牛肝菌多糖,有较强的自由基清除活性和亚铁离子还原能力,推测蜗牛黏液多糖中的该结构也有助于其抗氧化活性的发挥[24]。

图5 蜗牛黏液多糖对ABTS·+和·OH的清除活力Fig.5 Scavenging effects on ABTS radicals and hydroxyl radicals of A. fulica mucus polysaccharides
2.2.2 蜗牛黏液多糖对·OH的清除能力测定结果

笔者还比较了原始黏液(original liquid),醇沉淀去除蛋白质前(before PR)和去除蛋白质后(after PR)的抗氧化活性(图5)。由图5可知,原始黏液具有最高的抗氧化活性,这表明在蜗牛黏液中一定存在其他小分子抗氧化成分。对于ABTS·+和·OH,醇沉物去除蛋白质前后显示出类似的清除作用,特别是对·OH的清除。该结果表明,蜗牛黏液中大分子的抗氧化活性可能归因于多糖及其配合物。同时,一些草药来源的多糖在去除蛋白质前后的抗氧化活性明显不同,去除蛋白质前的多糖表现出更好的抗氧化活性[27]。
2.3 蜗牛黏液多糖体外免疫活性的测定结果
2.3.1 蜗牛黏液多糖对巨噬细胞NO产量的影响结果
NO可以作为细胞内气体信号分子介导多种生物学功能,例如:血管舒张、神经传递、免疫反应和血小板聚集,NO也参与巨噬细胞的溶细胞功能[28]。蜗牛黏液多糖孵育巨噬细胞24 h后,NO产量见图6(a)。由图6(a)可知,蜗牛黏液多糖对巨噬细胞产生NO具有显著的刺激能力(P<0.05)。LPS(1.0 μg/mL)与对照组相比,诱导的NO产量为(392.8±9.0)%,在多糖质量浓度为500.0 μg/mL时,刺激巨噬细胞产生NO的活力与LPS相似。在多糖质量浓度为10.0~500.0 μg/mL时,NO产生水平呈增加趋势。该结果表明:蜗牛黏液多糖可以促进巨噬细胞体外产生NO,呈浓度依赖性。
2.3.2 蜗牛黏液多糖对巨噬细胞的影响结果
随后研究了蜗牛黏液多糖对巨噬细胞的吞噬活性(FITC-葡聚糖摄取)的影响,见图6(b)。由图6(b)可知,不同质量浓度(0.1、1、10、50、100和200 μg/mL)的蜗牛黏液多糖和LPS(1.0 μg/mL)可以显著增加巨噬细胞的吞噬活性(P<0.05)。质量浓度为100 和200 μg/mL的蜗牛黏液多糖的吞噬活性均显著高于LPS(P<0.05)。该结果表明蜗牛黏液多糖能明显增加巨噬细胞的吞噬活性。
2.3.3 蜗牛黏液多糖刺激巨噬细胞产生细胞因子的测定结果
蜗牛黏液多糖可以促进巨噬细胞释放细胞因子(TNF-α和IL-6)见图6(c)。由图6(c)可知,蜗牛黏液多糖对巨噬细胞具有明显的免疫调节活性。TNF-α细胞因子的质量浓度从(1 538.3±63.6) pg/mL增加到(1 979.9±34.8)pg/mL。同时,IL-6细胞因子的质量浓度从(1 355.6±112.7) pg/mL增加到(2 608.7±210.6) pg/mL。与正常对照组相比,TNF-α和IL-6细胞因子均有显著的增加(P<0.05)。蜗牛黏液多糖(100.0 μg/mL)处理的巨噬细胞比阳性对照LPS(1.0 μg/ml,P<0.05)显著分泌更多的TNF-α和IL-6。

*表示P<0.05;**表示P<0.01;蜗牛黏液多糖组、LPS组均与空白对照组对比图6 蜗牛黏液多糖对巨噬细胞的免疫调节活性Fig.6 Immunomodulatory activity of A. fulica mucus polysaccharides
3 结论
本研究中,笔者提取并表征了蜗牛黏液的水溶性多糖。蜗牛黏液多糖的单糖组成为Fuc、Man、Glc和Gal,摩尔比为1.69∶ 2.46∶ 0.12∶ 1。多糖中糖醛酸的含量为9.1%。蜗牛黏液多糖骨架中存在多种类型的连接,最多的为→2)Manp-(1→,→3)Fucp-(1→和→3)Manp-(1→。蜗牛黏液多糖含有5个不同组分,分子量分别为4.549×106,1.392×105,6.291×104,5.262×104和4.153×104。体外抗氧化实验表明,蜗牛黏液多糖具有很好地清除ABTS·+和·OH的能力,IC50值分别为2.35和4.70 mg/mL。此外,蜗牛黏液多糖可明显刺激巨噬细胞产生免疫调节作用。因此,蜗牛黏液多糖可作为天然抗氧化剂和免疫调节剂应用于食品甚至药物中。

