缝隙连接蛋白(Cx)在稳定型冠心病中表达缺失的横断面研究
包丽雯 林杨毅 张津津 陈 华 施海明 李 剑 严萍萍△
(1复旦大学附属华山医院北院心内科 上海 201901;2复旦大学附属华山医院心内科 上海 200040)
动脉粥样硬化的发生发展由多种因素共同参与,其发病机制尚未完全阐明。缝隙连接蛋白(connexin,Cx)的表达异常与冠心病发生发展有一定关系。Cx 是一组跨膜蛋白质家族,Cx 组成了缝隙连接。缝隙连接是细胞连接的主要方式之一,发挥着加强细胞间机械联系、维持组织结构完整、协调细胞间功能活动的重要作用。分子物质通过缝隙连接在细胞质之间穿行、易化、扩散,因此Cx 的正常表达对细胞间的信息传递和相互作用有着重要影响[1-3]。在心血管系统中稳定表达的Cx 有Cx37、Cx40、Cx43、Cx46 等,Cx37 主要表达于内皮细胞和单核细胞中,Cx43 表达于内皮细胞、平滑肌细胞、单核细胞中,Cx40和Cx46表达于内皮细胞及其他白细胞[4-6]。
Cx 的表达改变会导致细胞间通讯功能紊乱,这或与动脉粥样硬化发生发展密切相关。Wong 等[7]发现,在载脂蛋白E 缺陷(ApoE-/-)的小鼠模型中,Cx37 缺失的小鼠与 Cx37 表达正常的小鼠相比,会发生更严重的冠状动脉粥样硬化。Jean 等[8]认为Cx 可能通过调控单核细胞与内皮细胞的黏附,影响一氧化氮的释放,从而影响动脉粥样硬化进程,Cx可能具有抗动脉粥样硬化的作用。目前公认Cx37和Cx40 具有抗动脉粥样硬化的属性,而Cx43 对于动脉粥样硬化的影响并不明确[9-10]。
本研究拟通过冠状动脉内取血来分离单核细胞,比较冠心病与非冠心病患者冠状动脉系统内皮-单核细胞中几种Cx 的表达差异,以观察Cx 对冠状动脉粥样硬化进程的影响。冠脉内直接采血分离单核细胞,发现该单核细胞分泌的几种在心血管中重要的缝隙连接蛋白的表达是本研究的创新之处。
资料和方法
研究对象本研究为单中心、小规模的横断面研究,经复旦大学附属华山医院伦理委员会批准(伦理号:KY2017-282)。于 2018 年 3—6 月,在因稳定型心绞痛入复旦大学附属华山医院北院拟择期行冠状动脉造影(coronary aniography,CAG)的患者中,根据CAG 结论,将签署知情同意书并同意经冠状动脉采血的患者分别归入冠心病组及非冠心病组,同时进行冠状动脉采血。
纳入和排除标准纳入标准:(1)年龄≥18 岁;(2)因稳定型心绞痛入院,择期行 CAG 的患者;(3)根据CAG 结论进行分组;冠心病(CAD)组为CAG明确至少有1 支冠状动脉血管狭窄在70%以上,或行PCI 治疗者;非冠心病(non-CAD)组为经 CAG 明确冠状动脉仅存在散在斑块或未见明显异常者。
排除标准:(1)因急性心肌梗死入院接受治疗的患者;(2)经CAG 证实狭窄程度为轻中度(20%~50%)或狭窄程度中度以上(50%~70%)的患者;(3)拒绝进行冠状动脉内采血的患者。
病例收集及检测指标收集入组患者的基线数据资料:年龄、性别、BMI 指数、吸烟史、血压、血肌酐、尿酸、血脂水平、pro-BNP、左室射血分数、高血压病史、糖尿病史等。
在行CAG 时,将患者冠状动脉血样(3 mL)收集于抗凝管中,立即用4 800 r/min 离心机(离心半径24 cm)高速离心15 min 后,取上层血浆并分离单核细胞,置于-80 ℃冰箱内保存。待所有患者血标本收集完成后,采用单盲法,由实验人员对分离得到的单核细胞标本的 Cx37、Cx40、Cx43、Cx46 进行qRT-PCR 定量分析。用TRIzol 从离心的单核细胞中 提 取 RNA,并 使 用 RT-master(RR036,日 本TAKARA 公司)将其逆转录成CDNA。用qRFPCR 方法检测 Cx37,Cx40,Cx43,Cx46 mRNA 表达水平。TB Green RR420 作为参考基因。
统计学方法Stata 13.0 软件对患者基线资料及分子标志物的定量结果进行分析。基线资料中呈正态分布的连续变量用两组t检验(±s),非正态分布的两组连续变量用秩和检验[Median(P25,P75)],非连续变量用χ2检验(%)进行统计分析。采用Logistic 多因素回归分析分别对Cx37、Cx40、Cx43、Cx46 进行组间统计学分析。P<0.05 为差异有统计意义。
结 果
入组情况研究时间窗内,共122 例患者行CAG,91 例患者签署知情同意书。经造影结果确认,最终81 例入选。其中35 人归入冠心病组、46 人归入非冠心病组,均完成病史采集、血样采集及单核细胞分离工作(图1)。
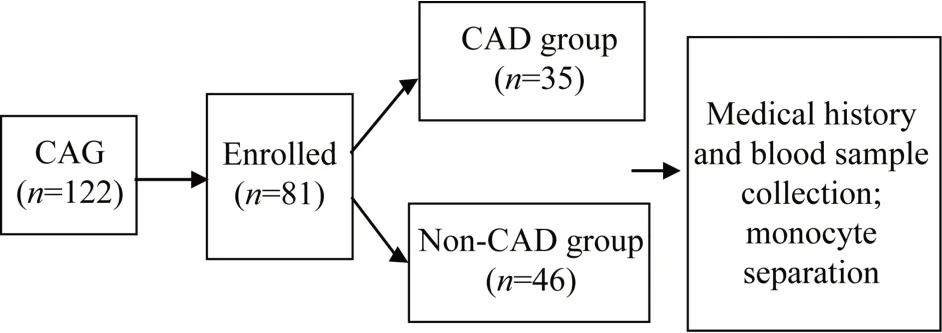
图1 研究对象入组流程图Fig 1 Group flow chart of the participants
基线资料比较两组患者年龄、性别、BMI、血压、肾功能、血脂代谢水平、左室射血分数、Pro-BNP、既往高血压病病史、既往脑梗病史、既往外周血管病病史差异均无统计学意义。但冠心病组患者糖尿病患病率(44.3%vs.19.8%,P=0.025)及糖化血红蛋白水平(6.78%±1.35%vs.5.75%±0.27%,P=0.04)显著高于非冠心病组患者(表1)。
Cx 表达结果对两组患者单核细胞的缝隙连接蛋白qRT-PCR 定量分析结果提示:与非冠心病组相比,冠心病组患者的 Cx37、Cx40、Cx43、Cx46 表达均降低,其中Cx43 差异有统计学意义(表2)。
多因素分析Logistic 多因素回归分析提示:在校正混杂因素后(年龄、性别、BMI、高血压病、糖尿病、低密度脂蛋白、eGFR、高尿酸血症、糖化血红蛋白),冠心病组Cx43 的低表达有统计学意义(OR=0.54,P=0.023,95%CI:0.47~0.95;OR=0.63,P=0.043,95%CI:0.41~0.98)(表3),ROC 曲线下面积为 0.86。CHD 组 Cx37、Cx40、Cx46 表达 低于 non-CHD 组,但差异无统计学意义。
讨 论
血管内皮功能受损时,此受损区域开始表达黏附分子E-选凝素(E-selectin)、白细胞黏附受体(leukocyte adhesion receptor)等,随后 LDL-C 开始向内皮细胞聚集并氧化,氧化的LDL-C 连同黏附分子导致单核细胞等向内皮细胞聚集、黏附,并迁移至内膜下,发动动脉粥样硬化。此时,单核细胞表面表达的唾液酸化路易斯寡糖与内皮细胞表面的炎症介质诱导的E-选凝素等相互作用,介导单核细胞贴壁,并通过后续各因子的共同作用影响动脉粥样硬化进程[11-12]。
表1 冠心病组与非冠心病组基线特征比较Tab 1 Baseline comparison between CAD group and non-CAD group (±s)
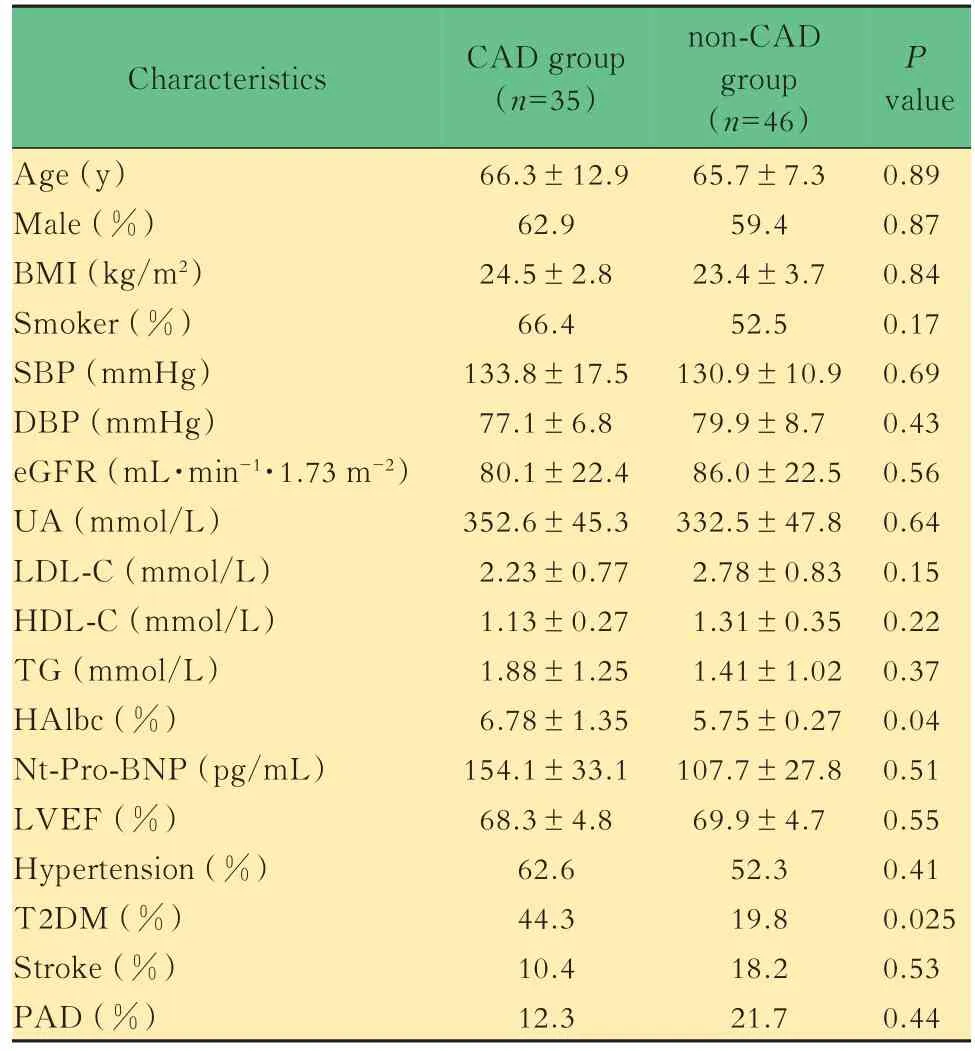
表1 冠心病组与非冠心病组基线特征比较Tab 1 Baseline comparison between CAD group and non-CAD group (±s)
BMI:Body mass index;SBP:Systolic blood pressure;DBP:Diastolic blood pressure;eGFR:Estimated glomerular filtration rate;UA:Uric acid;LDL-C:Low density lipoprotein cholesterol;HDL-C:High-density lipoprotein cholesterol;TG:Triglycerides;HAlbc:Glycated hemoglobin;LVEF:Left ventricular ejection fraction;T2DM:Type 2 diabetes mellites;PAD:Peripheral vascular disease.
P value 0.89 0.87 0.84 0.17 0.69 0.43 0.56 0.64 0.15 0.22 0.37 0.04 0.51 0.55 0.41 0.025 0.53 0.44 Characteristics Age(y)Male(%)BMI(kg/m2)Smoker(%)SBP(mmHg)DBP(mmHg)eGFR(mL·min-1·1.73 m-2)UA(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L)TG(mmol/L)HAlbc(%)Nt-Pro-BNP(pg/mL)LVEF(%)Hypertension(%)T2DM(%)Stroke(%)PAD(%)CAD group(n=35)66.3±12.9 62.9 24.5±2.8 66.4 133.8±17.5 77.1±6.8 80.1±22.4 352.6±45.3 2.23±0.77 1.13±0.27 1.88±1.25 6.78±1.35 154.1±33.1 68.3±4.8 62.6 44.3 10.4 12.3 non-CAD group(n=46)65.7±7.3 59.4 23.4±3.7 52.5 130.9±10.9 79.9±8.7 86.0±22.5 332.5±47.8 2.78±0.83 1.31±0.35 1.41±1.02 5.75±0.27 107.7±27.8 69.9±4.7 52.3 19.8 18.2 21.7
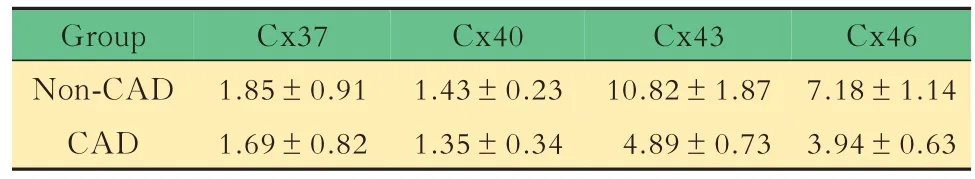
表2 冠心病组与非冠心病组患者Cx 表达量差异比较Tab 2 Connexins comparison between CAD group and non-CAD group
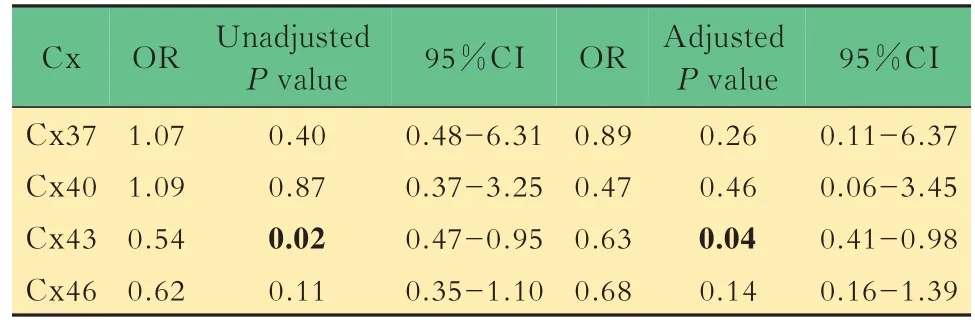
表3 冠心病组与非冠心病组患者Cx 的Logistic多因素回归分析Tab 3 Logistic regression of connexins in terms of CAD group compared with non-CAD group
单核细胞与内皮细胞之间的黏附与相互作用极依赖于细胞连接结构,缝隙连接是一种重要的细胞连接。单核细胞仅存在于血管中,单核细胞表面表达Cx,介导单核细胞与内皮细胞之间的相互作用。当Cx 基因缺失时,单核细胞与内皮贴壁作用加速,加重动脉粥样硬化。例如,在早期血管内皮功能受损情况下,黏附分子会伴随Cx37、Cx43 等表达异常而发生变化,引起脂质残片向内膜下沉积及炎症因子浸润,为巨噬细胞游走并形成泡沫细胞形成粥样硬化斑块提供条件[13-15]。
我们通过横断面研究观察Cx37、Cx40、Cx43 和Cx46 对冠状动脉粥样硬化的影响,发现冠心病组患者的 Cx37、Cx40、Cx43、Cx46 表达量均低于非冠心病组患者,其中Cx43 表达降低有显著统计学意义。提示与其他Cx 相比,Cx43 可能在冠心病发生发展中发挥更为关键的作用。通常,在单核细胞表面低表达Cx37 且不表达其他Cx,但随着TNF-a 和IFN-r 等免疫因子的刺激,泡沫细胞开始高表达Cx37 和Cx43。T 细胞在动脉粥样硬化斑块形成过程中有重要作用,CD4 抗原阳性的细胞(包括一些CD8+)可以介导斑块形成的免疫反应,形成局部炎症,促进斑块形成。当树突状细胞的抗原呈递细胞-Ⅱ分子与T 淋巴细胞受体桥接时,Cx43 聚集在免疫突触附近的外侧面。Cx43 表达增加可明显减少T 细胞抗原识别后的细胞内钙振荡,减少T 细胞分泌IFN-γ。因此,Cx43 对T 细胞的局部活化可能起重要的作用[17]。郑涛等[17]通过分析认为在冠心病及心肌梗死患者中,Cx43 可能从改善线粒体功能开始,发挥改善心肌缺血再灌注损伤修复的作用。陈林等[18]观察到在心肌梗死患者中,心肌不同部位Cx43表达差异较大,在部分梗死中心区表达甚至完全消失,并发生少量的重新分布;而在非梗死处心肌Cx43 表达量基本正常,但该处细胞闰盘的Cx43 亦稍被破坏,而重新分布于细胞一侧相接处。心肌缺血时Cx43 会发生脱磷酸化,且程度与心室肌细胞电耦联障碍程度呈正相关,缺血症状改善后,随着该处Cx43 恢复磷酸化功能,心肌的收缩功能会逐渐恢复,但若该患者存在Cx43 的表达缺失,将影响心肌功能的恢复。我们的研究结论与部分文献一致,但也有不尽相同之处。提示Cx43 表达在人群中存在基因多态性的问题,低表达Cx43 人群可能对动脉粥样硬化易感。
综上所述,冠心病患者中 Cx37、Cx40、Cx43、Cx46 表达量低于非冠心病患者,其中Cx43 表达降低,差异有显著的统计学意义。Cx43 缺失可能是影响冠心病发生发展的关键因子。
本研究为观察性研究,且样本量较小,尚需在大规模人群中对基因多态性观察并进行验证。此外,仅为单中心的横断面研究,只观察了我中心患者稳定型冠心病与Cx 表达量的相关性,并不能明确因果关系,尚需多中心合作的大样本量的前瞻性研究进行验证。

