CT引导下射频消融(RFA)治疗晚期胰腺癌
余天柱 陈 颐 △ 龚高全 刘凌晓 王成刚 李国平 王良文 李长煜 高珊珊 王小林
(1复旦大学附属中山医院介入治疗科 上海 200032;2上海市影像医学研究所 上海 200032)
胰腺癌恶性程度较高,预后较差,患者5 年总体生存率低于5%,中位生存期小于6 个月[1]。外科手术切除是目前唯一有可能治愈胰腺癌的治疗手段。约80%的患者在确诊时已属晚期,因肿瘤侵犯周围重要解剖结构或发生远处转移,无法接受手术切除[2]。全身化疗仍是晚期胰腺癌的主要治疗方法,但是以吉西他滨为基础的传统方案的中位生存期仅为 6.8 个月[3]。新型 FOLFIRINOX 方案(奥沙利铂、伊立替康、氟尿嘧啶和亚叶酸钙)使中位生存期延长至11.1 个月,但是较重的毒性反应和副作用限制了该方案的广泛应用[4]。因此,我们仍需不断探索新的治疗策略,提高晚期胰腺癌的疗效。
射频消融(radiofrequency ablation,RFA)通过射频电流引起离子震荡后产热,可以使肿瘤组织产生凝固性坏死,作为肿瘤热消融的一种,在肝、肺、肾等实体肿瘤治疗中取得了良好的治疗效果[5-6]。由于胰腺解剖学位置和结构的特殊性,目前胰腺癌的RFA 临床应用明显落后于其他实质脏器肿瘤[7-8]。针对胰腺消融特殊性设计出的Habib EUS RFA 针(英国EMcision 公司),比传统消融针更细,并发症可能相对较少[7]。目前 Haibib EUS RFA 针尚无国内应用的报道。本研究拟在CT 引导下使用Haibib EUS RFA 针治疗晚期胰腺癌,评价Haibib EUS RFA 治疗晚期胰腺癌的可行性和安全性,并初步观察其治疗效果,为RFA 治疗晚期胰腺癌提供临床依据。
资料和方法
病例资料选择 2016 年 5 月至 2019 年 1 月于复旦大学附属中山医院介入治疗科接受CT 引导下RFA 治疗的晚期胰腺癌患者。纳入标准:(1)已完成1~3 次动脉灌注化疗的晚期胰腺癌患者;(2)获得病理学依据;(3)年龄 18~75 岁;(4)胰腺病灶未接受过放疗、碘125 粒子植入等局部治疗;(5)ECOG 评分≤2 分;(6)凝血酶原时间延长<3 s;(7)白细胞计数>4×109/L,血小板计数>85×109/L;(8)血肌酐<115 μmol/L。排除标准:(1)有胰腺穿刺禁忌证;(2)无法控制的感染;(3)患者有其他肿瘤病史;(4)预计生存期<3 个月。本研究获得复旦大学附属中山医院伦理委员会批准(R2019-136),所有患者均签署知情同意书。
所有患者治疗前行肝、肾功能、血常规、凝血功能、血清淀粉酶及CA-199 的检查。同时术前行增强CT 或增强MRI 确定胰腺内肿瘤位置、大小及周围脉管侵犯情况。
主要器材HabibEUS RFA 针(英国EMcision公司)直径 1Fr(0.33 mm),长度190 cm,工作(消融)段长度8 mm(图1A);21G 超声穿刺针(美国Cook 公司)(图 1A);Rita 1500 RF 发生器(美国Mountain View 公司)(图 1B)。
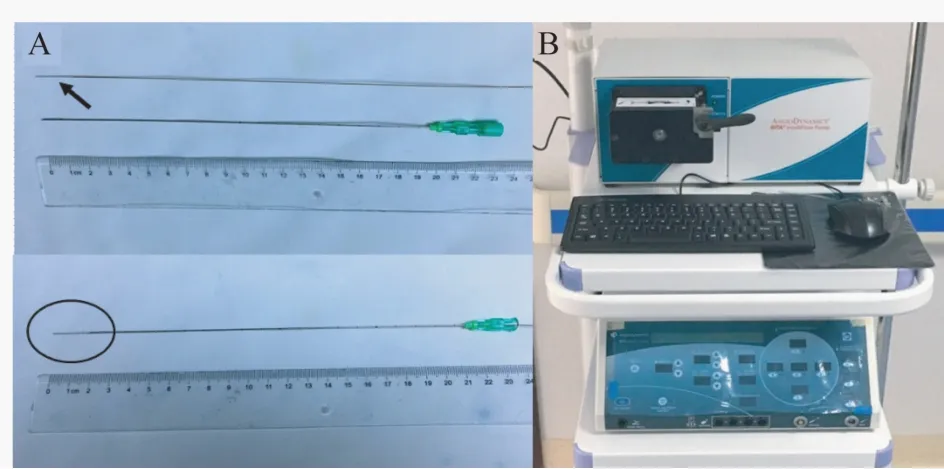
图1 胰腺消融所用的Habib EUS RFA 针及相关的21G 穿刺针Fig 1 The Habib EUS RFA probe and related 21G FNA needle for pancreatic cancer RFA
治疗方法患者仰卧位,CT 扫描后根据病灶所在位置和周围解剖结构确定穿刺点和进针角度。穿刺点局部麻醉,用21G 超声穿刺针经皮穿刺进入病灶中央部位,并接近病灶底部,距病灶底部约5 mm(图2B)。撤出21G 超声穿刺针针芯,送入Habib EUS RFA 针,消融针头端和21G 超声穿刺针齐平。固定Habib EUS RFA 针,回撤21G 超声穿刺针约2 cm,CT 扫描确认RFA 导管位置(图2C)。连接Rita 1500 RF 发生器,功率5 W,消融时间90 s。60 s 后同时撤除RFA 导管和超声穿刺针,再次CT扫描观察有无并发症(图2D)。
如病灶直径>3 cm,则行单针道两点消融。第一点消融结束后,同时回撤RFA 导管和超声穿刺针约8 mm,用同样参数进行第二点消融。
治疗后处理及观察指标术后1 天复查肝、肾功能、血常规、血清淀粉酶。为预防感染和急性胰腺炎,所有患者均接受抗生素输注(手术前3 h 口服头孢曲松1 g,每日2 次,连续3 天)和预防(术前3 h奥曲肽 0.1 mg,每日 3 次,连续 3 天)。
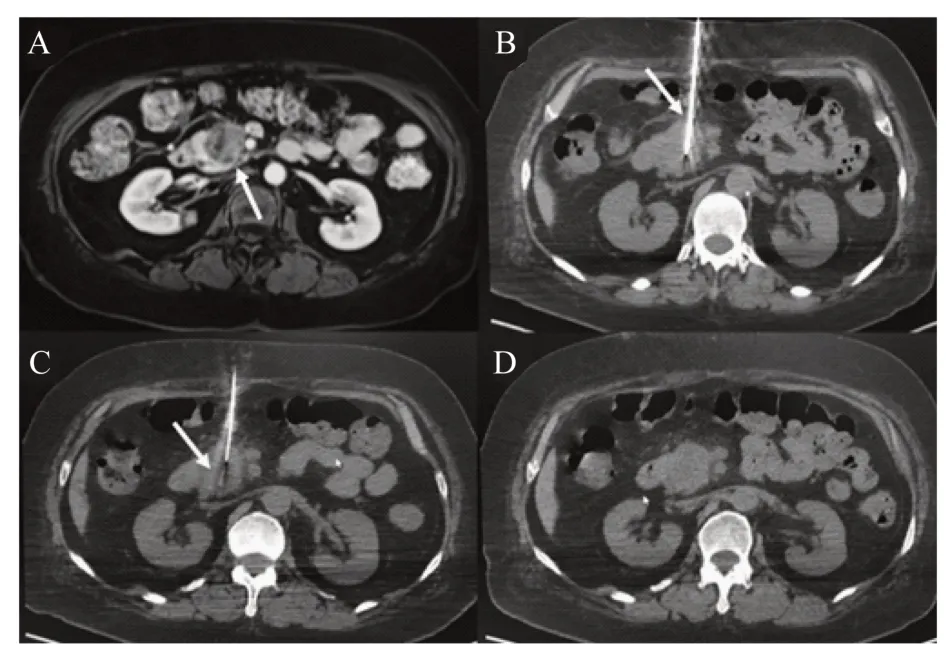
图2 CT 引导下Habib EUS RFA 治疗胰腺癌的过程Fig 2 The procedure of CT-guided Habib EUS RFA for pancreatic cancer
主要观察指标:Habib EUS RFA 治疗晚期胰腺癌的技术成功率及相关并发症。次要观察指标:Habib EUS RFA 的治疗效果。
随访所有患者术后1 个月复查肝肾功能、血常规、CA-199 以及腹部增强 CT/MRI(图 2A),观察病灶消融区域治疗后改变。
统计学方法计量资料采用±s表示,用独立样本或配对样本t检验进行分析;计数资料用百分比(%)表示,用χ2检验进行比较。通过Fisher 精确检验比较分类变量组。使用传统的线性最小二乘回归进行相关。使用SPSS 统计软件19.0 进行分析,P<0.05 为差异有统计学意义。
结 果
基本信息从 2016 年 5 月到 2019 年 1 月,6 名(4 名男性,2 名女性)晚期胰腺癌患者纳入本研究,平均年龄58.2 岁(43~66 岁)。患者的基本资料见表1。3 例病灶位于胰头部,2 例位于胰体部,1 例位于胰尾部。胰腺肿瘤长轴的平均长度为32.7 mm(23~55 mm)。 所有患者病理检查均证实为胰腺导管腺癌。所有患者RFA 治疗之前,均接受1~3 次以吉西他滨为基础的动脉灌注化疗。RFA 治疗后,所有患者继续接受以吉西他滨为基础的动脉灌注化疗。
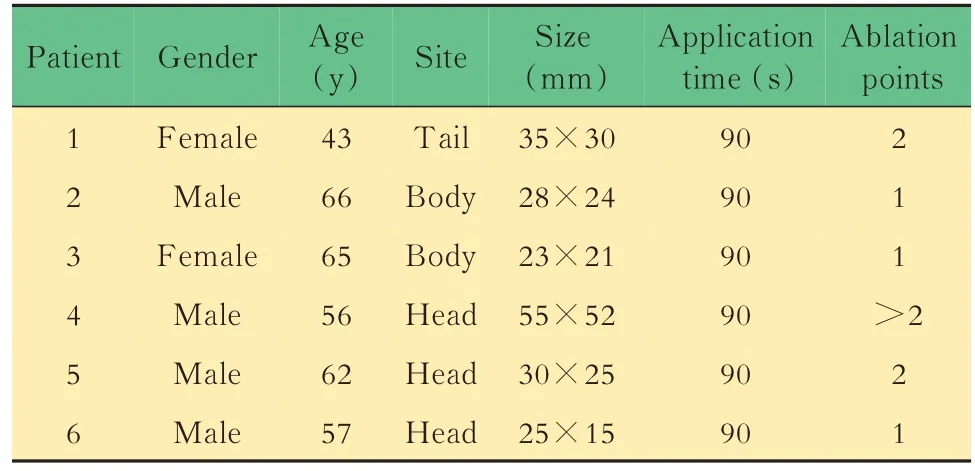
表1 晚期胰腺癌患者的基本资料Tab 1 Basic characteristics for advanced pancreatic cancer
可行性与安全性6 例患者均在CT 引导下成功实施了RFA。3 例患者行单针道单点消融,2 例患者行单针道两点消融,1 例患者行多针道多点消融。在手术期间和术后,所有患者的生命参数(血压、心率、氧合)均稳定。所有患者治疗后均无严重的治疗相关不良事件(如急性胰腺炎、出血,胰瘘等)发生。2 例患者出现RFA 后腹痛,2 天后自行缓解。1 例患者消融后淀粉酶水平升高,无任何严重急性胰腺炎的迹象,对症处理后2 天内恢复到正常范围。其他血生化指标较术前无明显变化(表2)。
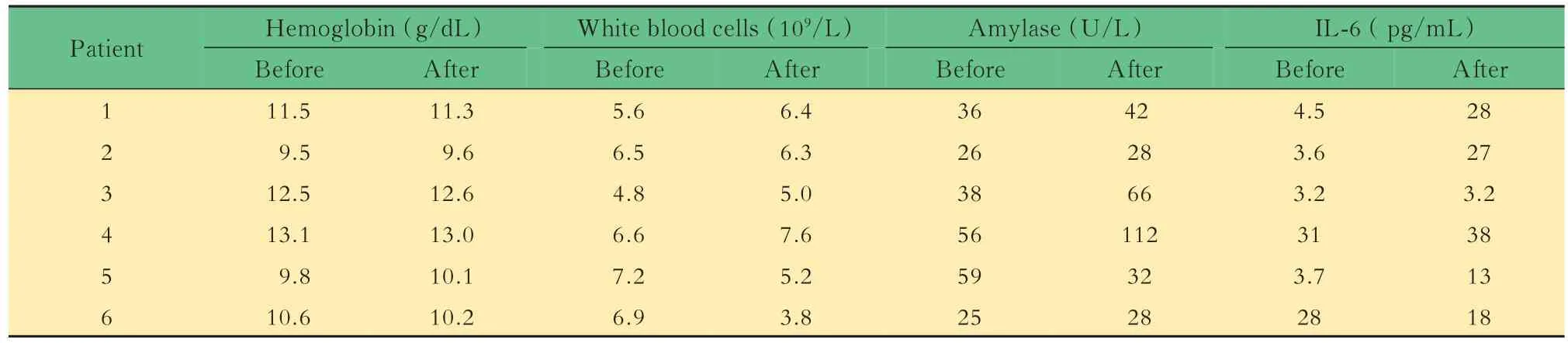
表2 晚期胰腺患者的术前及术后1 天实验室检查结果Tab 2 Laboratory test results before and 1 d after RFA for advanced pancreatic cancer
术后1 个月影像学随访显示,Habib EUS RFA针在晚期胰腺癌病灶中形成低密度坏死区(图3~4)。其中1 例患者的胰头癌直径达到5.5 cm(图4A),我们采用CT 引导下多点进针消融肿块(图4B、4C),1 个月后 MRI 随访,病灶中心区域也出现了明显的坏死区(图4D)。
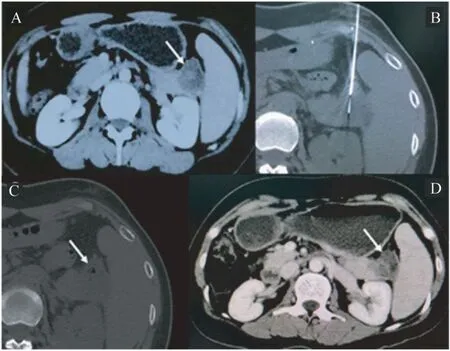
图3 1 例胰尾癌行单点消融及1 个月的随访结果Fig 3 Single-point RFA and one-month follow-up for a patient with pancreatic cancer at the tail of the pancreas

图4 1 例胰头癌行多点消融以及1个月的随访结果Fig 4 Multi-point RFA and one-month follow-up for a patient with pancreatic cancer at the head of the pancreas
讨 论
RFA 治疗晚期胰腺癌不能起到根治效果,但是具有以下治疗作用[9-12]:(1)通过肿瘤局部坏死,减轻肿瘤负荷,延长患者生存期;(2)具有一定的镇痛效果,减少镇痛药物摄入量;(3)激活机体抗肿瘤免疫。但是,胰腺是一个解剖上非常特殊的脏器,体积较小,位于腹腔深部,周围有胃肠道、胆道、腹腔干、肠系膜上动脉和门静脉等重要组织结构。胰腺组织极易损伤,这些因素导致晚期胰腺癌RFA 穿刺定位困难,容易引起胰腺炎、胰瘘、门脉静血栓形成、十二指肠穿孔、胆瘘等并发症。因此,RFA 治疗晚期胰腺癌的临床应用远远落后于其他实体肿瘤。
外科手术中,RFA 可以选择更为有利的消融穿刺途径;超声显像更为清晰;术中可以采取相应措施防止热损伤;可以即时处理热消融引起的并发症,目前已成为晚期胰腺癌RFA 最常用的治疗途径[13]。2014 年之前公开发表的胰腺癌 RFA 临床报道,病例数大于5 例、随访资料较为完整的研究均采用手术途径[14]。由于外科手术本身创伤较大,在降低RFA 相关并发症的同时,增加了外科手术相关并发症。据报道,手术途径RFA 治疗晚期胰腺癌的RFA 并发症发生率约占总体并发症的50%[14-15]。
超声内镜(endoscopic ultrasound,EUS)是将内镜和超声相结合的消化道检查技术,近年来超声内镜下的介入性治疗已经是国内外内镜技术的热点之一。EUS 导引RFA 治疗晚期胰腺癌时,消融针通过内窥镜途径送达胃腔或十二指肠内,经胃壁或肠壁穿刺胰腺病灶,损伤小于外科术中RFA。超声探头和胰腺仅间隔一层胃壁或肠壁,可以清晰显示胰腺肿瘤,而且超声导引可以实时监测消融进展情况,根据消融范围的变化及时调整消融参数[16]。多项小样本的前瞻性临床研究均证实了EUS 导引RFA 治疗晚期胰腺癌的可行性和安全性[17-21]。EUS导引RFA 可以安全地在胰腺病灶内产生凝固性坏死区,术后并发症通常较轻且具有自限性,无需临床干预,例如轻度腹痛、少量腹水、一过性血淀粉酶升高等[20-21]。
考虑到EUS 引导下RFA 操作距离较长(Haibib EUS RFA 针长达190 cm),操作技术较为复杂,通常只能进行一个针道消融[20]。而Haibib EUS RFA 针直径仅0.33 mm,可以通过21G 的穿刺针,理论上穿刺通过除动脉以外的组织脏器,均不会产生并发症,为经皮穿刺提供了安全性和便捷性。因此,我们尝试改变穿刺途径,在CT 导引下将Haibib EUS RFA 针经皮穿刺治疗晚期胰腺癌。
本研究CT 引导下经皮穿刺RFA 的成功率为100%,所有患者治疗后均无严重的治疗相关不良事件(如急性胰腺炎、出血,胰瘘等)发生。本研究中使用的Habib EUS RFA 针直径仅为1F,相当于0.33 mm,直径小于常用的传统射频针(18~19G,约1.07~1.27 mm)。其可以通过22G 穿刺针,穿刺系统直径较外科手术中的消融针小,因此可以明显减少穿刺相关并发症[14-15],为经皮穿刺提供了安全性和便捷性。此外胰腺组织对热损伤敏感,动物实验表明,Haibib EUS RFA 针在正常胰腺组织中的消融范围(直径 6~8 mm)[19,22]也较普通消融针小,对正常胰腺组织损伤更小,所有动物均未出现消化系统症状和行为异常[19]。本研究中,胰腺癌患者RFA治疗后仅出现血淀粉酶一过性升高,术后5 天即降至正常,本研究结果和动物实验保持一致,仅是一过性淀粉酶升高。Pai 等[23]使用 Habib EUS RFA 针在EUS 引导下治疗8 例胰腺肿瘤患者,其中6 例为囊性肿瘤,2 例为神经内分泌肿瘤。治疗后3~6 个月,2 例囊性肿瘤病灶完全消失,4 例直径缩小48.4%。2 例神经内分泌肿瘤血供明显减少并伴有中央坏死。所有患者均未出现严重并发症。表明Habib EUS 消融针在不同的引导途径中安全性都较传统RFA 针好。
CT 导引穿刺可以同时建立多个针道,使有效范围较小的治疗方法应用于体积较大的肿瘤,例如碘 125 粒子植入术[24],这是 EUS 导引无法达到的。虽然RFA 治疗晚期胰腺癌并不要求达到肿瘤完全坏死的目的,但8 mm 的消融直径是远远不够的。本研究中1 例患者胰头癌的直径达到5.5 cm,我们采用多点进针的方法(图4),扩大了Haibib EUS RFA 针的消融范围,使其可以用于体积较大的瘤体。一方面拓展了Haibib EUS RFA 针的适用范围,另一方面也为体积较大的胰腺癌提供了安全有效的局部治疗手段。
本研究中的6 例病例术后1 个月的影像随访资料显示,在患者的病灶消融区域观察到低密度坏死区,证明RFA 对晚期胰腺肿瘤有减轻肿瘤负荷的效果。虽然本研究对患者进行了后期随访,但是由于病例数较少且部分发生远处转移,因此需要入组更多的病例,进一步研究患者的生存获益。局部消融治疗可以缓解部分患者因胰腺肿瘤引起的疼痛。6例患者中有4 例RFA 后疼痛明显缓解,但是维持时间不到1 个月,之后患者是否需要再次接受RFA 治疗,需要进一步研究。
综上所述,CT 引导的Habib EUS RFA 可用于晚期胰腺癌的治疗。RFA 术为不能切除的胰腺癌患者提供了一种新的治疗方法,并有望成为其综合治疗的一部分。

