均相法检测脂蛋白残粒胆固醇的建立及初步临床应用
王 蓉, 黄克亮, 张建华, 张 欣
(1. 上海交通大学医学院附属第九人民医院黄浦分院检验科,上海 200011;2. 上海交通大学医学院化学教研室,上海 200025)
脂蛋白残粒(remnant lipoprotein,RLP)是乳糜微粒和极低密度脂蛋白(very lowdensity lipoprotein,VLDL)在脂蛋白脂肪酶(lipoprotein lipase,LPL)的作用下,大量三酰甘油(triglyceride,TG)、磷脂、载脂蛋白(apolipoprotein,apo)A和apo C水解后形成的富含胆固醇酯和apo E的相对较小的高密度残粒,是富含TG的脂蛋白 (triglyceride-rich lipoprotein,TRL)[1]。有研究结果显示,RLP与动脉粥样硬化的发生、发展密切相关,动脉粥样硬化会使RLP、TG和VLDL浓度升高,导致心脑血管疾病的发生[2]。目前,检测血清脂蛋白残粒胆固醇(remnant lipoprotein-cholesterol,RLP-C)浓度的方法较多,如超速离心法、琼脂糖凝胶电泳法、聚丙烯酰胺凝胶电泳法(polyacrylamide gel electrophoresis,PAGE)、免疫沉淀分离法等。超速离心法技术要求高,很难常规开展[3],琼脂糖凝胶电泳难以对RLP-C进行准确的定量检测[4],PAGE灵敏度欠佳。本研究参考MIYAUCHI等[5]报道的检测血清RLP-C浓度的方法(均相法),以表面活性剂聚氧乙烯-聚氧丁烯嵌段共聚物(polyoxyethylenepolyethylene oxide butene,POE-POB)为屏蔽剂,建立检测RLP-C浓度的方法并初步进行临床应用评价。
1 材料和方法
1.1 研究对象
选取2019年3—11月上海交通大学医学院附属第九人民医院黄浦分院混合性高脂血症患者116例(混合性高脂血症组),其中男46例、女70例,年龄24~88岁。纳入标准:根据《中国成人血脂异常防治指南(2016年修订版)》[6]中的临床分类方法,将总胆固醇(total cholesterol,TC)、TG浓度均升高的患者(TC≥6.22 mmol/L、TG≥1.7mmol/L)纳入混合性高脂血症组。另选取同期上海交通大学医学院附属第九人民医院黄浦分院体检健康者50名(正常对照组),其中男28名、女22名,年龄24~88岁。
1.2 方法
采集所有研究对象空腹12 h的静脉血5 mL。采用氧化酶法测定TC、TG,试剂盒购自德国西门子公司。采用免疫比浊法测定apo C2,试剂盒购自宁波瑞源公司。采用均相法检测RLP-C,参比试剂购自日本协和公司,自建方法试剂由本实验室自配,检测仪器为ADVIA CENTAUR XPT全自动生化分析仪(德国西门子公司)。TC、TG质控品(批号:M806001~M806003)由上海市临床检验中心提供,apo C2质控品(批号:201903260)购自宁波瑞源公司,RLP-C质控品(批号:145AFC)购自日本协和公司。
1.3 自建方法试剂的配制
1.3.1 3-(N-玛代琳)丙磺酸(3-morpholinopropanesulfonic acid,MOPS)缓冲液的配制 MOPS 4.12 g,无水醋酸钠0.656 g,乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)0.584 5 g,蒸馏水800 mL,加入2 mol/L NaOH溶液,调节pH值至6.8。
1.3.2 试剂1配制 硫酸钠1 g/L,牛血清白蛋白1 g/L,POE-POB(由上海交通大学医学院化学教研室合成)8 g/L,N-乙基-N-(2-羟基-3-磺丙基)-3-甲基苯胺钠盐0.15 g/L,过氧化物酶5 kU、抗维生素C氧化酶200 U,溶于500 mL MOPS缓冲液(pH值6.8)中。
1.3.3 试剂2配制 4-氨基安替比林0.05 g/L,氧丙烯烃基醚2 g/L,过氧化物酶1 kU,胆固醇酯酶100 U,胆固醇氧化酶300 U,磷脂酶-D 500 U,溶于100 mL MOPS缓冲液(pH值6.8)中。
1.4 自建方法的测定原理
POE-POB可与高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(lowdensity lipoprotein,LDL)、VLDL等脂蛋白结合,修饰脂蛋白结构,有效屏蔽非脂蛋白残粒,经过特殊修饰的脂蛋白残粒与水在胆固醇酯酶的作用下生成游离胆固醇和脂肪酸,游离胆固醇在胆固醇氧化酶的作用下,生产胆甾烯酮和双氧水,并经Trinder反应产生色源显色,通过测定红色醌亚胺色源在主波长600 nm/副波长700 nm下的吸光度(A)值变化,计算出血清RLP-C浓度。
1.5 RLP-C的检测参数
主波长600 nm,副波长700 nm,温度37 ℃,血清7.8 μL,试剂1 75 μL,试剂2 25 μL,用ΔA值表示反应速度。RLP-C浓度的计算公式为:RLP-C(mg/L)=ΔA样本/ΔA校准品×C校准品;式中ΔA样本为样本A值的变化值;ΔA校准品为校准品A值的变化值;C校准品为校准品浓度(mg/L)。
1.6 统计学方法
采用SPSS 15.0软件进行统计分析。呈正态分布的数据以±s表示,组间比较采用t检验。呈非正态分布的数据以中位数(M)[四分位数(P25~P75)]表示,组间比较采用Mann-WhitneyU检验。采用Pearson相关分析评估各项目之间的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 实验条件的选择
2.1.1 缓冲液选择 配制浓度均为0.02 mol/L的MOPS缓冲液、羟乙基哌嗪乙磺酸{2-[4-(2-hydroxyethyl)-1-piperazinyl] ethanesulfonic acid,HEPES}缓冲液、Tris-HCl缓冲液,其他条件不变,检测3份不同的血清样本。结果显示,MOPS缓冲体系的ΔA值最高。因此,最佳缓冲体系确定为MOPS缓冲体系。见图1。
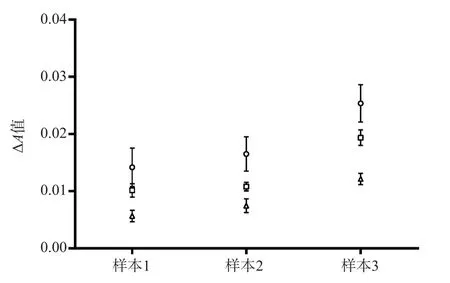
图1 不同缓冲体系每分钟的ΔA值
2.1.2 反应最适pH值选择 MOPS缓冲体系固定为20 mmol/L,配制pH值4.0~8.0的MOPS缓冲液,同时与1份样本作用,结果显示pH值6~7时A值最高,反应活性最高。因此,反应最适pH值确定为6.8。见图2。
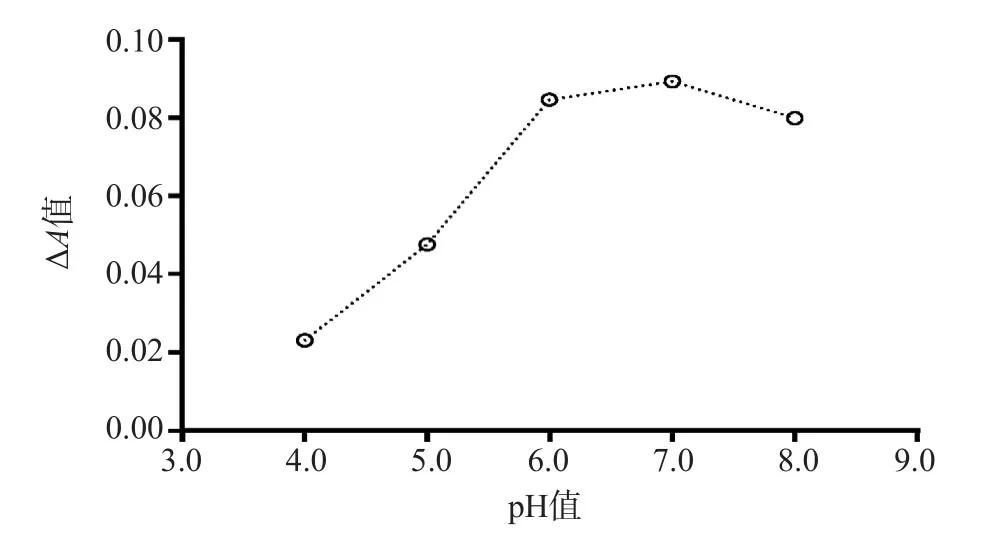
图2 不同pH值的MOPS缓冲液每分钟的ΔA值
2.1.3 最适MOPS缓冲体系的选择 在pH值6.8的条件下,分别用0.005、0.01、0.015、0.02、0.025、0.03、0.06 mol/L MOPS缓冲液配制试剂,测定1份混合血清。结果显示,反应速度(ΔA值)随着MOPS浓度的增加而增加,当MOPS>0.02 mol/L后,其浓度对反应速度(ΔA值)影响不大。最终选择的缓冲液浓度为0.02 mol/L。见图3。
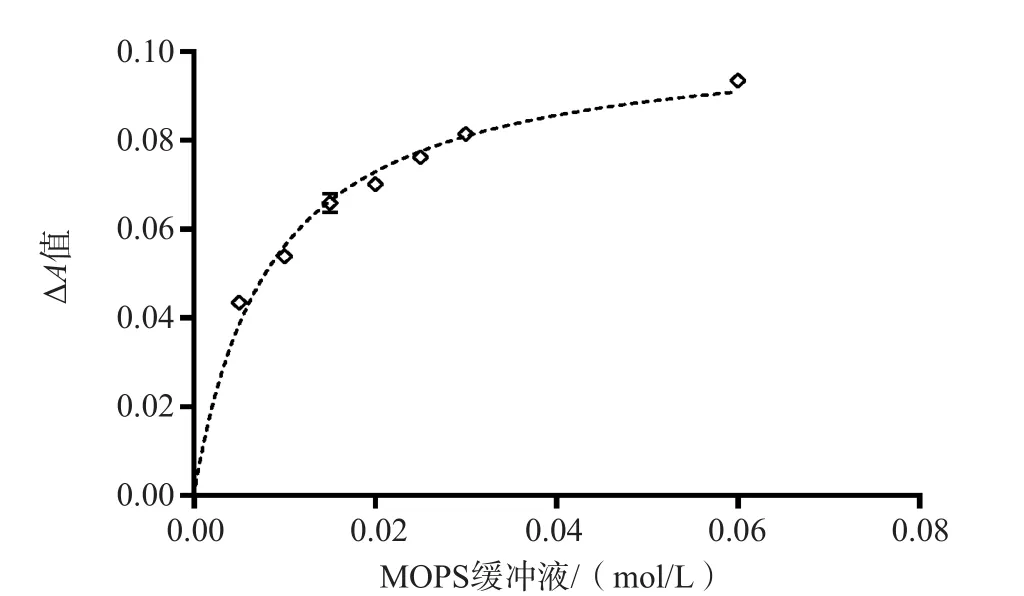
图3 不同浓度MOPS缓冲液每分钟的ΔA值
2.1.4 POE-POB浓度的选择 分别采用浓度为1、2、4、6、8、12 g/L POE-POB与20 mmol/L MOPS缓冲液组成反应体系,测定10份混合血清。结果显示,10份混合血清样本的RLP-C浓度随POE-POB浓度的升高而降低,但POE-POB>8 g/L后对RLP-C浓度的影响较低,因此POEPOB最适浓度为8 g/L。见图4。
2.1.5 不同浓度RLP-C对POE-POB的屏蔽实验 将RLP-C浓度分别为725、441、163 mg/L的血清样本按0.1、0.2、0.3、……、1.0倍稀释,采用8 g/L POE-POB及20 mmol/L MOPS缓冲液组成的反应体系进行检测。结果显示,3份血清样本检测结果均呈线性,r值分别为0.998 6、0.998 7、0.993 5,提示POE-POB浓度为8 g/L已足够。见图5。
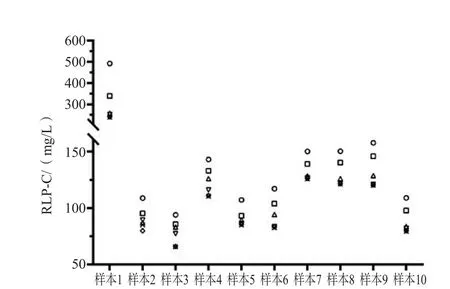
图4 不同浓度POE-POB对RLP-C浓度的影响
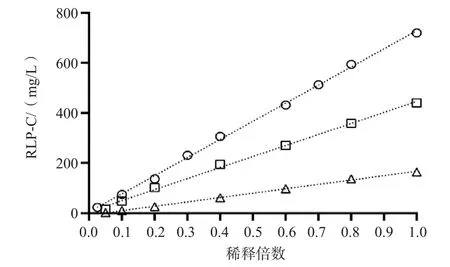
图5 不同浓度RLP-C对POE-POB的屏蔽实验
2.1.6 反应时间的选择 取RLP-C为254 mg/L的样本,加入试剂1混合孵育5 min,再加入试剂2混合孵育5 min,每14 s读取1次A值,直至10 min。结果显示5~10 min时,A值呈线性(r=0.998 6),故确定延迟时间为5 min,测定时间为5 min。见图6。
2.1.7 POE-POB屏蔽性能验证 采用参比试剂与自配试剂分别检测98例样本,RLP-C检测结果分别为46(30~79)、66(51~110)mg/L。2种方法的相关性良好,回归方程为Y=-1.255+0.846X(r=0.980),见图7。绘制Bland-Altman散点图,结果显示98例样本中仅有4例(4.08%)检测结果的偏移较大,不在±1.96s范围内。见图8。
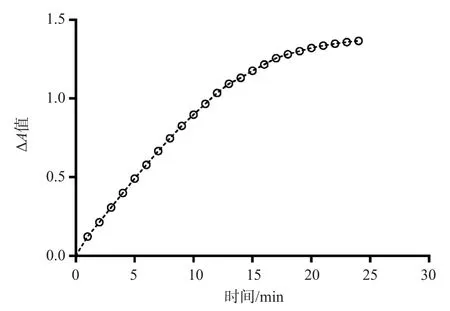
图6 酶促反应连续监测时间的ΔA值
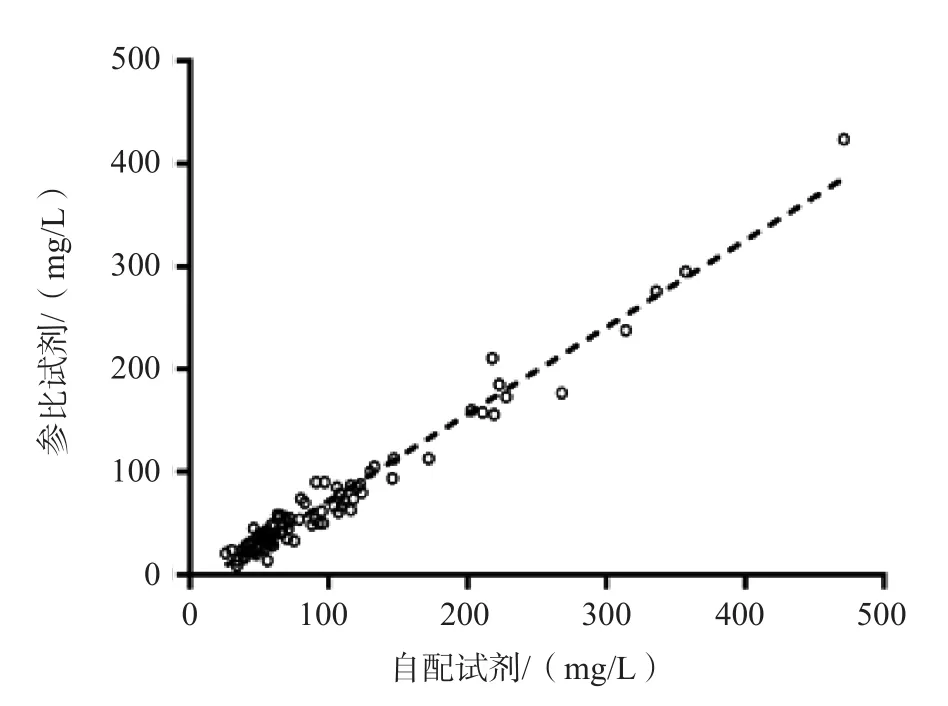
图7 自配试剂与参比试剂检测RLP-C的线性
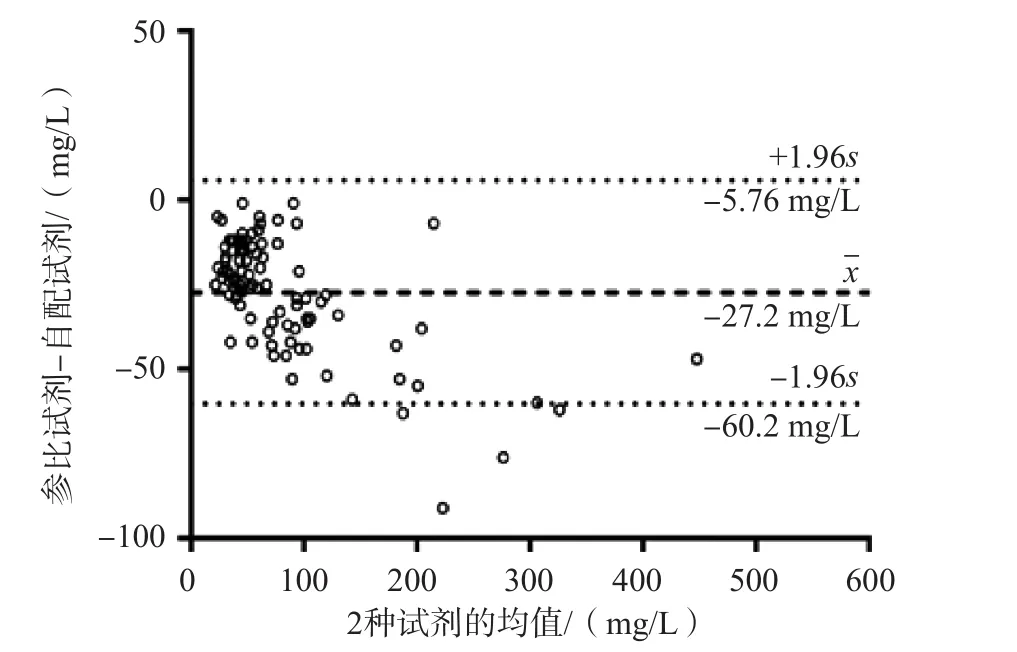
图8 自配试剂与参比试剂的Bland-Altman散点图
2.2 精密度实验
取RLP-C浓度为49、153和267 mg/L的3份样本,分别进行批内、批间各20次测定。结果显示,批内平均变异系数(coefficient of variation,CV)为3.37%,批间平均CV为4.91%。见表1。
2.3 稳定性试验
将自配试剂放入4 ℃冰箱,以每天新鲜配制的试剂作为对照。将血清分装成30份后-20 ℃保存,每天取1份样本复融后分别用上述2种试剂检测试剂中酶自然失活的情况,共记录30 d。结果显示30 d内,4 ℃储存的试剂检测血清样本的A值从0.161降至0.159。因此,自配试剂开瓶后放置4 ℃冰箱,可稳定1个月。
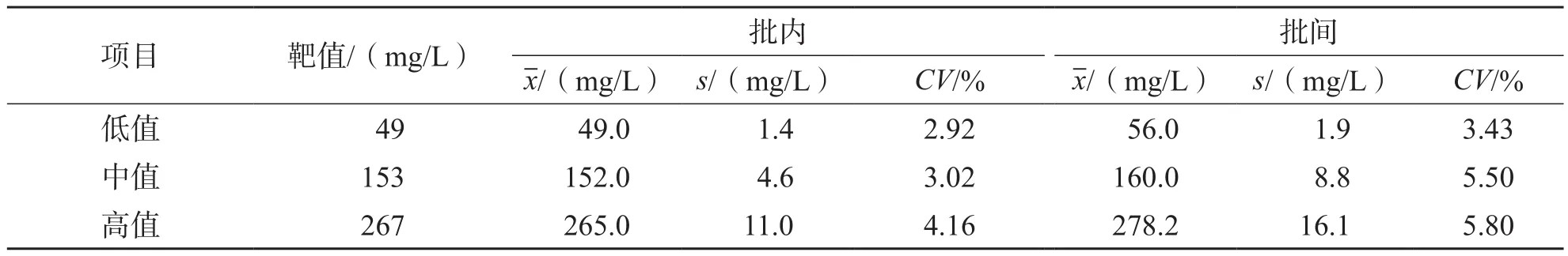
表1 精密度实验结果
2.4 反复冻融试验
选取8份新鲜血清样本,封口,-80 ℃冷冻保存30 min后取出,置于室温(25 ℃)下融解,并检测血清RLP-C浓度,反复冻融4次。结果显示,8份血清样本每次冻融后RLP-C浓度的平均下降比例为3.00%~14.58%。反复冻融对血清RLP-C浓度的影响较大。见表2。
2.5 初步临床应用
2.5.1 混合性高脂血症组与正常对照组各项血脂指标的比较 混合性高脂血症组血清RLP-C、TG、apo C2、TC浓度均高于正常对照组(P<0.001)。见表3。
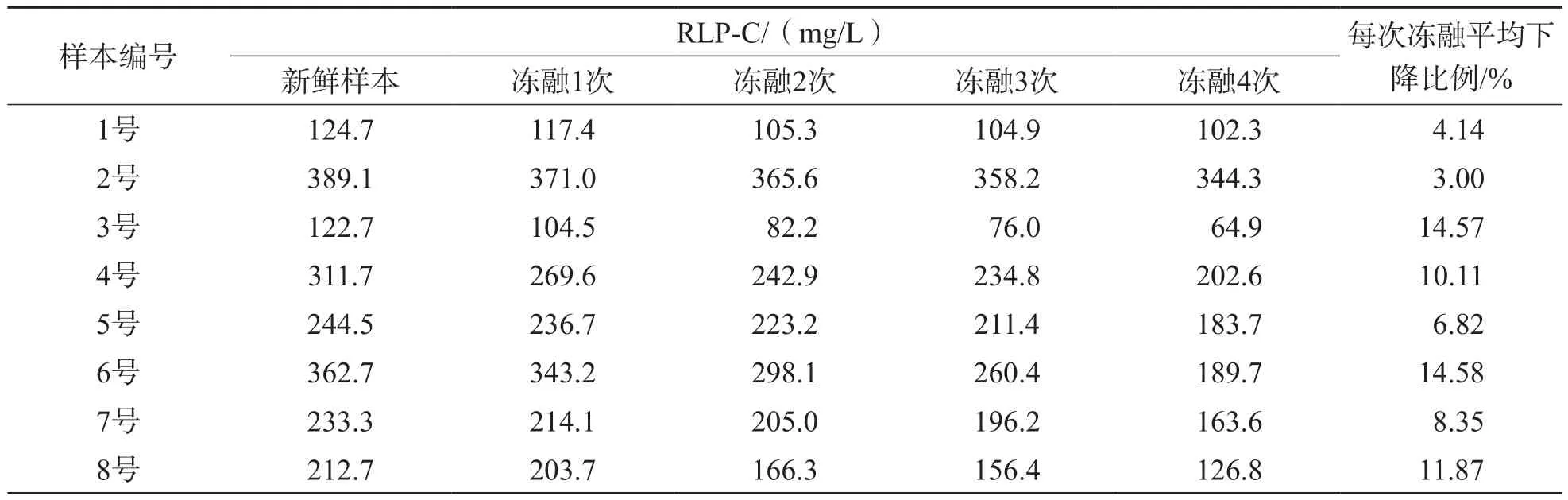
表2 8份血清样本反复冻融对RLP-C浓度的影响

表3 混合性高脂血症组与正常对照组血清RLP-C、TG、apo C2和TC浓度比较
2.5.2 混合性高脂血症组RLP-C、TG、apo C2、TC之间的相关性分析 RLP-C与TG呈正相关(r=0.496,P<0.001),与apo C2、TC均无相关性(r值分别为0.157、-0.090,P>0.05)。TG与apo C2呈正相关(r=0.650,P<0.01),与TC无相关性(r=-0.010,P>0.05)。apo C2与TC无相关性(r=-0.141,P>0.05)。
3 讨论
RLP的致动脉粥样硬化作用被认为比LDL更强,其与多种心血管疾病的发生、发展密切相关[7-8],但其致病机制尚不完全清楚。有研究结果显示,RLP可能通过损伤内皮细胞的结构和功能,诱导单核细胞黏附于血管内皮,促进血栓形成,增强血小板活化并刺激血管平滑肌细胞的增殖[9]。与LDL不同,RLP可被巨噬细胞直接吞噬而不被氧化,导致泡沫细胞的形成[10]。血清RLP-C、TG、VLDL-C浓度升高和HDL-C浓度降低可能是动脉粥样硬化和心脑血管疾病的独立危险因素[11-12]。因此,RPL对心脑血管疾病的临床预测和评估具有重要价值。本研究自行配制了检测RLP-C的试剂,将自配的表面活性剂POE-POB和磷脂酶D协同作用,选择性地修饰RLP,磷脂酶D则作用于脂蛋白磷脂,催化水解极性区,使其溶于反应体系中,形成溶解态的残粒样脂蛋白,其中的胆固醇酯参与后续反应,在表面活性剂、磷脂酶D、胆固醇酯酶等多种酶的共同作用下将除RLP以外的其他脂蛋白排除,使非脂蛋白残粒不溶于反应体系中。自建方法的检测结果与参比试剂相差约14%,但相关性良好(r=0.980),原因可能与2种试剂使用的表面活性剂不同有关。通过Bland-Altman散点图可以发现,2种方法超过±1.96s范围的数据比例<5%,说明2种方法可以相互替代,证明POE-POB对于非脂蛋白残粒具有特异性屏蔽作用。
本研究结果显示,自建方法的最佳缓冲液为0.02 mol/L MOPS缓冲液,最佳pH值为6.8,POE-POB浓度为8 g/L,检测时间为10 min,批内CV为3.37%,批间CV为4.91%,试剂稳定性良好。值得注意的是,试剂1和试剂2配制时因均含有表面活性剂,颗粒状试剂在水溶液中不易溶解,需充分搅拌溶解,且注意消泡。本研究结果还显示,反复冻融对血清RLP-C浓度的影响较大,测定值明显下降,因此用于RLP-C检测的样本宜新鲜,不宜反复冻融。
本研究采用自建方法检测混合性高脂血症患者和正常对照者的血清RLP-C浓度,结果显示混合性高脂血症患者血清RLP-C浓度高于正常对照组(P<0.001),且RLP-C与TG呈正相关(r=0.496,P<0.001),与宋云霄等[13]的研究结果一致。这说明RLP-C是较为恒定的生物标志物。后续将对高脂血症患者按性别进行分层分析,以深入了解该指标在高脂血症中的作用。
综上所述,本研究选用的表面活性剂POEPOB对脂蛋白残粒有较好的选择特异性,基于此建立的检测方法简便、快速,敏感性高、稳定性好,且适用于全自动生化分析仪。

